MODIFICA LAS INDICACIONES DE LOS PRODUCTOS FARMACÉUTICOS QUE CONTIENEN RISPERIDONA, INCORPORA ADVERTENCIAS EN LOS FOLLETOS DE INFORMACIÓN AL PROFESIONAL Y PACIENTE Y DEJA SIN EFECTO LA RESOLUCIÓN Nº 4.654/15 EXENTA
Núm. 1.078 exenta.- Santiago, 18 de marzo de 2021.
Visto estos antecedentes:
1. El comunicado de la Agencia Canadiense del Medicamento, Health Canada, con fecha 18 de febrero de 2015, en relación a la restricción de las indicaciones de uso para risperidona en cuadros de demencia sólo para el tratamiento sintomático de corto plazo de la agresión o síntomas psicóticos en pacientes con demencia severa de tipo Alzheimer que no responden a estrategias terapéuticas no farmacológicas y cuando existe un riesgo de dañarse a sí mismo o a otras personas, con lo cual, risperidona ya no se indica para el tratamiento de otros tipos de demencia, tales como las de origen vascular o de tipo mixto, debido a que la revisión de la información de seguridad realizada por el propietario del producto indica que existe un mayor riesgo de eventos adversos cerebrovasculares en pacientes con demencia vascular o de tipo mixto, comparados con aquellos con demencia de tipo Alzheimer;
2. La decisión de la Comisión Europea, con fecha de 7 de octubre de 2008, ante la recomendación del CHMP (Comité para Productos Farmacéuticos de uso humano) de la Agencia Europea de Medicamentos, en relación a armonizar la ficha técnica, el etiquetado y la información al usuario para los productos farmacéuticos que contienen risperidona, de manera que las indicaciones aprobadas no contemplaran el manejo de los síntomas en cuadros de demencia diferentes a los de tipo Alzheimer;
3. Las indicaciones aprobadas para risperidona en la Agencia de Medicamentos y Alimentos de Estados Unidos (FDA), las que no incluyen el tratamiento de síntomas relacionados a demencia;
4. Las indicaciones aprobadas para risperidona en la Agencia Canadiense del Medicamento, Health Canada, que sólo incluyen el manejo sintomático de la agresión y síntomas psicóticos en la demencia severa del tipo Alzheimer;
5. La revisión rutinaria de Farmacovigilancia sobre información de seguridad de medicamentos, en la cual se detectó que las indicaciones aprobadas vigentes en Chile para los productos farmacéuticos que contienen risperidona son, por un lado, heterogéneas, y por otro, en varios casos contemplan el tratamiento de la demencia de forma genérica, cubriendo, por ende, demencia de otro tipo, además de la de Alzheimer;
Considerando:
1. Que, risperidona es un medicamento antipsicótico, frecuentemente usado en el tratamiento de cuadros psiquiátricos, existiendo, a nivel nacional, un elevado número de productos farmacéuticos (66 registros sanitarios) que lo contienen;
2. Que, los eventos cerebrovasculares son episodios por lo general serios, que tienen el potencial de poner en riesgo la vida de los pacientes o de producir secuelas permanentes;
3. Que, es necesario aclarar el alcance de la resolución exenta Nº 4.654 de fecha del 27 de noviembre de 2015, la cual modifica las indicaciones de los productos farmacéuticos que contienen risperidona e incorpora advertencias en folletos de información al profesional y al paciente, sin señalar vías de administración, ni registros sanitarios involucrados;
4. Que, resulta necesario ajustar las indicaciones, de manera uniforme de los productos que contienen risperidona, para mejor manejo de la información y mejor resguardo de la seguridad de los pacientes; y
Teniendo presente:
Las disposiciones de los artículos 96º y 97º del Código Sanitario; los artículos 63º, 64º, 71º, 218º, 219º y 220º del Reglamento del Sistema Nacional de Control de los Productos Farmacéuticos de uso Humano, aprobado por decreto supremo Nº 3 de 2010 del Ministerio de Salud; los artículos 59º letra b) y 61º letra b), del DFL Nº 1 de 2005, y las facultades delegadas por la resolución exenta Nº 2.460 de 13 de octubre de 2020, del Instituto de Salud Pública de Chile, dicto la siguiente:
Resolución:
1. Determínase que, en adelante, los productos farmacéuticos que contienen Risperidona, tendrán las siguientes indicaciones aprobadas:
Risperidona de administración oral:
. Tratamiento agudo y de mantenimiento de la esquizofrenia.
. Como monoterapia para el tratamiento a corto plazo de la manía aguda o episodios mixtos asociados a desorden bipolar y como terapia adyuvante a estabilizadores de ánimo en el manejo de episodios maniáticos agudos o mixtos en trastorno bipolar.
. El tratamiento a corto plazo (hasta 6 semanas) de la agresión persistente que puede aparecer en pacientes con demencia de tipo Alzheimer de moderada a grave que no responden a otras medidas no farmacológicas y cuando hay un riesgo de daño para ellos mismos o para los demás; no se ha demostrado efecto sobre otras alteraciones de la conducta en estos pacientes o sobre el estado mismo de la enfermedad de Alzheimer.
. En el tratamiento sintomático a corto plazo (hasta 6 semanas) de la agresión persistente en los trastornos de la conducta en niños de 5 años de edad en adelante y adolescentes con un funcionamiento intelectual por debajo de la media o retraso mental diagnosticados de acuerdo a criterios DSM - IV, en los que la gravedad de la agresión u otros comportamientos perturbadores requieran tratamiento farmacológico. En este caso, la farmacoterapia debe formar parte de un programa terapéutico más exhaustivo, con medidas educacionales y psicosociales; a la vez, se recomienda su prescripción por un especialista en neurología infantil y en psiquiatría para niños y adolescentes o por médicos familiarizados con el tratamiento de los Trastornos de la Conducta en niños y adolescentes.
Risperidona inyectable:
. Tratamiento de la esquizofrenia.
. Como monoterapia o como terapia adjunta al litio o valproato para el tratamiento de mantenimiento del trastorno bipolar I.
Uso pediátrico: la seguridad y eficacia no están establecidas en pacientes menores de 18 años.
2. Instrúyese que, los titulares de registros sanitarios de productos farmacéuticos que contienen el principio activo Risperidona, deberán actualizar el folleto de información al profesional y folleto de información al paciente, de modo que contenga, al menos, la información que se indica a continuación:
Folleto de información al profesional:
ADVERTENCIAS
En ensayos controlados con placebo realizados en pacientes de edad avanzada con demencia, se observó una incidencia significativamente mayor de accidentes cerebrovasculares (aproximadamente 3 veces más), como ictus (incluida la muerte) y ataques isquémicos transitorios, en aquellos tratados con Risperidona en comparación con los que recibieron placebo (media de edad: 85 años; rango: 73-97). Los datos agrupados de seis estudios controlados con placebo realizados principalmente en pacientes de edad avanzada (>65 años de edad) con demencia demostraron que se produjeron ACVs (graves y no graves, combinados) en el 3,3% (33/1009) de los pacientes tratados con risperidona y en el 1,2% (8/712) de los que recibieron placebo. La razón de probabilidades (intervalo de confianza exacto del 95%) fue de 2,96 (1,34, 7,50). Se desconoce el mecanismo de este aumento del riesgo. No es posible excluir un incremento del riesgo para otros antipsicóticos u otras poblaciones de pacientes. Este medicamento debe utilizarse con precaución en pacientes con riesgo de ataque cerebral.
El riesgo de accidentes cerebrovasculares fue significativamente mayor en pacientes con demencia mixta o vascular, comparado con aquellos que presentaban demencia de tipo Alzheimer. Por tanto, pacientes con otros tipos de demencia que no sea la de tipo Alzheimer no deben ser tratados con risperidona.
Se recomienda a los médicos que valoren los beneficios y riesgos del uso de risperidona en pacientes de edad avanzada con demencia, considerando los factores predictivos de riesgo de ictus en cada paciente. Se debe informar a pacientes/cuidadores para que notifiquen inmediatamente los signos y síntomas de posibles ACVs, como debilidad o entumecimiento repentino de cara, brazos o piernas, y problemas del habla o visuales. Se considerarán sin demora todas las opciones de tratamiento, incluida la suspensión de risperidona.
Risperidona sólo debe utilizarse a corto plazo en caso de agresión persistente en pacientes con demencia de tipo Atzheimer de moderada a severa, como complemento de tos tratamientos no farmacológicos cuya eficacia haya sido limitada o nula, y cuando exista el riesgo de daño para el paciente o para los demás.
Se debe valorar a los pacientes con regularidad, considerando la necesidad de continuar el tratamiento.
Folleto de información al paciente:
ADVERTENCIAS
Pacientes de edad avanzada con demencia:
En pacientes de edad avanzada con demencia, hay un aumento en el riesgo de tener un ataque cerebrovascular. No debe tomar risperidona si tiene demencia provocada por un ataque cerebrovascular.
Durante el tratamiento con risperidona debe ver a su médico con frecuencia.
Si usted o su cuidador observan un cambio súbito de su estado mental o la aparición repentina de debilidad o entumecimiento de la cara, los brazos o las piernas, sobre todo si es un lado, o habla confusa, aunque sea por poco tiempo, busque tratamiento médico inmediatamente. Puede ser signo de un ataque cerebrovascular.
3. Determínase que, los titulares de los registros sanitarios de los productos farmacéuticos que a continuación se indican, deberán, en caso que sus folletos no cumplan con lo instruido en los puntos anteriores, someter a la aprobación de este Instituto, los folletos de información al profesional y paciente que incluyan los aspectos señalados, en un plazo que no exceda de 90 días contados desde la fecha de publicación de esta resolución:
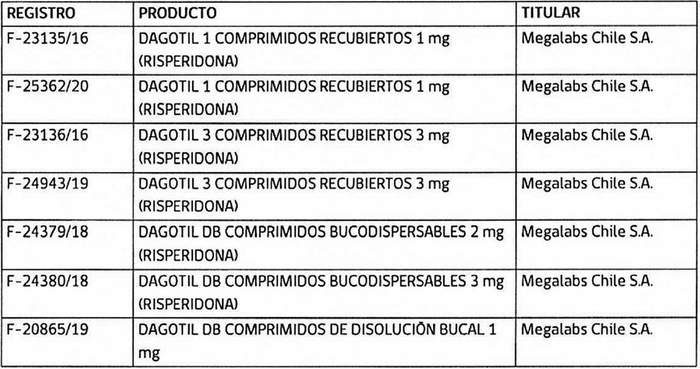
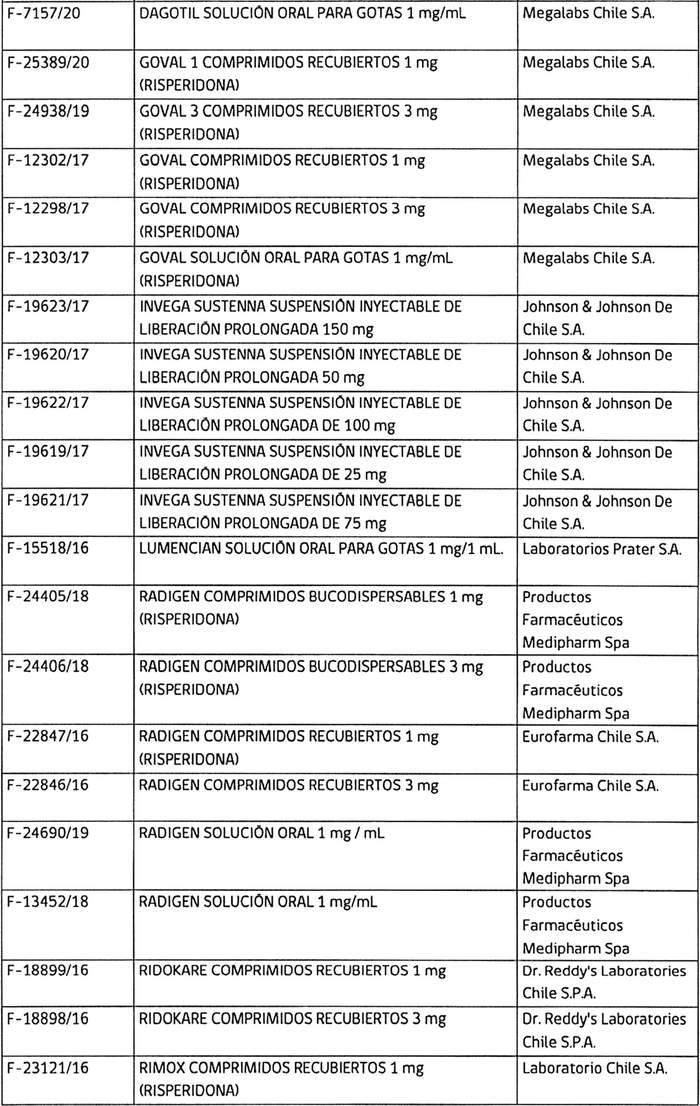
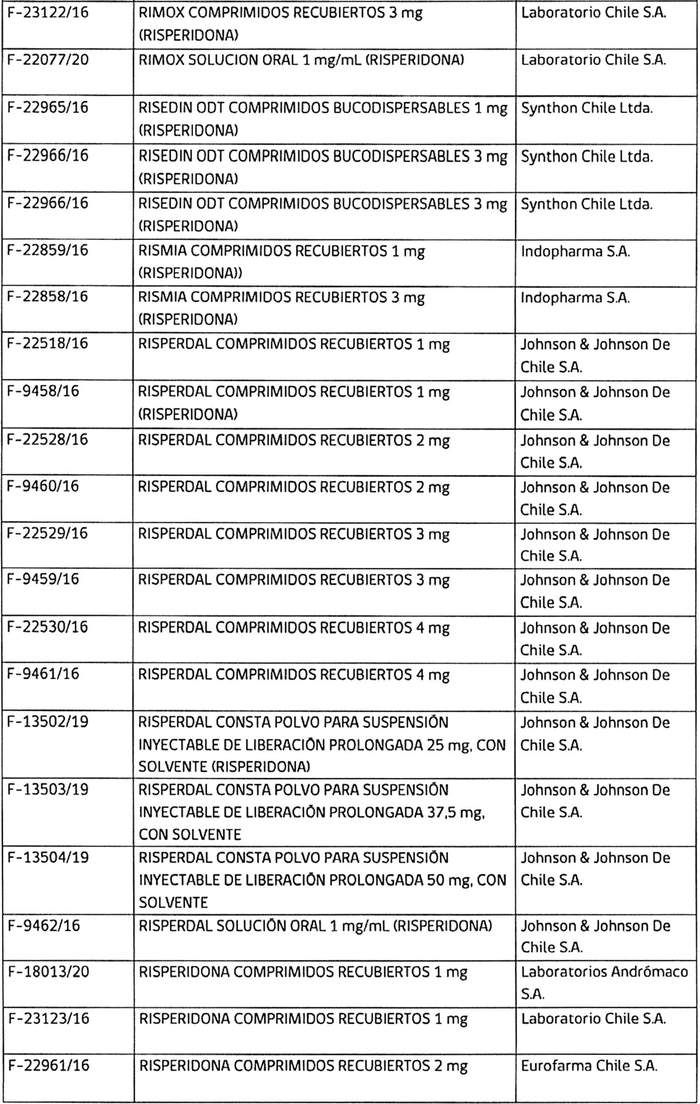
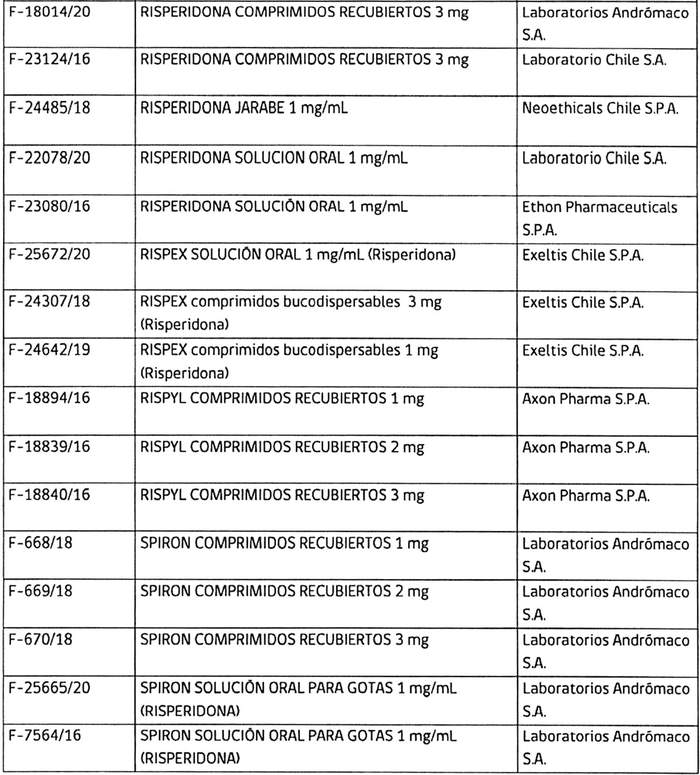
4. Establécese que todo registro sanitario de producto farmacéutico que contenga el principio activo risperidona, que se conceda o sea solicitado con posterioridad a la publicación de la presente resolución en el Diario Oficial, deberá cumplir con las exigencias establecidas en ésta.
5. Déjase sin efecto la resolución exenta 4.654 del 27 de noviembre de 2015.
Anótese, comuníquese y publíquese en el Diario Oficial y la página web del Instituto de Salud Pública de Chile.- Alexis Aceituno Ávarez, Jefe Subdepartamento de Registro Sanitario de Productos Farmacéuticos Bioequivalentes, Departamento Agencia Nacional de Medicamentos, Instituto de Salud Pública de Chile.