INSTRUYE ACTUALIZAR LOS FOLLETOS DE INFORMACIÓN AL PROFESIONAL Y PACIENTE DE LOS PRODUCTOS FARMACÉUTICOS QUE CONTIENEN NITROFURANTOÍNA EN SU COMPOSICIÓN
Núm. 3.431 exenta.- Santiago, 5 de agosto de 2022.
Visto estos antecedentes:
1. La alerta informativa de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), del 22 de julio de 2016, que comunicó la notificación de reacciones adversas graves, especialmente pulmonares (fibrosis, neumonitis intersticial) o hepáticas (hepatitis citolítica, hepatitis colestásica, hepatitis crónica, cirrosis), en tratamientos profilácticos prolongados o intermitentes de meses de duración con nitrofurantoína, y en consecuencia, fueron restringidas las indicaciones de uso y la duración de tratamiento, estando indicada en adelante para su uso exclusivo en el tratamiento curativo de cistitis agudas, no como profilaxis, con duración del tratamiento limitado a un máximo de 7 días, en mujeres a partir de los 3 meses de edad.
2. La decisión de la AEMPS, tras la revisión de las condiciones de uso autorizadas para nitrofurantoína, en relación a la actualización de la ficha técnica y el prospecto de los medicamentos comercializados que contienen dicho principio activo, resultando en la modificación y restricción de las indicaciones aprobadas y duración del tratamiento, y en la incorporación de nuevas contraindicaciones y precauciones de uso, debido a las notificaciones de reacciones adversas graves pulmonares y hepáticas, a raíz de su uso en tratamientos prolongados o intermitentes de meses de duración.
3. La Agencia Nacional para la Seguridad de Medicamentos y Productos de Salud de Francia (ANSM, por sus siglas en francés) reforzó la información sobre el uso adecuado de este antibiótico, cuyas indicaciones ya habían sido restringidas en el año 2012, debido al reporte de eventos adversos con efectos hepáticos graves y pulmonares. La agencia señaló que la nitrofurantoína se reserva para el tratamiento de infecciones del tracto urinario bajo, para tratamiento curativo y no preventivo de las infecciones documentadas, sólo en las mujeres, y no en los hombres, y por un período corto (5-7 días).
4. La evaluación realizada por la Sección Información de Medicamentos del Subdepartamento Farmacovigilancia, en la cual se detectó que las indicaciones aprobadas vigentes en Chile para los productos farmacéuticos que contienen nitrofurantoína, no se establece la duración máxima, mientras que la información de las secciones contraindicaciones y precauciones de los folletos de estos productos farmacéuticos, no están uniformes en contenido con los hallazgos descritos en los puntos anteriores.
5. Los reportes de sospechas de reacciones adversas asociadas a nitrofurantoína contenidos en la base de datos del Centro Nacional de Farmacovigilancia (CNFV), registrándose 125 notificaciones, desde enero de 2016 a diciembre 2021, de las cuales, cuatro están relacionadas con reacciones pulmonares (neumonitis intersticial, derrame pleural), tres de ellas clasificadas como serias, y tres a eventos hepáticos (insuficiencia hepática aguda y hepatitis fulminante), dos clasificados como serios, de los cuales uno tuvo desenlace fatal. Este último caso fue evaluado por el Comité de Farmacovigilancia, asignando la categoría de causalidad condicional, dado que era necesario contar con mayor información, para concluir el análisis del mismo.
Considerando:
1. Que, nitrofurantoína es un antibiótico que actúa inhibiendo varios sistemas enzimáticos en bacterias Gram-negativas (Escherichia coli) y Gram-positivas (Enteroccus faecalis, Staphylococcus saprophyticus, Streptococcus agalactiae (estreptococos grupo B), frecuentemente usado en el tratamiento de las infecciones en las vías urinarias, existiendo a nivel nacional productos farmacéuticos con registro sanitario vigente que lo contienen;
2. Que, los eventos pulmonares (fibrosis, neumonitis intersticial) y hepáticos (hepatitis citolítica, hepatitis colestásica, hepatitis crónica, cirrosis), son episodios por lo general de carácter serio, que tienen el potencial de poner en riesgo la vida de los pacientes o de producir secuelas permanentes;
3. Que, la Orientación Técnica para el Uso de Antibióticos en Infecciones Comunitarias de Manejo Ambulatorio, elaborada por el Ministerio de Salud de Chile, establece pautas para el tratamiento de diferentes infecciones, entre ellas, las ITU, para la cual una de las alternativas terapéuticas es el uso de nitrofurantoína por un número acotado de días, dependiendo del tipo de infección y paciente;
4. Que, resulta necesario restringir la duración del tratamiento a no más de 7 días para el tratamiento de las ITU bajas e incorporar nuevas contraindicaciones y precauciones de uso, de manera uniforme para los productos que contienen nitrofurantoína, con el fin de conseguir un mejor manejo de la información y resguardar la seguridad de los pacientes; y
Teniendo presente:
Las disposiciones de los artículos 96º y 97º del Código Sanitario; los artículos 63º, 64º, 71º, 218º, 219º y 220º del Reglamento del Sistema Nacional de Control de los Productos Farmacéuticos de Uso Humano, aprobado por decreto supremo Nº 3 de 2010 del Ministerio de Salud; los artículos 59º letra b) y 61º letra b), del DFL Nº 1 de 2005, y las facultades delegadas por la resolución exenta Nº 191, de 5 de febrero de 2021, del Instituto de Salud Pública de Chile, dicto la siguiente:
Resolución:
1. Instrúyese que, los titulares de registros sanitarios de productos farmacéuticos que contienen el principio activo nitrofurantoína, deberán actualizar los folletos de información al profesional y al paciente, de modo que contenga, al menos, la información que se indica a continuación:
POSOLOGÍA
La duración del tratamiento debe limitarse a 7 días como máximo. No debe utilizarse en tratamientos prolongados, continuos (más de 7 días) o intermitentes.
PRECAUCIONES Y CONTRAINDICACIONES
El uso de este medicamento está contraindicado en las siguientes situaciones:
. Hipersensibilidad a nitrofurantoína y otros nitrofuranos, o a alguno de los excipientes utilizados en su composición.
. Tratamientos prolongados, continuos (>7 días) o intermitentes.
. Insuficiencia renal con un aclaramiento de creatinina <45 mL/min.
. Porfiria aguda.
. Deficiencias de glucosa 6-fosfato deshidrogenasa (G6PD).
. En las dos últimas semanas de embarazo por el riesgo de anemia hemolítica fetal y en niños menores de 3 meses debido a la inmadurez del sistema enzimático eritrocitario.
Advertencias y precauciones especiales de empleo:
. El uso de nitrofurantoína en tratamientos prolongados (continuos o intermitentes), se ha asociado a la aparición de reacciones adversas pulmonares graves (fibrosis, neumonitis intersticial), hepáticas graves (hepatitis citolítica, hepatitis colestásica, hepatitis crónica, cirrosis, hepatotoxicidad) y síntomas de hipersensibilidad que han resultado graves en algunos casos, por lo que su uso es incompatible con el tratamiento profiláctico de las infecciones urinarias recidivantes.
. Hepatotoxicidad.
. Las reacciones hepáticas, incluidas hepatitis, hepatitis autoinmune, ictericia colestática, hepatitis crónica activa y necrosis hepática, se producen de forma rara. Se han notificado muertes. La manifestación de la hepatitis crónica activa puede ser insidiosa, por lo que los pacientes se deben someter a exámenes periódicos para identificar cambios en pruebas bioquímicas que sean indicativos de daño hepático. Si se produce hepatitis, el medicamento se debe retirar de inmediato y se deben tomar medidas adecuadas.
. El tratamiento con nitrofurantoína sólo debe iniciarse después de una cuidadosa evaluación de la relación beneficio/riesgo.
. Este medicamento puede administrarse con precaución en pacientes con un aclaramiento de creatinina situado entre 30-44 mL/min, en casos de antecedentes o sospecha de infección por microorganismos multirresistentes (Ej: enterobacterias productoras de beta-lactamasas de espectro extendido y/o carbapenemasas, enterococos resistentes a ampicilina). En esta situación se debe valorar el balance beneficio/riesgo.
. Nitrofurantoína debe ser utilizada con precaución en pacientes con enfermedad pulmonar, alteración de la función hepática, y predisposición a reacciones alérgicas.
. Se debe interrumpir el tratamiento si aparecen alteraciones en la función pulmonar, hepática, o síntomas de hipersensibilidad.
. Se han producido casos de neuropatías periféricas graves e irreversibles por lo que se recomienda interrumpir el tratamiento en caso de aparición de los primeros síntomas neurológicos (parestesias).
. La nitrofurantoína debe ser utilizada con precaución en pacientes con anemia, diabetes mellitus, desequilibrio electrolítico, debilidad o déficit de vitaminas B (en particular de ácido fólico).
. Las reacciones gastrointestinales pueden ser reducidas con la administración conjunta de este medicamento con comida o leche.
. Durante el tratamiento, la orina puede adquirir coloración amarillenta o marrón-pardo.
. Puede interferir con pruebas de glucosa en orina, pudiendo dar resultados falsos positivos.
2. Determínase que los titulares de los registros sanitarios de los productos farmacéuticos que a continuación se indican, deberán, en caso que sus folletos no cumplan con lo instruido en los puntos anteriores, someter a la aprobación de este instituto, los folletos de información al profesional y paciente que incluyan los aspectos señalados, en un plazo que no exceda de 90 días contados desde la fecha de publicación de esta resolución:
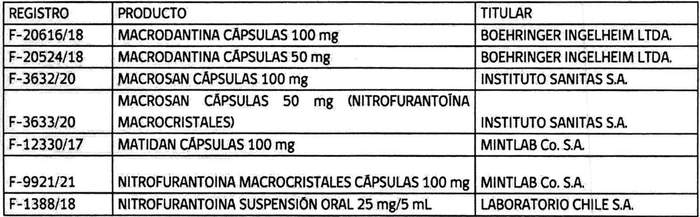
3. Establécese que todo registro sanitario de producto farmacéutico que contenga el principio activo nitrofurantoína, que se conceda o sea solicitado con posterioridad a la publicación de la presente resolución en el Diario Oficial, deberá cumplir con las exigencias establecidas en esta.
Anótese, comuníquese y publíquese en el Diario Oficial y en la página web del Instituto de Salud Pública de Chile.- Jorge Chávez Arrué, Jefe (S) Subdepartamento de Registro Sanitario de Productos Farmacéuticos Bioequivalentes, Departamento Agencia Nacional de Medicamentos, Instituto de Salud Pública de Chile.