ACTUALIZA FOLLETOS DE INFORMACIÓN AL PROFESIONAL Y AL PACIENTE E INSTRUYE EL ENVÍO DE UN PLAN DE MANEJO DE RIESGOS PARA LOS PRODUCTOS FARMACÉUTICOS QUE CONTIENEN ISOTRETINOÍNA EN SU COMPOSICIÓN
Núm. 3.888 exenta.- Santiago, 25 de julio de 2023.
Vistos estos antecedentes:
1. La publicación del 26 de octubre de 2017 de la Agencia Reguladora de Medicamentos y Productos Sanitarios de Reino Unido (MHRA, por su sigla en inglés), en la cual se informa el reporte de casos de disfunción sexual en la Unión Europea, principalmente relacionados con la disfunción eréctil y la disminución de la libido, en pacientes en tratamiento con isotretinoína;
2. La publicación del 26 de enero de 2020 de la Agencia Europea de Medicamentos (EMA, por su sigla en inglés) donde se presentaron las conclusiones científicas recomendando la inclusión, en la información de los productos que contienen isotretinoína (formulaciones orales), de la reacción adversa sequedad vulvovaginal, en base a lo señalado en el Informe de Evaluación del Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC, por sus siglas en inglés);
3. La recomendación de las agencias reguladoras internacionales MHRA, EMA, Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), y Health Canada, de incluir como nuevas reacciones adversas a la información de los productos farmacéuticos que contengan isotretinoína, disfunción sexual, incluyendo disfunción eréctil y disminución de la libido, y sequedad vulvovaginal;
4. El comunicado de la MHRA, de fecha 26 de abril de 2023, en el cual se entregan las recomendaciones realizadas por el Grupo de Trabajo de Expertos en Isotretinoína de la Comisión de Medicamentos Humanos para fortalecer la seguridad del tratamiento con isotretinoína, las cuales incluyen nuevas advertencias, la necesidad de monitoreo para los efectos secundarios psiquiátricos, la introducción de nuevos requisitos de monitoreo de los efectos secundarios en la función sexual y una supervisión adicional del inicio del tratamiento para pacientes menores de 18 años;
5. Los registros sanitarios vigentes que contienen el principio activo isotretinoína en su formulación, cuyos antecedentes técnicos se encuentran contenidos en la base de datos Gicona del Instituto de Salud Pública de Chile;
6. El informe técnico realizado, a solicitud del ISP, por el Centro de Información Toxicológica y de Medicamentos de la Pontificia Universidad Católica de Chile (Cituc) para la evaluación de la relación beneficio/riesgo para el medicamento isotretinoína en el tratamiento del acné, cuya conclusión es la recomendación de incorporar a los folletos de información de los medicamentos que contienen isotretinoína utilizados en el país, las reacciones adversas disfunción sexual, incluyendo disfunción eréctil y disminución de la libido, y sequedad vulvovaginal;
7. Los reportes de sospechas de reacciones adversas asociadas a isotretinoína en la base de datos del Centro Nacional de Farmacovigilancia desde enero de 2015 a marzo de 2023, que corresponden a un total de 72 reportes de reacciones adversas relacionadas al uso de isotretinoína, entre los cuales se informaron: 1 caso de sequedad vulvovaginal, 1 reporte de depresión, 1 de ansiedad y 1 de psicosis;
8. El programa de gestión de riesgos para la isotretinoína implementado en 1984, con el fin de minimizar el riesgo de defectos de nacimiento, el cual, a lo largo de los años, evolucionó a una Estrategia de Evaluación y Mitigación de Riesgos, vigente y solicitado a la fecha por la Food and Drug Administration de Estados Unidos, la EMA y Health Canada, entre otras agencias.
Considerando que:
1. El principio activo isotretinoína (ácido 13-cis-retinoico) es un compuesto retinoide derivado de la vitamina A, indicado en Chile para el tratamiento del acné severo en pacientes que no responden a tratamientos convencionales como agentes de limpieza o antibióticos;
2. El acné es una enfermedad crónica, inflamatoria e inmunomediada de la unidad pilosebácea, de alta prevalencia en adolescentes, la cual involucra la cara, el tronco y la espalda, pudiendo dejar cicatrices y afectar la calidad de vida, incluyendo la salud mental de los pacientes que la padecen, por lo que el tratamiento temprano, efectivo y seguro es clave para la resolución de la enfermedad y la prevención del impacto psicosocial y las cicatrices;
3. La isotretinoína está contraindicada en mujeres embarazadas o en edad fértil que desean quedar embarazadas, debido a que este fármaco es un potente teratógeno asociado con una alta frecuencia de defectos congénitos graves y potencialmente mortales, por lo que es necesario implementar medidas adicionales de seguridad para evitar este riesgo;
4. Existe la posibilidad de aparición de reacciones adversas relacionadas al uso de isotretinoína, de frecuencia no conocida, tales como: disfunción sexual, incluyendo disfunción eréctil, disminución de la libido y sequedad vulvovaginal, algunos de los cuales pueden ser persistentes tras el cese del tratamiento y tener importantes repercusiones en los pacientes afectados;
5. Se han descrito casos de depresión, síntomas psicóticos y, rara vez, intentos de suicidio entre los pacientes tratados con isotretinoína, motivo por el cual aquellos pacientes con antecedentes depresivos requieren especial atención y monitoreo;
6. En la revisión de los folletos nacionales de productos farmacéuticos que contienen isotretinoína se pudo corroborar que, algunos de ellos, tanto folletos de información al profesional como al paciente, carecen de esta información actualizada, mientras que en otros resulta insuficiente o dispar;
7. El Instituto de Salud Pública, en base a su evaluación, considera necesaria la actualización de los folletos de información, tanto al paciente como al profesional y la presentación de un plan de manejo de riesgos para los productos farmacéuticos que contienen isotretinoína disponibles en el país, y
Teniendo presente:
Las disposiciones de los artículos 96º y 97º del Código Sanitario; los artículos 63º, 64º, 71º, 218º, 219º y 220º del Reglamento del Sistema Nacional de Control de los Productos Farmacéuticos de uso Humano, aprobado por decreto supremo Nº 3 de 2010, del Ministerio de Salud; los artículos 59º letra b) y 61º letra b), del DFL Nº 1 de 2005, y las facultades que me confiere el decreto 15, de 2023, del Ministerio de Salud, dicto la siguiente:
Resolución:
1. Establécese que, los titulares de registros sanitarios de los productos farmacéuticos que contienen el principio activo isotretinoína en su composición, deberán incluir en los folletos de información al profesional y al paciente, la información que, en cada caso, se indica a continuación.
FOLLETO DE INFORMACIÓN AL PROFESIONAL
Advertencias y Precauciones:
Trastornos psiquiátricos:
En pacientes tratados con isotretinoína, se ha notificado depresión, empeoramiento de la depresión, ansiedad, tendencias agresivas, alteraciones del estado de ánimo, síntomas psicóticos, y muy raramente, ideación suicida, intentos de suicidio y suicidio. Se debe tener especial precaución en pacientes con antecedentes de depresión y se debe monitorizar a todos los pacientes en busca de signos de depresión y se deben derivar para que reciban un tratamiento apropiado si es necesario. Sin embargo, la interrupción de isotretinoína puede ser insuficiente para aliviar los síntomas y, por lo tanto, puede ser necesaria una evaluación psiquiátrica o psicológica adicional.
Las percepciones de los familiares o amigos pueden ser útiles para detectar el deterioro de la salud mental.
Reacciones Adversas
Trastornos del aparato reproductor y de la mama:
Frecuencia no conocida: Disfunción sexual que incluye disfunción eréctil y disminución de la libido, sequedad vulvovaginal.
Trastornos psiquiátricos:
Raros: Depresión, empeoramiento de la depresión, tendencias agresivas, ansiedad, alteraciones del estado de ánimo.
Muy raros: Suicidio, intento de suicidio, ideación suicida, trastorno psicótico, comportamiento anormal.
FOLLETO DE INFORMACIÓN AL PACIENTE
Consulte a su médico antes de empezar el tratamiento, si alguna vez ha tenido algún problema de salud mental. Esto incluye depresión, tendencias agresivas o cambios de humor. También se incluyen los pensamientos sobre autolesionarse o terminar con su vida. Esto se debe a que su estado de ánimo puede verse afectado mientras tome isotretinoína.
Problemas de salud mental:
Es posible que usted no logre darse cuenta de algunos cambios en su estado de ánimo y comportamiento, por lo que es muy importante que les diga a sus amigos y familiares que está tomando este medicamento. Es posible que ellos noten estos cambios y le ayuden a identificar cualquier problema sobre el que necesite hablar con su médico.
Reacciones Adversas:
Problemas mentales:
Raros (pueden afectar hasta 1 de cada 1.000 personas):
Depresión o trastornos relacionados. Estos signos incluyen estado de ánimo triste o alterado, ansiedad, sentimientos de malestar emocional.
Empeoramiento de la depresión existente.
Volverse violento o agresivo.
Muy raros (pueden afectar hasta 1 de cada 10.000 personas):
. Algunas personas han tenido sentimientos o pensamientos sobre autolesionarse o acabar con sus propias vidas (pensamientos suicidas), han intentado acabar con sus propias vidas (intento de suicidio), o han terminado con sus propias vidas (suicidio). Estas personas pueden no dar la apariencia de estar deprimidas.
. Comportamiento inusual.
. Signos de psicosis: Pérdida de contacto con la realidad, como oír voces o ver cosas que no están ahí.
Póngase en contacto con su médico inmediatamente si experimenta signos o síntomas de alguno de estos problemas mentales. Su médico puede indicarle que deje de tomar isotretinoína. Esto puede no ser suficiente para detener los efectos: es posible que necesite más ayuda, y su médico puede gestionarlo.
Es muy importante que indique a su médico si ha padecido alguna enfermedad tal como depresión, comportamiento suicida o psicosis y si está recibiendo algún medicamento para el tratamiento de estas enfermedades.
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles):
. Problemas para conseguir o mantener una erección
. Disminución de la libido
Sequedad vaginal
2. Determínase que los titulares de los registros sanitarios de los productos farmacéuticos que a continuación se indica, deberán, en caso que sus folletos no cumplan con lo instruido en el punto anterior, someter a la aprobación de este Instituto, los folletos de información al profesional y paciente que incluyan los aspectos señalados, en un plazo que no exceda de 90 días, contados desde la fecha de publicación de esta resolución:
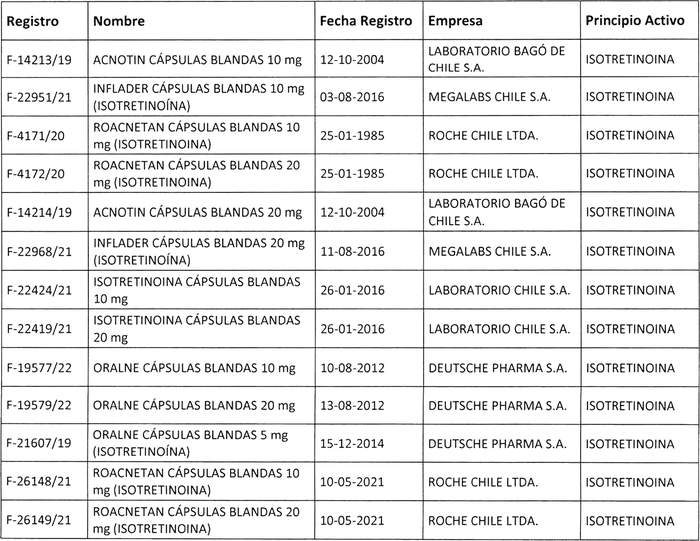
3. Instrúyese a los titulares de los registros sanitarios señalados en el numeral 2, que deberán proceder al envío de un Plan de Manejo de Riesgos (PMR), el cual deberá ajustarse a lo establecido en la resolución Nº 3.496 de 2013, de este instituto, dentro del plazo de 45 días hábiles a contar de la publicación de la presente resolución en el Diario Oficial, siendo necesaria su evaluación y actualización durante todo el ciclo de vida del producto farmacéutico, a medida que se disponga de nueva información. El documento debe ser enviado al Subdepartamento Farmacovigilancia a través del correo cenimef@ispch.cl o ingresarlo por Oficina de Gestión de Productos y Servicios (GPS) de este Instituto.
4. Aclárase que todo registro sanitario de producto farmacéutico que contenga el principio activo Isotretinoína que se conceda o sea solicitado con posterioridad a la publicación de la presente resolución en el Diario Oficial, deberá cumplir con las exigencias en ésta señaladas.
Anótese, comuníquese y publíquese en el Diario Oficial y en la página web del Instituto de Salud Pública de Chile.- Rubén Verdugo Castillo, Director, Instituto de Salud Pública de Chile.