DETERMINA RÉGIMEN DE CONTROL A APLICAR AL PRODUCTO NUTRIGEN D
Núm. 398 exenta.- Santiago, 4 de febrero de 2016.
Visto estos antecedentes:
La solicitud de determinación de régimen de control a aplicar y la documentación técnica adjunta presentada por Nutrigenomics, de fecha 3 de octubre de 2014, respecto del producto Nutrigen D; el acuerdo de la Sesión Nº 5/15 del Comité de Expertos Asesor en Régimen de Control Aplicable, realizada el 29 de septiembre de 2015; la resolución exenta Nº 4.656, de fecha 4 de diciembre de 2015, del Instituto de Salud Pública, que fuera publicada en el Diario Oficial del 21 de diciembre de 2015 y que abrió periodo de información pública en el procedimiento de régimen de control aplicable respecto de este producto; y
Considerando:
Primero: Que el producto se presenta en forma de cápsulas y de acuerdo a lo declarado su fórmula sería la siguiente:
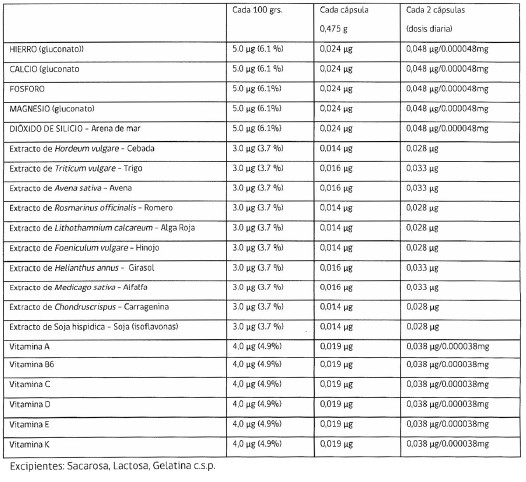 .
. Segundo: Que el interesado presenta un documento en el que indica que el producto sirve en el niño, en caso de crecimiento irregular y dolores de crecimiento, en adultos en caso de dolores de huesos, en caso de post fractura cuando hay un retraso de consolidación ósea después o cuando hay trastornos de la calidad de la consolidación, y en caso de factores de riesgo de la osteoporosis, como trastornos pulmonares, tabaquismo, delgadez excesiva, corticoterapia y por último en caso de osteopenia;
Tercero: Que Nutrigen D fue evaluado en la Sesión Nº 5/15, de fecha 29 de septiembre de 2015, del Comité de Expertos Asesor en Régimen de Control Aplicable, tal como consta en el acta correspondiente, en la que se concluyó, por unanimidad, que él debe ser clasificado como producto farmacéutico, por los siguientes motivos:
a) Se trata de una formulación que se presenta en forma de cápsulas de administración oral;
b) Se le atribuyen finalidades de uso terapéuticas relacionadas con el tratamiento de la osteoporosis;
c) De acuerdo a lo señalado en la fórmula el producto contiene 21 principios activos, algunos de los cuales son de origen vegetal o de algas y están en forma de extractos y tienen propiedades terapéuticas:
a. Extracto de Hordeum vulgare - Cebada. Se trata de un extracto del cereal cebada, que de acuerdo a lo señalado por la FAO, corresponde a una solución concentrada de malta macerada en agua, que es usada en alimentos dietéticos y de bebés, así como en la cocción del pan, y es considerado como un producto derivado de la cebada (Faostat Code 0051) (http://www.fao.org/es/faodef/fdef01e.htm). Se han evaluado 2 productos en RCA, que contiene cebada, el producto Matilia Allaitement (Matilia Lactancia), que contenía dentro de su formulación vitaminas, minerales y extractos de malta de cebada, extracto de anís y extracto de fenogreco sin cuantificar y como excipientes, el cual ha quedado clasificado como fuera de nuestra competencia, pero tenemos antecedentes de que el Minsal no autorizará su comercialización como alimento debido a la falta de estudios de seguridad de este tipo de productos usados en el periodo de lactancia y el producto Mezcla en Polvo a Base Proteínas de Suero de Leche y Soya, Sabor Vainilla Tahiti Trim Plan 40 Complete Shake, el cual contenía dentro de sus ingredientes activos harina de cebada (Hordeum vulgare), pero no fue posible clasificarlo por falta de antecedentes. Consultada la base de datos Gicona para productos registrados que contengan como ingrediente activo extracto de cebada, solamente se han encontrado cosméticos registrados con Hordeum vulgare. La EFSA no hace referencia a la planta Hordeum vulgare excepto que aparece mencionada en el listado denominado Anexo B: "Botanicals appearing on a negative list or subject to restricted use in at least one European Member State but for which the Scientific Committee, through the analysis of the data found, could not identify substances of concern, or other data for the inclusion in the compendium, A systematic literature search should be performed for these species", como Hordeum vulgare L., Poaceae (Gramineae), Seed. Lo que quiere decir que esta planta se encuentra al menos en un listado de plantas en que se restringe, pero de las cuales este mismo comité no ha podido comprobar ningún efecto negativo, pero tampoco se ha encontrado información que sustente su uso.
b. Extracto de Triticum vulgare - Trigo: - Existen antecedentes del extracto de Triticum vulgare, que hablan acerca de las propiedades cicatrizantes usado de forma tópica. Se ha evaluado en comisión de RCA un solo producto que contiene extracto acuoso de Triticum vulgare, el cual corresponde al producto Damor Line Crema, que corresponde a un producto de uso tópico indicado como cicatrizante, que ha quedado clasificado como producto farmacéutico, porque contenía ingredientes con propiedades terapéuticas (antisépticas y cicatrizantes) y está destinado a ser administrado tópicamente sobre la piel de las personas para tratar heridas (escaras, quemaduras de primer y segundo grado, laceraciones, abrasiones de la piel, quemaduras solares severas). Consultada la base de datos Gicona solamente se encuentran productos cosméticos registrados con este ingrediente activo. Respecto a este ingrediente activo en el libro de farmacognosia de Jean Bruneton se hace referencia a Triticum sp., en el que señala que es una planta perteneciente a la familia de las Graminacea, extensamente cultivada con interés farmacéutico por su almidón, por su fracción lipídica (aceite del germen de trigo), por su contenido de fibra (salvado de trigo), por el gluten (revestimiento de tabletas), por la materia insaponificable del aceite del grano (propuesta para el tratamiento de la periodontitis), por la utilidad del grano (tradicionalmente usado para aumentar la eliminación renal del agua y como tratamiento adjunto en las dietas para bajar de peso) y por la transformación de los productos del almidón. En internet la información que habla acerca de la acción del extracto acuoso de Triticum vulgare en el tratamiento de problemas de la piel, en documento de la UNAM en estudio denominado "Evaluación de la actividad reepitelizante del Triticum vulgare en la cervicitis crónica erosiva", se plantea que: Las fitoestimulinas o bioestimulinas de origen vegetal, obtenidas por un proceso de extracción en gramíneas (principalmente en Triticum vulgare o trigo), estimulan la síntesis de RNAm y DNA en fibroblastos y activan la reepitelización de los tejidos. También se encontró un documento que habla y menciona el uso en forma de crema, gasas estériles y óvulos denominado Taldermol. Se evaluó la capacidad de un extracto derivado de Triticum vulgare para estimular la proliferación celular de células de fibroblastos 3T3 de ratón. La respuesta celular al extracto de Triticum (TE) fue más evidente en cultivos dispersos, TE fue capaz de soportar la división celular continua. La proliferación celular mostró una respuesta dependiente de la dosis. (Farinella, Z., Morale. M.C. Agoste, M. A., & Rizza, V (1985). Stimulation of cell division in mouse fibroblast line 3T3 by an extract derived from Triticum vulgare. International journal of tissue reactions, 8(4), 337-342). Se encontró otra información más actual (estudios clínicos incluso), que se refieren al uso del extracto en formas farmacéuticas de uso tópico consideradas dispositivos médicos, para el tratamiento de hemorroides. Se menciona la especie Triticum aestivum L., subsp. Aestivum, Poaceae (Gramineae), dentro del Anexo B de la EFSA. El RSA se refiere este ingrediente como: Harina, sin otro calificativo, es el producto pulverulento obtenido por la molienda gradual y sistemática de granos de trigo de la especie Triticum aestivum sp. vulgare, previa separación de las impurezas, hasta un grado de extracción determinado (RSA, Párrafo II, de las harinas, Artículo 347).
c. Extracto de Rosmarinus officinalis - Romero: Corresponde Rosmarinus officinalis, el romero es una especie del género Rosmarinus de la familia Lamiaceae, cuyo hábitat natural es la región mediterránea. Las partes aéreas de Rosmarinus officinalis, pueden ser consideradas hierbas aromáticas, de acuerdo a lo establecido en el Párrafo IV, del Título XXIV, del DS Nº 977/96, siempre y cuando se destinen a la preparación de infusiones, lo cual no corresponde a este caso, ya que este ingrediente se presenta en forma de extracto que impregna a los gránulos de la cápsula que conforma el producto. La Norma Técnica Nº 133, que fuera aprobada por el decreto exento Nº 25, de fecha 18/01/2012, del Ministerio de Salud, ha catalogado a los tallos, hojas y flores de (Rosmarinus officinalis) como medicamento herbario tradicional (artículo 27º, del decreto Nº 3, de 2010), para los siguientes usos: "digestiones difíciles de tipo crónico (dispepsias), cólicos abdominales, padecimientos hepáticos, trastornos menstruales". Se debe administrar por vía oral, en forma de infusión, la cual se prepara con 1 cucharada del vegetal y 1 litro de agua recién hervida: "beber 1 taza 3 veces al día". Este Instituto tiene varios medicamentos autorizados que contienen preparaciones vegetales de romero como principio activo: 3 registros que contienen esencia de romero y 2 registros que contienen romero de castilla como hierba seca.
d. Extracto de Lithothamnium calcareum - Alga Roja: Llamada alga Coralline es un alga roja del orden Corallinales. Son características por su tallo duro ya que es un depósito calcáreo contenido dentro de las paredes celulares. El color es más rosa u otro tono de rojo, pero otras especies pueden ser púrpura, amarillo, azul, blue, blanco o gris-verde. Esta alga juega un rol importante en la ecología y en los arrecifes de coral. Algunos moluscos y peces se alimentan de esta alga. No hay antecedentes de productos que hayan pasado por RCA con este ingrediente, ni tampoco se han encontrado productos farmacéuticos que lo contengan.
e. Extracto de Medicago sativa - Alfalfa: La alfalfa, Medicago sativa L., está considerada por la FDA como segura (Code of Federal Regulations, Title 21 - Food and Drugs, Revised as of April 1, 2001). La EFSA en el listado que comprende un compendio de drogas vegetales que de las cuales se han reportado sustancias posiblemente preocupantes para la salud humana cuando se utiliza en alimentos y suplementos alimenticios "Compendium of Botanicals Reported to Contain Naturally Occuring Substances of Possible Concern for Human Health When Used in Food and Food Supplements", señala que: Medicago sativa L., Leguminosae (Fabaceae), partes aéreas y semillas, contiene alcaloides pyrrolidinicos en las semillas: ejemplo stachydrine (0.18%), homostachydrine; y derivados nitro aromáticos: ejemplo trigonelline (0.36%) (Barnes J., Anderson L.A., Phillipson J.D. 2007, Herbal Medicines. 3rd ed. Ed. Pharmaceutical Press. ISBN 978-0-85369-623-0). Respecto de la alfalfa se debe señalar que hay varias asociaciones autorizadas como medicamentos que presentan extracto o tinturas de alfalfa, la mayor parte de ellos corresponden a registros bastante antiguos que han sido renovados. Sin embargo, más recientemente, a través de la resolución Nº 7.845, de fecha 30/09/03, de este Instituto, se determinó que el régimen que correspondía aplicar al producto Extracto Foliar de Alfalfa, el cual corresponde al jugo de las partes aéreas de Medicago sativa L. que posteriormente se seca e ingiere directamente, consumiéndose de 5 - 10 g diarios por vía oral, es el propio de los alimentos. Mediante resolución Nº 2.333, de fecha 24 de marzo de 2006, se clasificó el producto "Bioenergitas II Cápsulas", como medicamento, el cual correspondía a una asociación de varios principios activos, entre ellos polvo de partes aéreas de Medicago sativa L.
f. Extracto de Chondruscrispus - Carragenina: La carragenina es un hidrocoloide extraído de algas marinas rojas de las especies Gigartina, Hypnea, Eucheuma, Chondrusy lridaea. Es utilizada en diversas aplicaciones en la industria alimentaria como espesante, gelificante, agente de suspensión y estabilizante, tanto en sistemas acuosos como en sistemas lácticos. Carragenina es considerada un excipiente, en el RSA, párrafo V, artículo 215, de los productos lácteos, se menciona a la carragenina de la siguiente forma: "En la leche evaporada se podrá utilizar, además, carragenina en una dosis máxima de 150 mg/kg". No existen productos registrados con carragenina como ingrediente activo, y por Régimen de control a aplicar han pasado un gran número de productos que lo contienen como excipiente, los cuales han sido clasificados en distintas categorías, dependiendo de los ingredientes activos, no siendo la carragenina un ingrediente tomado en consideración para su clasificación. No se entiende el sentido de este ingrediente activo en esta formulación.
g. Extracto de Soja hispidica - Soja (isoflavonas): Corresponde a la planta Glycine max, conocida como soja, contiene fitoestrógenos, llamados isoflavonas, este Instituto tiene varios productos registrados cuyos principios activos contienen isoflavonas, autorizado como coadyuvante para el tratamiento de la osteoporosis. Existen bastantes antecedentes sobre la acción de estos compuestos con actividad estrogénica o antiestrogénica denominados fitoestrógenos. Se han identificado numerosos productos naturales con actividad estrogénica con estructuras muy diversas, tales como: isoflavonas, lignanos, coumestranos, flavonoides y estilbenos (Papoutsi et al., 2006). Diferentes estudios con isoflavonas han demostrado propiedades estrogénicas y antiestrogénicas al competir con el receptor estrogénico demostrando una actividad bifásica; por un lado una actividad estrogénica en bajas concentraciones (< 10-6M), y una actividad antiestrogénica en altas concentraciones (> 10-6M) (Papoutsi et al., 2006). Estudios epidemiológicos en seres humanos documentaron los efectos adversos de genisteína en mujeres embarazadas que consumieron dietas vegetarianas teniendo descendientes masculinos con un incremento de hipospadias, posiblemente por los altos niveles de isoflavonas de soja (North and Golding, 2000). Adultos jóvenes -hombres y mujeres- que consumieron soja, tuvieron un incremento de alergias, y además las mujeres presentaron alteraciones en el ciclo menstrual comparado con los que consumieron leche de vaca (Goldman et al., 2001; BL Strom, 2001). Otro ejemplo también explica como felinos Cheetah en cautiverio sufrieron infertilidad por el consumo de alimentos ricos en soja (Setchell et al., 1987). Por lo tanto, aunque este ingrediente se encuentre en bajas concentraciones no tiene una justificación como alimento.
d) Al producto se le atribuyen propiedades terapéuticas relacionadas con el tratamiento de la osteoporosis, sus ingredientes de vegetales y algas a pesar de estar en dosis subterapéutica no están en las formas usadas en alimento;
e) Por lo tanto, dada la composición y finalidad de uso de Nutrigen D, así como a los antecedentes antes descritos, este producto cumple con la definición de producto farmacéutico y para poder comercializarse en Chile debe contar previamente con un registro sanitario que demuestre calidad, seguridad y eficacia;
Cuarto: Que, mediante la resolución exenta Nº 4.656, de fecha 4 de diciembre de 2015, de este Instituto, que fuera publicada en el Diario Oficial del 21 de diciembre de 2015, se abrió periodo de información pública en el procedimiento administrativo de determinación del régimen de control que corresponde aplicar a este producto, de 10 día hábiles, contados desde la publicación de dicha resolución en el Diario Oficial, no habiéndose recibido en ese plazo ninguna observación para este procedimiento; y
Teniendo Presente:
Lo dispuesto en el artículo 96º del Código Sanitario; en los artículos 8º y 9º del Reglamento del Sistema Nacional de Control de los Productos Farmacéuticos de Uso Humano, aprobado por el decreto Nº 3 de 2010, del Ministerio de Salud; la resolución exenta Nº 4.023, del 4 de diciembre de 2013, del Instituto de Salud Pública de Chile; el artículo 59º letra b), del decreto con fuerza de ley Nº 1, de 2005, que fija el texto refundido, coordinado y sistematizado del decreto ley Nº 2.763, de 1979 y de las leyes Nº 18.933 y Nº 18.469, del Ministerio de Salud; lo dispuesto en el Reglamento del Instituto de Salud Pública de Chile, aprobado por el decreto supremo Núm. 1.222, de .996, de la misma Secretaría de Estado; y las facultades delegadas por la resolución exenta Nº 292, del 12 de febrero de 2014, del Instituto de Salud Pública de Chile, dicto la siguiente:
Resolución:
1. Establécese que el régimen que corresponde aplicar al producto Nutrigen D, presentado por Nutrigenomics, es el propio de los Productos Farmacéuticos.
2. Por lo tanto, deberá regirse por las disposiciones del Reglamento del Sistema Nacional de Control de Productos Farmacéuticos de Uso Humano, decreto Nº 3, de 2010, del Ministerio de Salud.
3. De acuerdo a lo señalado en el artículo 8º, del decreto Nº 3, de 2010, del Ministerio de Salud, desde la fecha de notificación de la presente resolución y mientras no se obtenga el registro sanitario de este medicamento, éste deberá ser retirado del mercado por parte de quien lo distribuye o expende, sin perjuicio de las responsabilidades sanitarias a que ello diere lugar.
4. Lo dispuesto en la presente resolución también será aplicable al resto de los productos que contengan el o los componentes declarados como propios de un producto farmacéutico (artículo 8º, del decreto Nº 3, de 2010).
Anótese, comuníquese, publíquese en el Diario Oficial y en la página web ISP.- Helen Rosenbluth López, Jefa Subdepartamento Registro y Autorizaciones Sanitarias, Departamento Agencia Nacional de Medicamentos, Instituto de Salud Pública de Chile.