DETERMINA RÉGIMEN DE CONTROL A APLICAR AL PRODUCTO NUTRIGEN L
Núm. 399 exenta.- Santiago, 4 de febrero de 2016.
Visto estos Antecedentes:
La solicitud de determinación de régimen de control a aplicar y la documentación técnica adjunta presentada por Nutrigenomics, de fecha 3 de octubre de 2014, respecto del producto Nutrigen L; el acuerdo de la sesión Nº 5/15 del Comité de Expertos Asesor en Régimen de Control Aplicable, realizada el 29 de septiembre de 2015; la resolución exenta Nº 4.656, de fecha 4 de diciembre de 2015, del Instituto de Salud Pública, que fuera publicada en el Diario Oficial del 21 de diciembre de 2015 y que abrió periodo de información pública en el procedimiento de régimen de control aplicable respecto de este producto; y
Considerando:
Primero: Que el producto se presenta en forma de cápsulas y de acuerdo a lo declarado su fórmula seria la siguiente:
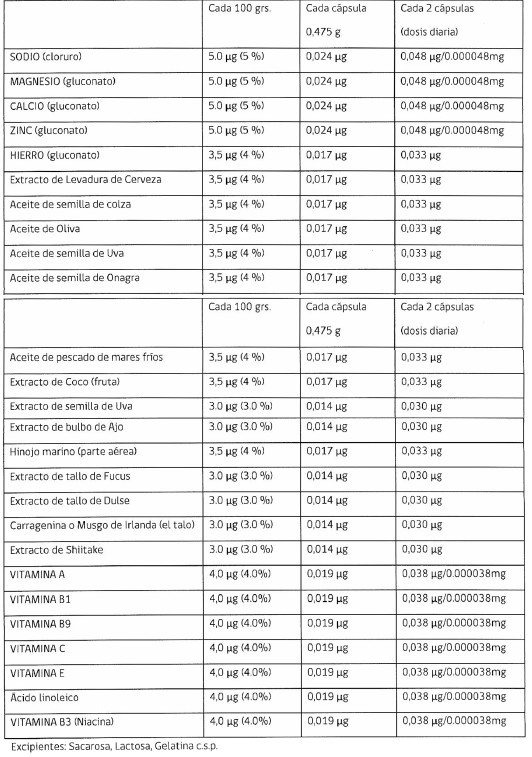 .
. Segundo: Que el interesado presenta un documento en el que indica que el producto se usa en: "Trastornos metabólicos: para la hiperlipidemia: hipercolesterolemia, hipergliciridemia, hiperglucemia, hiperuricemia, aparición de enfermedades metabólicas, como disminución del HDL-Colesterol y oxidación del LDL-colesterol.";
Tercero: Que Nutrigen L fue evaluado en la sesión Nº 5/15, de fecha 29 de septiembre de 2015, del Comité de Expertos Asesor en Régimen de Control Aplicable, tal como consta en el acta correspondiente, en la que se concluyó, por unanimidad, que él debe ser clasificado como producto farmacéutico, por los siguientes motivos:
a) Se trata de una formulación que se presenta en forma de cápsulas de administración oral;
b) Se le atribuyen finalidades de uso terapéuticas relacionadas con trastornos metabólicos;
c) De acuerdo a lo señalado en la fórmula el producto contiene 26 principios activos, de los cuales la mayoría podría constituir un alimento, pero respecto a otros no está clara su función alimenticia en la forma de preparación:
a. Aceite de semilla de Onagra: El ISP tiene un producto registrado ACEITE DE ONAGRA CÁPSULAS BLANDAS F-11453/11, que contiene una mezcla de ácidos grasos entre ellos 345 mg por cápsula de ácido linoleico y 51,5 mg por cápsula de ácido oleico. En RCA se han clasificado varios productos que contienen aceite de Oenothera biennis L., como producto farmacéutico. De acuerdo a lo establecido en la resolución genérica Nº 9.330 de fecha 28 de octubre de 2005 en que se limitan las indicaciones terapéuticas de los registros de todos los productos farmacéuticos que contengan aceite de semillas de Oenothera biennis L. (Evening Primrose) como principio activo. Los límites definidos en esta resolución se establecen de acuerdo a lo indicado por la OMS, siendo la dosis diaria recomendada de 320 - 480 mg de aceite fijo al día (calculado como ácido gama linolénico) en dosis divididas. El aceite de Oenothera biennis, no aparece mencionado dentro de los aceites comestibles de origen vegetal en el reglamento de sanitario de los alimentos (DS Nº 977/96).
b. Extracto de semilla de Uva: La semilla de uva se caracteriza por su alto contenido en vitamina E, flavonoides, ácido linoleico y polifenoles. A través de la resolución exenta Nº 1.688, de fecha 24/02/06, del ISP, se determinó que el régimen que corresponde aplicar al producto PROCIANIDINA - LICOPENO CÁPSULAS, de la empresa Eurolab Ltda., que contiene 66,72 mg de una mezcla de: extracto estandarizado de semillas de Vitis vinifera L. (equivalente a no menos de 22,5 mg y no más de 37,5 mg de procianidina) y extracto estandarizado de epicarpio del fruto de Licopersicum esculentum Mill. (tomate) (equivalente a no menos de 2,25 mg y no más de 3,75 mg de licopeno), cuya finalidad de uso era como antioxidante y en que su modo de uso era de 1 cápsula 2 veces al día, es el propio de los alimentos. Por otra parte, este Instituto tiene 4 registros vigentes (N-328/09, N-340/09, N-330/09 y N-8/11), cuyo único principio activo es un extracto seco de semillas de Vitis vinifera L, presentan 50 mg de ese extracto por forma farmacéutica de administración oral; todos ellos tienen condición de venta directa; los registros N-328/09, N-340/09 y N-330/09 tiene las siguientes indicaciones terapéuticas autorizadas: "Coadyuvante en el tratamiento de los síntomas de insuficiencia venosa, la capacidad antioxidante de Vitis vinifera podría contribuir a la profilaxis del envejecimiento celular", las indicaciones del registro N-8/11 son: "Contribuye a la adecuada mantención de la función venosa y capilar periférica. La capacidad antioxidante de Vítis vinifera podría contribuir a la profilaxis del envejecimiento celular". Cada cápsula de este producto aportaría 0,030 µg de extracto de semillas de uva, es decir, una cantidad muy inferior a la de los extractos autorizados como medicamentos por el ISP.
c. Extracto de bulbo de Ajo: Los bulbos del Allium sativum L., de acuerdo a lo señalado en la monografía WHO sus principales constituyentes son los compuestos sulfurados, de los cuales se ha estimado que un 82% corresponde a cisteín sulfóxidos (ej.: aliína) y a péptidos no volátiles de gama-glutamilcisteína. Los usos medicinales respaldados por datos clínicos son: como coadyuvante al manejo dietético en el tratamiento de hiperlipidemias, en la prevención de la atereosclerosis por cambios vasculares (dependiente de la edad), también puede ser útil en el tratamiento de la hipertensión moderada. Se recomienda dosis diaria de 2-5 mg de aceite de ajo (WHO monographs on selected medicinal plantas, Volume 1, World Health Organization, Geneva, 1999, pág. 16-26). Este Instituto ha autorizado varios medicamentos que contienen como único principio activo, aceite de ajo, en una concentración de 0,682 mg por cápsula blanda. Su condición de venta es directa en establecimientos de tipo A y B, las indicaciones autorizadas son: "Coadyuvante en el tratamiento de hipertipidemias, cuando las medidas dietarias son insuficientes. Profilaxis de ateroesclerosis. Mejora la circulación en enfermedad arterial vascular periférica". Cada cápsula de este producto aporta 0,030 µg de extracto de bulbo de ajo, es decir, una cantidad muy inferior a la del producto autorizado como medicamento por el ISP.
d. Hinojo marino (parte aérea): Al parecer se trata de la planta Crithmum maritimum, la única especie del género Crithmum, es una planta silvestre comestible en otros países que se encuentra en la zona meridional de Europa, en especial la costa del mar Mediterráneo, donde crece en estado silvestre. Es una hierba perenne. No se conoce mucho de este vegetal. Consultada la base de datos Gicona se encuentran varios productos cosméticos con este ingrediente activo. No se han evaluado productos en RCA que contengan este ingrediente.
e. Extracto de tallo de Fucus: En la base de datos de productos farmacéuticos registrados se encuentran varios medicamentos autorizados, con sus registros vigentes, que contienen como principio activo el alga Fucus o Fucus vesiculosus, sola o en asociación. Estos corresponden a productos farmacéuticos homeopáticos, fitofármacos o clasificados como otros (artículos 15º, 14º y 17º, letra c), del decreto Nº 3 de 2010, respectivamente). A modo de ejemplo se citan los siguientes: FUCUS ESPECIAL COMPRIMIDOS, registro Nº H-755/10 (medicamento homeopático), en que cada comprimido presenta 50 µg de Fucus D1 en asociación con otras 4 preparaciones homeopáticas, encontrándose clasificado como adelgazante natural; FUCUS VESICULOSUS COMPUESTO SOLUCIÓN ORAL PARA GOTAS, registro Nº H-918/10 (medicamento homeopático), en que cada 100 ml de solución oral para gotas contiene 2,25 ml de Fucus vesiculosus D1 en asociación con otras 7 preparaciones homeopáticas, encontrándose aprobado con la siguiente indicación terapéutica: "Medicamento homeopático útil en el control de sobrepeso"; CELLASENE GOLD CÁPSULAS BLANDAS, registro Nº N-469/08 (fitofármaco), en que cada cápsula blanda contiene 120 mg de extracto seco de tallos de Fucus vesiculosus L. (equivalente a 210 µg de yodo) en asociación con una serie de otros principios activos. La indicación terapéutica autorizada es: "Coadyuvante en el tratamiento de la insuficiencia vascular cerebral y periférica"; y CELLTECH CÁPSULAS BLANDAS, registro Nº K-52/08 (clasificado en otros), que presenta 120 mg de extracto seco de tallos de Fucus vesiculosus L. (equivalente a no menos de 240 mcg de yodo) por cada cápsula blanda, en asociación con otros 5 principios activos. La indicación terapéutica autorizada es: "Ayuda a reducir la aparición de Celulitis". Adicionalmente, se debe agregar que la Autoridad Europea de Seguridad de Alimentos (EFSA) establece lo siguiente respecto de los vegetales Fucus vesiculosus: Se detallan nombres en varios idiomas. Se describe como una alga comúnmente encontrada en las costas del Mar del Norte, el oeste del Mar Báltico y los Océanos Atlántico y Pacífico; es un alga muy variable, puede crecer 100 cm o más y es fácilmente reconocible por las pequeñas vesículas llenas de gas que se producen en pares, una a cada lado de una nervadura central, que corre a lo largo de la hoja como una correa. Este producto está presente en el mercado europeo como alimento o ingrediente alimentario y es consumido en un grado significativo desde antes del 15 de mayo de 1997. Por tanto, su acceso al mercado no está sujeto a la regulación de Alimentos Nuevos (EC) Nº 258/97. Sin embargo, algunos estados Miembros pueden restringir su uso como alimento o ingrediente alimentario. Por tanto, se recomienda chequear con las autoridades nacionales competentes, disponible en: http://ec.europa.eu/food/food/biotechnology/novelfood/nfnetweb/mod_search/index.cfm?action=mod_search.list&ascii=65. Los talos de Fucus se encuentran autorizados en Francia con las siguientes indicaciones: Tradicionalmente usado como coadyuvante en tratamientos de pérdida de peso, admitiéndose también como un laxante de volumen. Asimismo, se especifica que la ingesta de yodo no puede exceder los 120 µg en adultos. Además, la fitoterapia contemporánea y la cosmetología usan esta alga ampliamente por sus microelementos, yodo y otros constituyentes (Jean Brunethon, "Pharmacognosy, Phytochemistry, Medicinal Plants", Intercept Ltd, England, 1995, pág. 47). Se han evaluado en la comisión de RCA, 4 productos que contienen Fucus vesiculosus sola a o asociados y todos han quedado clasificados como producto farmacéutico, debido a que estaban destinados a tratamientos para adelgazar.
f. Carragenina o Musgo de Irlanda (el talo): La carragenina es un hidrocoloide extraído de algas marinas rojas de las especies Gigartina, Hypnea, Eucheuma, Chondrus y Iridaea. Es utilizada en diversas aplicaciones en la industria alimentaria como espesante, gelificante, agente de suspensión y estabilizante, tanto en sistemas acuosos como en sistemas lácticos, Carragenina es considerada un excipiente, en el RSA, párrafo V, artículo 215, de los productos lácteos, se menciona a la carragenina de la siguiente forma: "En la leche evaporada se podrá utilizar, además, carragenina en una dosis máxima de 150 mg/kg". No existen productos registrados con carragenina como ingrediente activo, y por RCA de control a aplicar han pasado un gran número de productos que lo contienen como excipiente, los cuales han sido clasificados en distintas categorías, dependiendo de los ingredientes activos, no siendo la carragenina un ingrediente tomado en consideración para su clasificación. No se entiende el sentido de este ingrediente activo en esta formulación.
d) Al producto se le atribuyen propiedades terapéuticas relacionadas con los trastornos metabólicos y algunos de sus ingredientes vegetales, aceites y algas a pesar de estar en dosis subterapéutica no están en las formas usadas en alimento;
e) Por lo tanto, dada la composición y finalidad de uso de Nutrigen L, así como a los antecedentes antes descritos, este producto cumple con la definición de producto farmacéutico y para poder comercializarse en Chile debe contar previamente con un registro sanitario que demuestre, calidad, seguridad y eficacia;
Cuarto: Que, mediante la resolución exenta Nº 4.656, de fecha 4 de diciembre de 2015, de este Instituto, que fuera publicada en el Diario Oficial del 21 de diciembre de 2015, se abrió periodo de información pública en el procedimiento administrativo de determinación del régimen de control que corresponde aplicar a este producto, de 10 días hábiles, contados desde la publicación de dicha resolución en el Diario Oficial, no habiéndose recibido en ese plazo ninguna observación para este procedimiento; y
Teniendo Presente: Lo dispuesto en el artículo 96º del Código Sanitario; en los artículos 8º y 9º del Reglamento del Sistema Nacional de Control de los Productos Farmacéuticos de Uso Humano, aprobado por el decreto Nº 3, de 2010, del Ministerio de Salud; la resolución exenta Nº 4.023, del 4 de diciembre de 2013, del Instituto de Salud Pública de Chile; el artículo 59º letra b), del decreto con fuerza de ley Nº 1, de 2005, que fija el texto refundido, coordinado y sistematizado del decreto ley Nº 2.763, de 1979 y de las leyes Nº 18.933 y Nº 18.469, del Ministerio de Salud; lo dispuesto en el Reglamento del Instituto de Salud Pública de Chile, aprobado por el decreto supremo Núm. 1.222, de 1996, de la misma Secretaría de Estado; y las facultades delegadas por la resolución exenta Nº 292, del 12 de febrero del 2014, del Instituto de Salud Pública de Chile, dicto la siguiente:
Resolución:
1. Establécese que el régimen que corresponde aplicar al producto Nutrigen L, presentado por Nutrigenomics, es el propio de los Productos Farmacéuticos.
2. Por lo tanto, deberá regirse por las disposiciones del Reglamento del Sistema Nacional de Control de Productos Farmacéuticos de Uso Humano, decreto Nº 3 de 2010, del Ministerio de Salud.
3. De acuerdo a lo señalado en el artículo 8º, del decreto Nº 3 de 2010, del Ministerio de Salud, desde la fecha de notificación de la presente resolución y mientras no se obtenga el registro sanitario de este medicamento, éste deberá ser retirado del mercado por parte de quien lo distribuye o expende, sin perjuicio de las responsabilidades sanitarias a que ello diere lugar.
4. Lo dispuesto en la presente resolución también será aplicable al resto de los productos que contengan el o los componentes declarados como propios de un producto farmacéutico (artículo 8º, del decreto Nº 3 de 2010).
Anótese, comuníquese, publíquese en el Diario Oficial y en la página web ISP.- Helen Rosenbluth López, Jefa Subdepartamento Registro y Autorizaciones Sanitarias, Departamento Agencia Nacional de Medicamentos, Instituto de Salud Pública de Chile.