DETERMINA RÉGIMEN DE CONTROL A APLICAR AL PRODUCTO NUTRIGEN I
Núm. 400 exenta.- Santiago, 4 de febrero de 2016.
Visto estos Antecedentes:
La solicitud de determinación de régimen de control a aplicar y la documentación técnica adjunta presentada por Nutrigenomics, de fecha 3 de octubre de 2014, respecto del producto Nutrigen I; el acuerdo de la sesión Nº 5/15 del Comité de Expertos Asesor en Régimen de Control Aplicable, realizada el 29 de septiembre de 2015; la resolución exenta Nº 4.656, de fecha 4 de diciembre de 2015, del Instituto de Salud Pública, que fuera publicada en el Diario Oficial del 21 de diciembre de 2015 y que abrió periodo de información pública en el procedimiento de régimen de control aplicable respecto de este producto, y
Considerando:
Primero: Que el producto se presenta en forma de cápsulas con gránulos impregnados y de acuerdo a lo declarado su fórmula sería la siguiente:
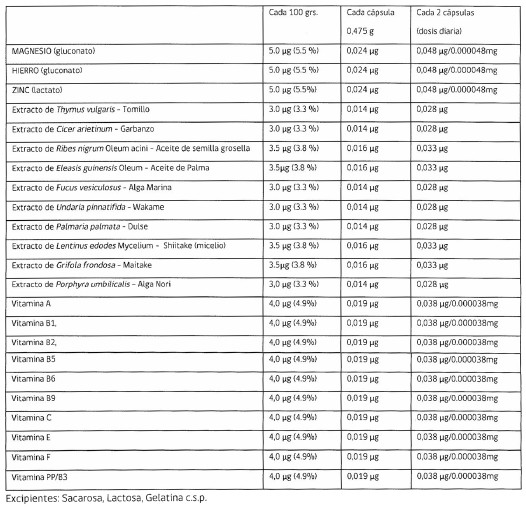 .
. Segundo: Que el interesado presenta un documento en el que indica que el producto sirve para los trastornos metabólicos, hiperlipidemias, hipercolesterotemia, hipertrigliceridemia, hiperglucemia, hiperuricemia, existencia de patología infecciosas agudas frecuentes, gripe, otitis, sinusitis, rinofaringitis, anginas, bronco pulmonar. Fragilidad frente a epidemias, patologías infecciosas crónicas, alergias, astenia que se agrava a pesar del reposo, enfermedades auto inmunes;
Tercero: Que Nutrigen I fue evaluado en la sesión Nº 5/15, de fecha 4 de septiembre de 2015, del Comité de Expertos Asesor en Régimen de Control Aplicable, tal como consta en el acta correspondiente, en la que se concluyó, por unanimidad, que él debe ser clasificado como producto farmacéutico, por los siguientes motivos:
a) Se trata de una formulación que se presenta en forma de cápsulas de administración oral;
b) Se le atribuyen finalidades de uso terapéuticas relacionadas con efectos inmunoprotectores;
c) De acuerdo a lo señalado en la fórmula el producto contiene 23 principios activos, algunos de los cuales son de origen vegetal o corresponden a hongos o algas que están en forma de extractos y tienen propiedades terapéuticas:
a. Extracto de Thymus vulgaris - Tomillo: La OMS tiene una monografía autorizada para: "Herba Thymi", que consiste en las hojas secas y sumidades floridas de Thymus vulgaris L. o de Thymus zygis L., que se pueden administrar en forma droga cruda triturada, el polvo seco en bolsas de té y extractos fluidos para infusión y otras preparaciones galénicas (WHO monographs on selected medicinal plants, Volume 1. World Health Organization, Geneva, 1999, pag. 259-266). Sus usos medicinales son: a) Usos descritos en farmacopeas y en sistemas de medicina tradicional: Oralmente para tratamiento de dispepsia y otros trastornos gastrointestinales, también en caso de tos, resfrío, bronquitis, y pertussis, en caso de laringitis y amigdalitis para hacer gárgaras; Tópicamente se usa el extracto para tratar heridas menores, resfrío común, desordenen de la cavidad bucal y como agente antibacteriano para higiene oral. Dosis: En infusión, adultos y niños mayores de 1 año 1-2 g de droga seca o su equivalente en droga fresca, varias veces al día, según necesidad, en niños mayores de 1 año 0,5-1g; Extracto fluido dosis equivalente; tintura (1:10 en alcohol 70%), 40 gotas, 3 veces al día. Asimismo, hay medicamentos autorizados que contienen preparaciones vegetales de Tomillo, como único principio activo o asociado. Ejemplos: N-45/11, Hustagil Jarabe, que contiene extracto fluido de tomillo, indicado como: Coadyuvante en el tratamiento de afecciones respiratorias y N-44/11, Hustagil Compuesto Ungüento Balsámico, que contiene aceite esencial de tomillo asociado a otros componentes de origen vegetal, indicado como: Descongestionante de las vías respiratorias; La Norma Técnica Nº 133, que fuera aprobada por el decreto exento Nº 25, de fecha 18/01/2012, del Ministerio de Salud, ha catalogado a las hojas y ápices florales de Thymus vulgaris, como medicamento herbario tradicional (artículo 27º, del decreto Nº 3, de 2010), para los siguientes usos: "uso interno: malestares digestivos (digestiones difíciles de tipo crónico (dispepsia), diarrea, cólicos, flatulencia, vómitos); parásitos intestinales; malestares respiratorios (tos, catarro, bronquitis, amigdalitis, resfríos)". Se debe administrar por vía oral, en forma de infusión, la cual se prepara con 1 cucharada del vegetal y 1 litro de agua recién hervida: "beber 1 taza 3 veces al día". Las partes aéreas de Thymus vulgaris L. (tomillo), puede ser considerado hierba aromática, de acuerdo a lo establecido en el Párrafo IV, del Título XXIV, del DS Nº 977/96, siempre y cuando se destinen a la preparación de infusiones, lo cual no corresponde a este caso, ya que este ingrediente se presenta en forma de extracto que impregna a los gránulos de la cápsula que conforma el producto. Se ha evaluado en RCA sólo un producto que contiene este ingrediente activo en su formulación asociado a otras hierbas aromáticas o de agrado, las cuales se encuentran en forma de infusión y como una bebida, el cual ha quedado clasificado como alimento. (Terma con Limón, Res. Ex. Nº 12.363, de fecha 30 de septiembre de 2005).
b. Extracto de Cicer arietinum - Garbanzo: - Corresponde a la leguminosa conocida como garbanzo Cicer arietinum L., respecto de este vegetal son conocidas sus propiedades alimenticias ya que es rico en proteínas (entre 20 y 25% de su peso), aunque no incluyen todos los aminoácidos esenciales, por lo que a los platos se le agrega pastas o arroz a su preparación. Se sabe de algún efecto diurético y su capacidad para favorecer el tránsito intestinal (debido al alto nivel de fibras que contiene), además de su valor energético y por su bajo contenido en sodio. No existe información que se refiera al uso de extractos de este vegetal. Se encontró alguna información que se refiere al uso de harina de garbanzo asociada a harina de maíz para preparar una bebida, en el cual señala que Cicer arietinum L es una de las leguminosas de mayor importancia en el mundo, cuyos granos contienen, en base seca, 61.1-67.4% de carbohidratos, 21.7-24.5% de proteínas, vitaminas (Tiamina, Niacina) y ácidos grasos insaturados (Oleico, Linolénico). Las proteínas de garbanzo son deficientes en aminoácidos azufrados (Met+Cys). Los granos de garbanzo integrales contienen una amplia gama de compuestos fenólicos (flavonoles, glucósidos de flavona, proantocianidinas oligoméricas y poliméricas) que son considerados compuestos bioactivos debido a su capacidad antioxidante. Además señala que el consumo de granos integrales se ha asociado con la prevención de enfermedades cardiovasculares, diabetes tipo 2, y algunos tipos de cáncer, por lo que las guías alimentarias para los americanos del departamento de agricultura de los Estados Unidos, destacan la necesidad del consumo de cereales y leguminosas integrales. Finalmente concluye en este trabajo que esta bebida funcional se podría utilizar como una alternativa a las bebidas con bajo valor nutricional, tales como los preparados con agua, azúcares simples, y saborizantes artificiales y colorantes, que se ofrecen ampliamente en el mercado (Rochín -Medina, J. J., Milán-Carrillo, J., Gutiérrez-Dorado, R., Cuevas-Rodríguez, E. O., Mora-Rochín, S., Valdez-Ortiz, A., ...& Reyes-Moreno, C. Bebida funcional de valor nutricional/nutracéutico alto elaborada a partir de una mezcla de granos integrales (maíz + garbanzo) extrudidos.). No existen productos registrados como medicamento que contengan garbanzos en ninguna de sus formas, tampoco ha pasado por RCA algún producto con extracto de garbanzo, solamente con harina de éste. El Reglamento Sanitario de los Alimentos (DS 977/96, en su Párrafo II, de la rotulación y publicidad, Artículo 106.- Nº 2), señala Alimentos desecados: Corresponden a frutas, verduras, hortalizas o leguminosas deshidratadas, aun cuando adopten presentaciones farmacéuticas por vía oral; no se hace referencia en ninguna parte al uso de extracto de Garbanzo o de leguminosas en general. No se menciona en monografía EFSA.
c. Extracto de Ribes nigrum Oleum acini - Aceite de semilla grosella: De acuerdo a lo que señala se trataría de aceite de la semilla de la grosella Ribes nigrum L, conocido como cassis, grosellero negro, zarzaparrilla negra o parrilla negra, es un arbusto frondoso y no espinoso, originario de Europa oriental y central, pertenece al mismo género del grosellero común y se parece mucho a él. Científicamente, se ha demostrado que el aceite de semilla de grosellero negro tiene un moderado efecto inmunológico atribuible a su capacidad para reducir la producción de prostaglandina E2 (Wu. D., Meydani, M., Leka, L. S., Nightingale, Z., Handelman, G. J., Blumberg, J. B., & Meydani, S. N. (1999), Effect of dietary supplementation with black currant seed oil on the immune response of healthy elderly subjects. The American journal of clinical nutrition, 70(4), 536 543). Por otra parte el aceite de este ingrediente activo no se encuentra descrito dentro del listado de tos ingredientes de origen vegetal del RSA (DS Nº 977/96), (Artículo 251), ya que el listado actualizado recientemente señala que los aceites comestibles de origen vegetal autorizados corresponden a los obtenidos de frutos o sus partes o de semillas oleaginosas como: algodón, cártamo, girasol o maravilla, germen de maíz, maní o cacahuate, oliva, pepa de uva, raps o colza, sésamo o ajonjolí, soja o soya, avellana chilena, arroz, pepa de tomate, germen de trigo, linaza, mosqueta, palta y aceites comestibles obtenidos de las semillas de Nuez, Almendra, Calabaza, semillas de Piñón o Pinus koraiensis, semillas de Chía, semillas del hongo Mortierella alpina, aceite de alga Crypthecodinium cohnii, aceite de los frutos de Vitelaria paradoxa (Karité), Shorea stenoptera (manteca de Illipé), aceite de la microalga Schizochytrium sp y aceite de la semilla de Cannabis sativa.
d. Extracto de Eleasis guinensis Oleum - Aceite de Palma: De acuerdo lo señalado en el DS 977/96, Artículo 253.- "Mantecas o grasas comestibles de origen vegetal, son los alimentos grasos vegetales de consistencia sólida o semisólida a la temperatura de 15ºC, obtenidas de los siguientes frutos, sus partes o semillas: cacao, coco, coco del Paraguay, babassú, palma, palmiste y otros autorizados por el Ministerio de Salud". En el año 2011 (sesión Nº 2 de RCA), se evaluó producto denominado Slimtone Control 8 hrs., polvo para suspensión oral, que contenía aceite de palma y aceite de avena, el cual quedó como fuera de nuestra competencia: "Por tener aceite de avena, que no aparece en los listados de ingredientes alimenticios, no se puede asignar una clasificación para este producto".
e. Extracto de Fucus vesiculosus - Alga Marina: En la base de datos de productos farmacéuticos registrados se encuentran varios medicamentos autorizados, con sus registros vigentes, que contienen como principio activo el alga Fucus o Fucus vesiculosus, sola o en asociación. Estos corresponden a productos farmacéuticos homeopáticos, fitofármacos o clasificados como otros (artículos 15º, 14º y 17º, letra c), del decreto Nº 3, de 2010, respectivamente). A modo de ejemplo se citan los siguientes: Fucus Especial comprimidos, registro Nº H-755/10 (medicamento homeopático), en que cada comprimido presenta 50 mcg de Fucus D1 en asociación con otras 4 preparaciones homeopáticas, encontrándose clasificado como adelgazante natural; Fucus vesiculosus compuesto solución oral para gotas, registro Nº H-918/10 (medicamento homeopático), en que cada 100 mL de solución oral para gotas contiene 2,25 mL de Fucus vesiculosus D1 en asociación con otras 7 preparaciones homeopáticas, encontrándose aprobado con la siguiente indicación terapéutica: "Medicamento homeopático útil en el control de sobrepeso"; Cellasene Gold cápsulas blandas, registro Nº N-469/08 (fitofármaco), en que cada cápsula blanda contiene 120 mg de Extracto seco de tallos de Fucus vesiculosus L. (equivalente a 210 mcg de yodo) en asociación con una serie de otros principios activos. La indicación terapéutica autorizada es: "Coadyuvante en el tratamiento de la insuficiencia vascular cerebral y periférica"; y Celltech cápsulas blandas, registro Nº K-52/08 (clasificado en otros), que presenta 120 mg de Extracto seco de tallos de Fucus vesiculosus L. (equivalente a no menos de 240 mcg de yodo) por cada cápsula blanda, en asociación con otros 5 principios activos. La indicación terapéutica autorizada es: "Ayuda a reducir la aparición de Celulitis". Adicionalmente, se debe agregar que la Autoridad Europea de Seguridad de Alimentos (EFSA) establece lo siguiente respecto de los vegetales Fucus vesiculosus: Se detallan nombres en varios idiomas, Se describe como una alga comúnmente encontrada en las costas del Mar del Norte, el oeste del Mar Báltico y los Océanos Atlántico y Pacífico; es un alga muy variable, puede crecer 100 cm o más y es fácilmente reconocible por la pequeñas vesículas llenas de gas que se producen en pares, una a cada lado de una nervadura central, que corre a lo largo de la hoja como una correa. Este producto está presente en el mercado europeo como alimento o ingrediente alimentario y es consumido en un grado significativo desde antes del 15 de mayo de 1997. Por tanto, su acceso al mercado no está sujeto a la regulación de Alimentos Nuevos (EC) Nº 258/97. Sin embargo, algunos estados Miembros pueden restringir su uso como alimento o ingrediente alimentario. Por tanto, se recomienda chequear con las autoridades nacionales competentes, disponible en: http://ec.europa.eu/food/food/biotechnology/novelfood/nfnetweb/mod_search/index.cfm?action=mod_search.list&ascii=65. Los talos de Fucus se encuentran autorizados en Francia con las siguientes indicaciones: Tradicionalmente usado como coadyuvante en tratamientos de pérdida de peso, admitiéndose también como un laxante de volumen. Asimismo, se especifica que la ingesta de yodo no puede exceder los 120 mcg en adultos. Además, la fitoterapia contemporánea y la cosmetología usan esta alga ampliamente por sus microelementos, yodo y otros constituyentes (Jean Brunethon, "Pharmacognosy, Phytochomistry, Medicinal Plants", Intercept Ltd, England, 1995, pag. 47). Se han evaluado en la comisión de RCA 4 productos que contienen Fucus vesiculosus solo a o asociados y todos han quedado clasificados como producto farmacéutico, debido a que estaban destinados a tratamientos para adelgazar.
f. Extracto de Undaria pinnatifida - Wakame: Este Instituto ha evaluado en Régimen de control a aplicar varios productos que contienen dentro de sus ingredientes activos polvo de hojas de algas pardas (Undaria pinnatifida) e importancia nutricional por la presencia de ácidos grasos de la serie omega (poliinsaturados), útiles en la profilaxis de la ateriosclerosis; en la síntesis de Prostaglandinas, por su alto contenido en fibra soluble refuerza su papel laxante así como su efecto antiabsorción de glucosa. En la monografía EFSA no hay comentarios respecto de esta alga en particular, solamente aparece en una referencia bibliográfica cuyo estudio corresponde a un trabajo experimental para determinar el mecanismo de unión de metales pesados como Cadmio y Plomo en la fase acuosa de las algas pardas entre ella la Undaria pinnatifida (Seki H., Auzuku A. 1998. Biosorption of heavy metal ions to brown algae, Macrocystis pyrifera, Kjellmaniella crassiforia, and Undaria pinnatifida. J Colloid and Interface Science 206, 297-301).
g. Extracto de Palmaria palmata - Dulse: Corresponde al alga roja (Rhodophyta) Palmaria palmata (L) Kuntze 1891, también llamada dulse. Crece en las costas del norte de los océanos Atlántico y Pacífico, se usa como aperitivo y como fuente de fibra, son una buena fuente de minerales y vitaminas comparadas con otros vegetales y contienen todos los oligoelementos que necesitan las personas, además de un alto contenido en proteínas, es usada comúnmente en Irlanda, Islandia y la parte atlántica de Canadá tanto como comida como medicina, se puede encontrar en muchas tiendas de comida saludable o mercados de pescado (Guiry, M.D., & Blunden, G. (1991). Seaweed resources in Europe: uses and potential. John Wiley and Sons Ltd.). No hay antecedentes de productos que hayan pasado por RCA con este ingrediente, ni tampoco se han encontrado productos farmacéuticos que lo contengan.
h. Extracto de Lentinus edodes Mycelium - Shiitake (micelio): Corresponde a una seta comestible originaria de Asia del este, hongo Lentinus edodes (BERK.) Pegler, al cual se le atribuyen propiedades nutracéuticas, inmunológicas y anticancerígenas. Este Instituto ha clasificado en RCA varios productos que contienen esta especie en forma de extracto como medicamento: 4Life ECM Plus cápsulas, producto farmacéutico Resol. Nº 5.045, de fecha 19 de octubre de 2009, Lingzhi Coffee 3 en 1, Lingzhi Black Coffee, Cocozhi, 4 Life Transfer Factor Plus fórmula avanzada.
i. Extracto de Grifola frondosa - Maitake: Grifola frondosa es un hongo comestible del tipo polyporo que crece en forma de racimos en la base de los árboles, en particular de los robles. En mercado de los suplementos de los Estados Unidos, así como en las tiendas de comestibles asiáticos, el hongo es conocido por su nombre japonés maitake. Este hongo es nativo del noreste de Japón y de Norte América y es apreciado por la medicina tradicional China y la herbología japonesa como un hongo medicinal, ayuda a equilibrar los sistemas del cuerpo alterados, es ampliamente consumido en Japón, y su popularidad en la cocina occidental está creciendo, aunque el hongo ha sido acusado de causar reacciones alérgicas en casos raros. En 2009, un estudio fase I/II de prueba en humanos, realizado por el Centro de Cáncer Memorial Sloan-Kettering, mostró que maitake podría estimular el sistema inmunológico de las pacientes con cáncer de mama (Deng. G., Lin, H., Seidman, A., Fornier, M., D'Andrea, G., Wesa. K., ... & Cassileth, B. (2009). A phase I/II trial of a polysaccharide extract from Grifola frondosa (Maitake mushroom) in breast cancer patients: inmunological effects. Journal of cancer research and clinical oncology, 135(9), 1215,-1221.). Estudios pequeños en pacientes con cáncer han demostrado que podría estimular las células del sistema inmune, Estudios in vivo han mostrado que Maitake podría estimular tanto el sistema inmune innato como el sistema adaptativo (Kodama, N., Murata, Y., & Nanba, H. (2004). Administration of a polysaccharide from Grifola frondosa stimulates inmune function of normal mice. Journal of medicinal food, 7(2), 141-145). Entre otros estudios. No existen productos registrados con este ingrediente activo. Este Instituto ha clasificado en RCA varios productos que contienen esta especie en forma de extracto como medicamento: 4Life ECM Plus cápsulas, producto farmacéutico Resol. Nº 5.045, de fecha 19 de octubre de 2009, Lingzhi Coffee 3 en 1, Lingzhi Black Coffee, Cocozhi, 4 Life Transfer Factor Plus fórmula avanzada.
j. Extracto de Porphyra umbilicalis - Alga Nori: Se refiere a variedades comestibles de alga marina de las diversas especies de alga roja Porphyra, incluyendo de forma destacada la P. yezoensis y la P. tenera. Nori es un término japonés usado para referirse a distintos tipos de algas incluyendo algunas cianobacterias. Nori también se refiere comúnmente a productos alimenticios creados a base de estos seres marinos, Los productos finales se elaboran cortando las algas en tiras y secándolas mediante un proceso parecido al del papel, se ocupa habitualmente para el sushi. Este Instituto no tiene productos registrados con este ingrediente activo y tampoco hay antecedentes de que haya pasado por RCA algún producto.
d) Al producto se le atribuyen propiedades terapéuticas como inmunoestimulante, sus ingredientes de vegetales, algas y hongos a pesar de estar en dosis subterapéutica no están en las formas usadas en alimento;
e) Por lo tanto, dada la composición y finalidad de uso de Nutrigen I, así como a los antecedentes antes descritos, este producto cumple con la definición de producto farmacéutico y para poder comercializarse en Chile debe contar previamente con un registro sanitario que demuestre, calidad, seguridad y eficacia;
Cuarto: Que, mediante la resolución exenta Nº 4.656, de fecha 4 de diciembre de 2015, de este Instituto, que fuera publicada en el Diario Oficial del 21 de diciembre de 2015, se abrió periodo de información pública en el procedimiento administrativo de determinación del régimen de control que corresponde aplicar a este producto, de 10 días hábiles, contados desde la publicación de dicha resolución en el Diario Oficial, no habiéndose recibido en ese plazo ninguna observación para este procedimiento, y
Teniendo Presente:
Lo dispuesto en el artículo 96º del Código Sanitario; en los artículos 8º y 9º del Reglamento del Sistema Nacional de Control de tos Productos Farmacéuticos de Uso Humano, aprobado por el decreto Nº 3, de 2010, del Ministerio de Salud; la resolución exenta Nº 4.023, del 4 de diciembre de 2013, del Instituto de Salud Pública de Chile; el artículo 59º letra b), del decreto con fuerza de ley Nº 1, de 2005, que fija el texto refundido, coordinado y sistematizado del decreto ley Nº 2.763, de 1979 y de las leyes Nº 18.933 y Nº 18.469, del Ministerio de Salud; lo dispuesto en el Reglamento del Instituto de Salud Pública de Chile, aprobado por el decreto supremo Núm. 1.222, de 1996, de la misma Secretaría de Estado; y las facultades delegadas por la resolución exenta Nº 292, del 12 de febrero del 2014, del Instituto de Salud Pública de Chile, dicto la siguiente:
Resolución:
1. Establécese que el régimen que corresponde aplicar al producto Nutrigen I, presentado por Nutrigenomics, es el propio de los Productos Farmacéuticos.
2. Por lo tanto, deberá regirse por las disposiciones del Reglamento del Sistema Nacional de Control de Productos Farmacéuticos de Uso Humano, decreto Nº 3, de 2010, del Ministerio de Salud.
3. De acuerdo a lo señalado en el artículo 8º, del decreto Nº 3, de 2010, del Ministerio de Salud, desde la fecha de notificación de la presente resolución y mientras no se obtenga el registro sanitario de este medicamento, éste deberá ser retirado del mercado por parte de quien lo distribuye o expende, sin perjuicio de las responsabilidades sanitarias a que ello diere lugar.
4. Lo dispuesto en la presente resolución también será aplicable al resto de los productos que contengan el o los componentes declarados como propios de un producto farmacéutico (artículo 8º, del decreto Nº 3, de 2010).
Anótese, comuníquese, publíquese en el Diario Oficial y en la página web ISP.- Helen Rosenbluth López, Jefa Subdepartamento Registro y Autorizaciones Sanitarias, Departamento Agencia Nacional de Medicamentos, Instituto de Salud Pública de Chile.