DETERMINA PETITORIO FARMACÉUTICO DE LOS ESTABLECIMIENTOS DE EXPENDIO DE MEDICAMENTOS QUE INDICA
Núm. 1.831 exenta.- Santiago, 25 de octubre de 2019.
Vistos:
Lo dispuesto en los Libros Cuarto, Sexto y demás disposiciones pertinentes del decreto con fuerza de ley Nº 725, de 1967, del Ministerio de Salud, que aprueba el Código Sanitario; lo señalado en el decreto con fuerza de ley Nº 1, de 2005, del Ministerio de Salud; los artículos 19, Nº 9 y 32, Nº 6, de la Constitución Política de la República; lo dispuesto en los artículos 94 y 101, ambos del Código Sanitario, modificado por la ley 20.724; el decreto supremo Nº 466, de 1984, del Ministerio de Salud, que aprobó el Reglamento de Farmacias, Droguerías, Almacenes Farmacéuticos, Botiquines y Depósitos autorizados; el memorándum B35 Nº 675, de 9 de octubre de 2019, de la Jefa de División de Políticas Públicas Saludables y Promoción; la resolución Nº 7 de 2019, de la Contraloría General de la República, y
Considerando:
1º Que, al Ministerio de Salud le compete ejercer la función que corresponde al Estado de garantizar el libre e igualitario acceso a las acciones de promoción, protección y recuperación de la salud y de rehabilitación de la persona enferma; así como coordinar, controlar y, cuando corresponda, ejecutar tales acciones
2º Que, conforme con lo anterior, corresponde a esta Secretaría de Estado formular, fijar y controlar las políticas de salud.
3º Que, de acuerdo a las disposiciones del artículo 94º y 101º, ambas del Código Sanitario, compete al Ministerio de Salud determinar los petitorios farmacéuticos con que deberán contar los establecimientos de expendio de productos farmacéuticos.
4º Que, asimismo, el artículo 101 del Código Sanitario dispone que el petitorio farmacéutico será aprobado mediante resolución del Ministerio de Salud.
5º Que, en mérito de lo anterior, dicto la siguiente:
Resolución:
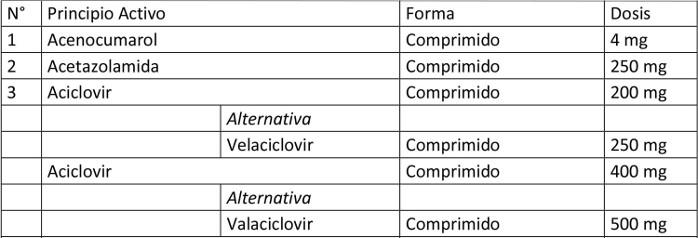
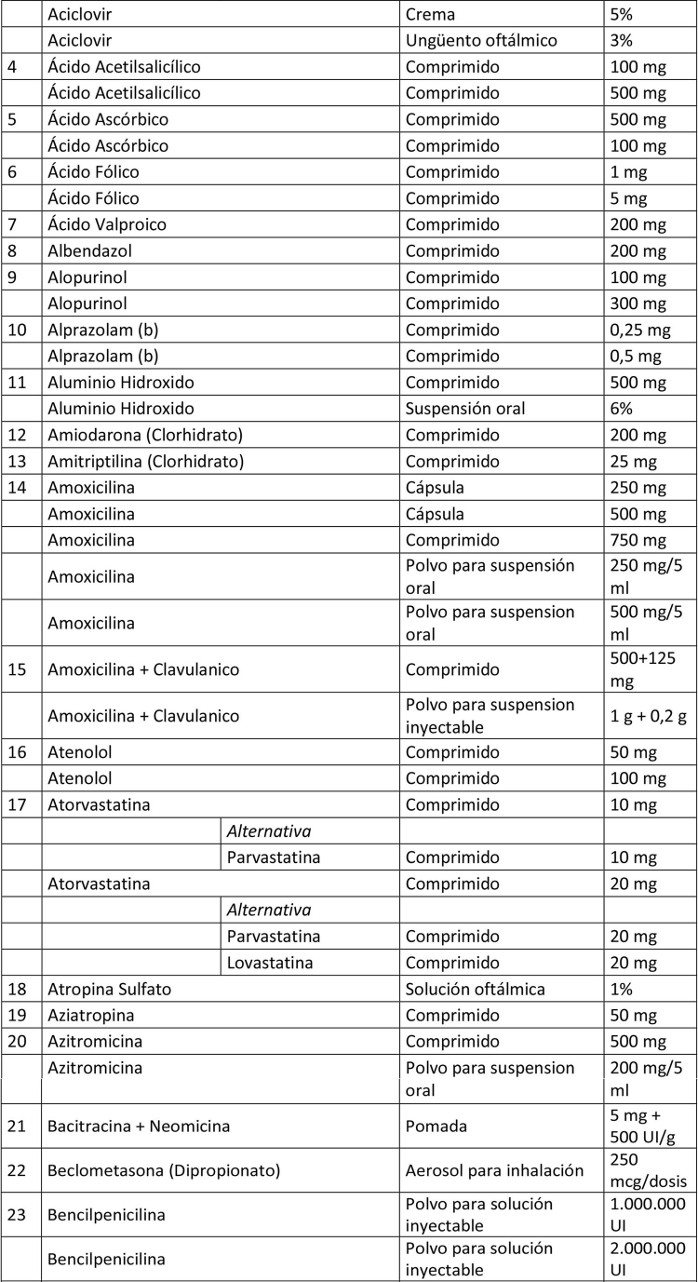
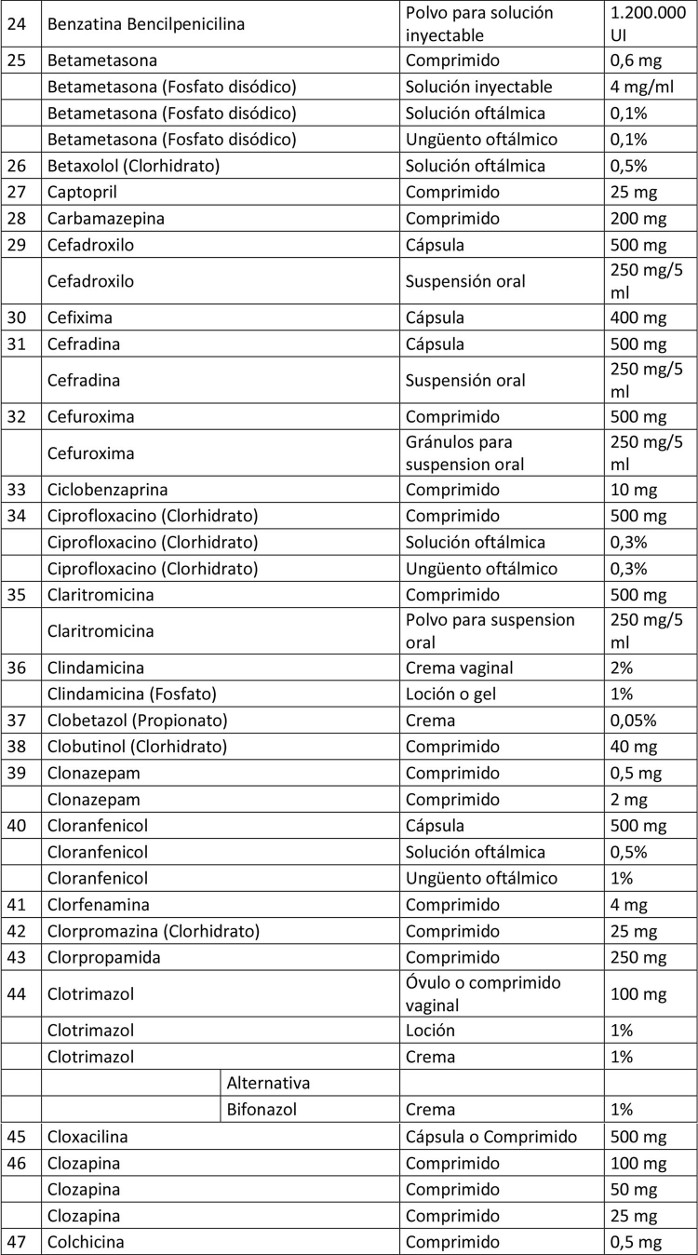
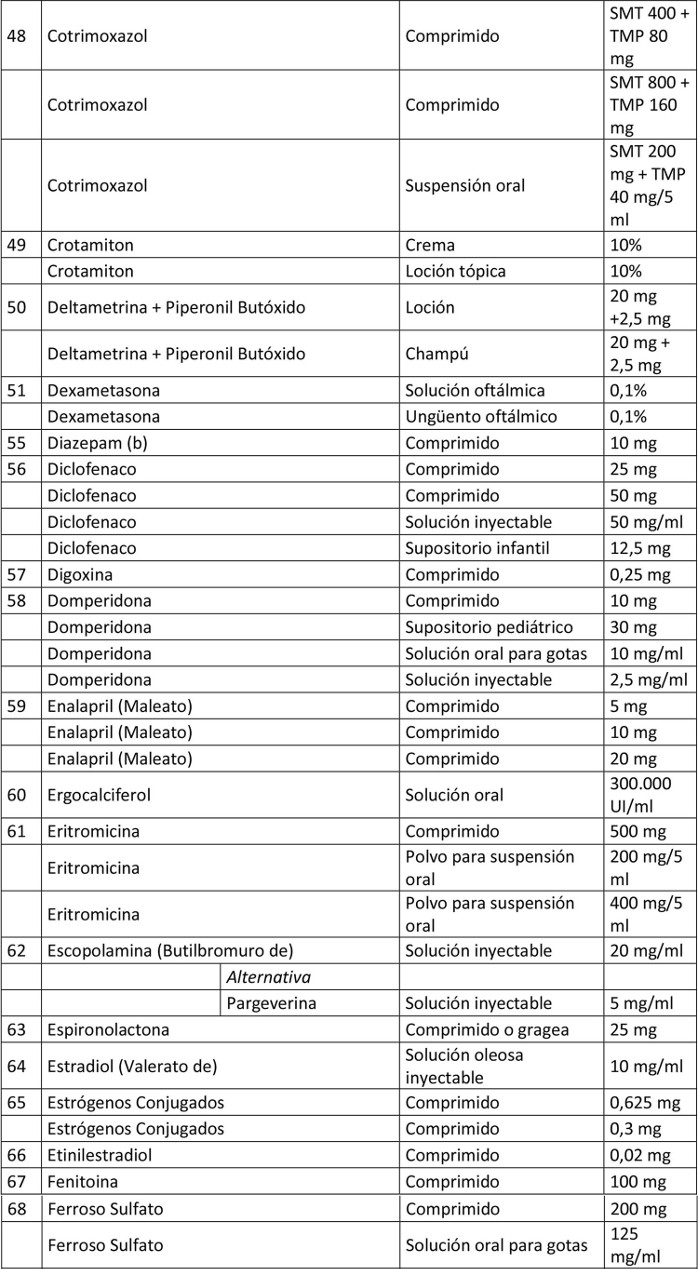
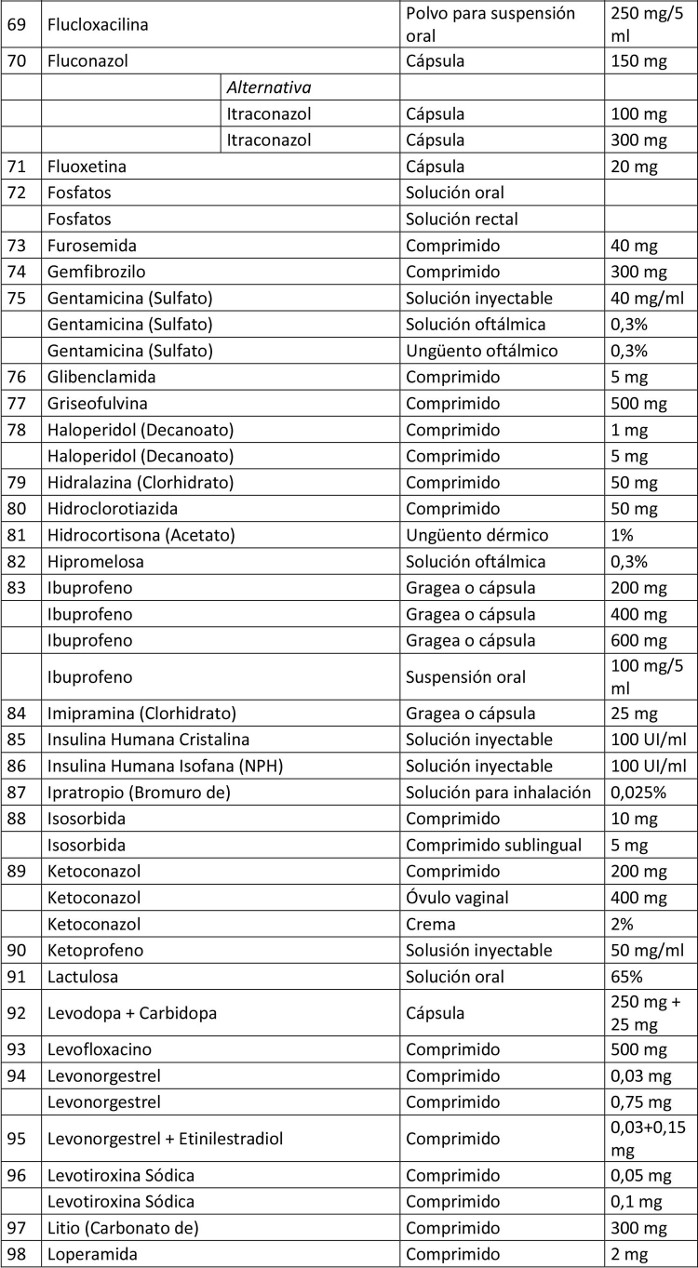
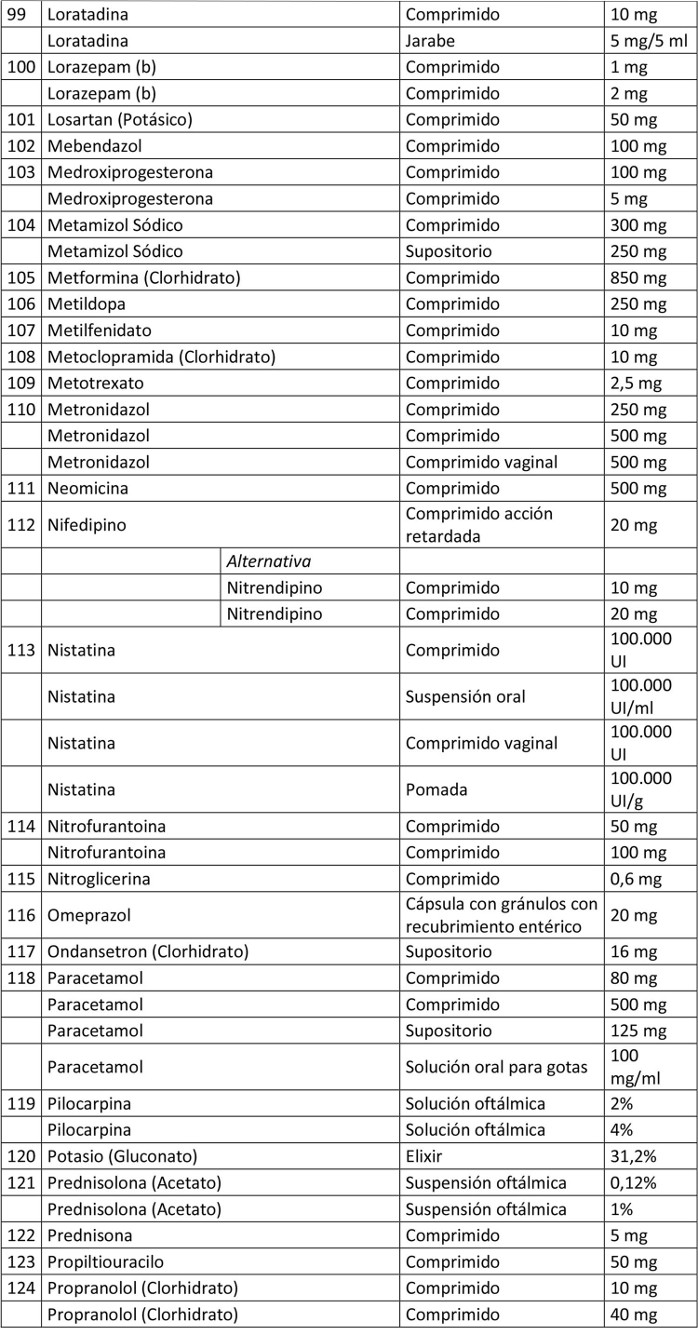
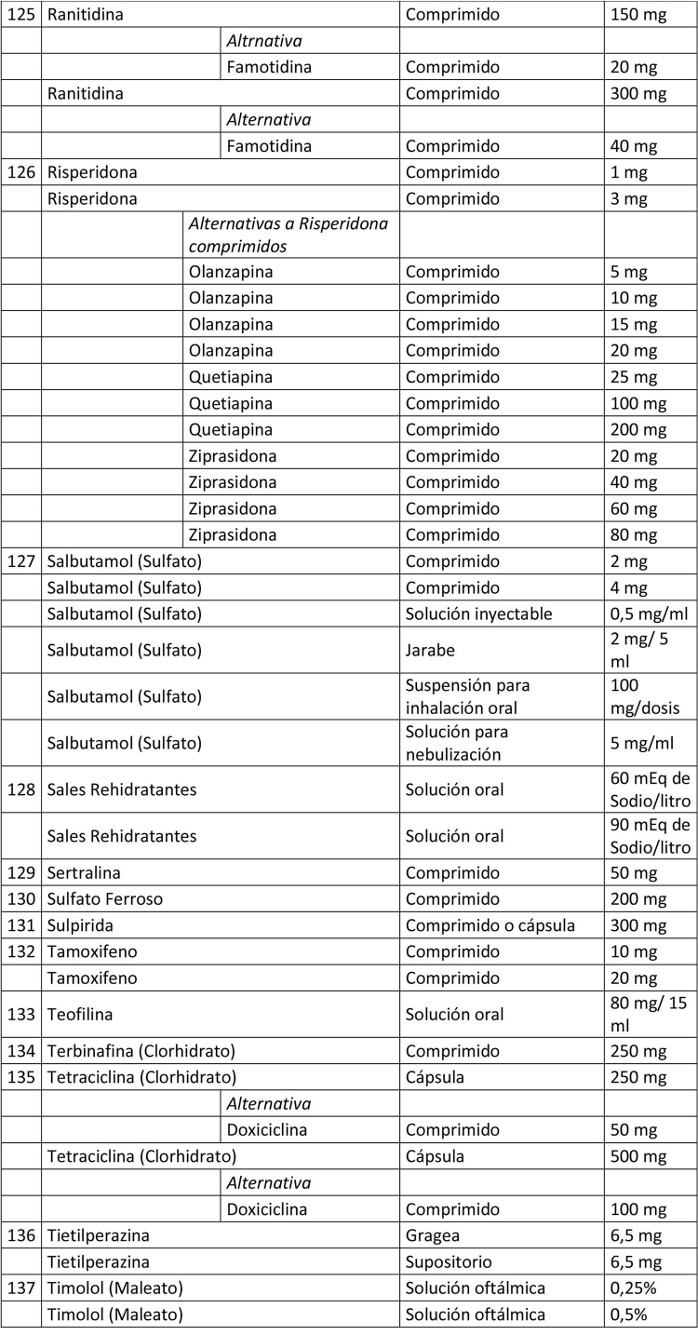
Artículo 1º.- Apruébase el siguiente petitorio farmacéutico para farmacias:
 .
. .
. .
. .
. .
. .
. .
.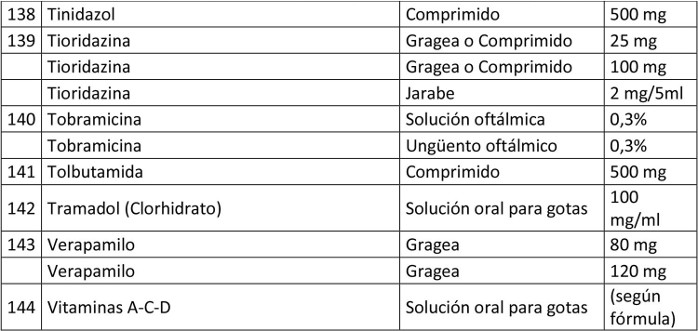 .
. Artículo 2º.- En el caso de aquellos medicamentos contenidos en este petitorio que han debido demostrar su bioequivalencia, la obligación contenida en esta resolución se entenderá cumplida teniendo en existencia al menos un producto farmacéutico, del principio activo que se trate, denominado exclusivamente por su denominación común internacional, es decir, sin que tenga asociada una denominación de fantasía.
Artículo 3º.- Las disposiciones de la presente resolución entrarán en vigencia 15 días corridos desde la fecha de su publicación en el Diario Oficial.
Anótese y comuníquese.- Jaime Mañalich Muxi, Ministro de Salud. Transcribo para su conocimiento resolución exenta Nº 1.831 de 25-10-2019.- Saluda atentamente a Ud., Paula Daza Narbona, Subsecretaria de Salud Pública.