INSTRUYE ACTUALIZAR FOLLETOS DE INFORMACIÓN AL PROFESIONAL Y AL PACIENTE PARA LOS PRODUCTOS FARMACÉUTICOS QUE CONTIENEN FINGOLIMOD EN SU COMPOSICIÓN
Núm. 3.821 exenta.- Santiago, 7 de octubre de 2019.
Vistos estos antecedentes:
1. Las notas informativas emitidas con fechas 14 de diciembre de 2017 y 18 de abril de 2016 por la agencia regulatoria de medicamentos del Reino Unido, MHRA (Medicines and Healthcare Products Agency), abordando riesgos asociados al uso del medicamento Fingolimod, tanto a raíz de las propiedades inmunosupresoras del fármaco, como son algunos tipos de cáncer, infecciones serias y leucoencefalopatía, como riesgos cardiacos, entregando, en el primer caso, recomendaciones orientadas a evitar el uso de este medicamento en pacientes con factores predisponentes, evitar la exposición a factores de riesgo y mantener un estrecho seguimiento para un oportuno diagnóstico y abordaje terapéutico de estas complicaciones, y en el segundo, contraindicando su uso en pacientes que cursan con algunos cuadros cardiovasculares.
2. Las notas informativas de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) emitidas con fechas 21 de diciembre de 2015, 6 de noviembre de 2017 y 26 de julio de 2019; la primera de ellas, entregando recomendaciones sobre los riesgos relacionados con su efecto inmunosupresor, en particular la aparición de infecciones, incluyendo leucoencefalopatía multifocal progresiva (LMP), cáncer cutáneo de células basales y linfoma; la segunda, señalando nuevas contraindicaciones de uso en pacientes con patología cardiaca subyacente y recomendaciones de revisiones dermatológicas, estas últimas a causa de la posibilidad de aparición de alguna neoplasia de la piel; y la tercera, contraindicando Fingolimod en mujeres embarazadas y en aquellas que no usen medidas anticonceptivas eficaces, por el riesgo de malformaciones congénitas asociado al uso de este medicamento.
3. Los comunicados emitidos por la agencia de Estados Unidos, Food and Drug Administration, los días 20 y 26 de noviembre de 2018, advirtiendo sobre el riesgo de empeoramiento de la enfermedad luego de la suspensión del tratamiento con Fingolimod, e informando de la modificación de los folletos de los productos que lo contienen, de forma que los profesionales y pacientes estén en conocimiento de esta posibilidad.
4. El Protocolo 2019 para el tratamiento de segunda línea basado en Fingolimod o Natalizumab o Alemtuzumab o Cladribina u Ocrelizumab, para personas con Esclerosis Múltiple Recurrente Remitente con falla a tratamiento con inmunomoduladores y tratamiento con Ocrelizumab para personas con Esclerosis Múltiple Primaria Progresiva, en donde consta la recomendación de uso de Fingolimod para el tratamiento de esta enfermedad, con cobertura por el Sistema de Protección Financiera para Diagnósticos y Tratamientos de Alto Costo, Ley Nº 20.850.
5. La Nota Informativa emitidas por el Instituto de Salud Pública de Chile (ISP) y publicada en su página web el 31 de julio de 2019, entregando recomendaciones sobre riesgos asociados al uso de Fingolimod, en la que se revisan los aspectos abordados por la presente resolución.
6. La base de datos del Subdepartamento Farmacovigilancia, del Departamento Anamed del ISP, que a través de su sistema de notificación ha recibido 285 reportes de sospechas de reacciones adversas entre los años 2013 y 2018, asociadas a productos que contienen Fingolimod, de los cuales, 43 fueron considerados preliminarmente como casos serios, nueve de los cuales incluyeron eventos adversos de tipo cardiaco y otro reportó una LMP, que no llegó a ser confirmada.
7. La recomendación del Subdepartamento Farmacovigilancia respecto de la necesidad de modificar los registros que contienen Fingolimod, en base a los problemas de seguridad detectados,
Considerando que:
1. Fingolimod es un medicamento con indicación en el tratamiento de pacientes con la forma recidivante de Esclerosis Múltiple (EM) para reducir la frecuencia de las exacerbaciones clínicas y retrasar la progresión de la enfermedad física.
2. La EM corresponde a una enfermedad inflamatoria crónica autoinmune desmielinizante del Sistema Nervioso Central (SNC), caracterizada por episodios que recurren y remiten, y habitualmente se presentan de manera progresiva, que involucran fatiga, parestesia, dolor focal, ataxia, temblor, problemas visuales, disfunción sexual, disfunción vesical y espasticidad, entre otros síntomas, según el territorio del SNC que se encuentre comprometido. El promedio de prevalencia de EM en el mundo es de 30 por cada 100.000 personas, mientras que, en Chile, se calcula en alrededor de 14 por 100.000 habitantes, con unos 2.400 casos en el país, aproximadamente.
3. La Esclerosis Múltiple Remitente Recurrente (EMRR) se incorporó el año 2010 bajo modalidad de Garantía Explícita en Salud, contando también, desde el año 2015, con cobertura a través de la Ley Ricarte Soto para aquellos pacientes refractarios a la terapia habitual, encontrándose Fingolimod incluido en la canasta de prestaciones para dicha enfermedad.
4. Los riesgos reflejados en los antecedentes, procedentes tanto de agencias de referencia a nivel internacional, como de los propios datos de vigilancia del ISP, son relevantes y determinantes para la salud de los pacientes que reciben este medicamento, el que, sin embargo, sigue constituyendo una herramienta terapéutica imprescindible para los afectados por la patología a cuyo tratamiento está orientado.
5. El ISP, en base a su evaluación, considera necesaria la inclusión de nuevas contraindicaciones y advertencias en los folletos de información de los productos farmacéuticos que contienen Fingolimod, de modo que se indique tanto a los pacientes en tratamiento como a los prescriptores, las medidas que deben adoptar para disminuir la probabilidad de presentar alguno de los efectos adversos presentados en los antecedentes, y
Teniendo presente:
Los artículos 96º y 97º de la ley Nº 20.724, que modifica el Código Sanitario en materia de regulación de farmacias y medicamentos; los artículos 63º, 64º, 71º, 218º, 219º y 220º del Reglamento del Sistema Nacional de Control de los Productos Farmacéuticos de Uso Humano, aprobado por decreto supremo Nº 3 de 2010 del Ministerio de Salud; los artículos 59º letra b) y 61º letra b), del DFL Nº 1 de 2005, y las facultades delegadas por la resolución exenta Nº 56 de 11 de enero de 2019, del Instituto de Salud Pública de Chile, dicto la siguiente:
Resolución:
1. Establécese que, los titulares de registros sanitarios de los productos farmacéuticos que contienen el principio activo Fingolimod en su composición, deberán incluir en los folletos de información al profesional y al paciente, la información que, en cada caso, se indica a continuación:
FOLLETO DE INFORMACIÓN AL PROFESIONAL
Contraindicaciones
Fingolimod está contraindicado en pacientes que:
. En los seis meses previos hayan presentado infarto de miocardio, angina inestable, accidente cerebro vascular, accidente isquémico transitorio, insuficiencia cardiaca descompensada o insuficiencia cardiaca de clase III/IV de la New York Heart Association.
. Cursen con arritmias cardiacas graves que requieran tratamiento con antiarrítmicos de la clase I o clase III.
. Con bloqueo aurículo-ventricular (AV) de segundo grado tipo Mobitz tipo II o bloqueo AV de tercer grado, o síndrome del seno enfermo, si no portan marcapasos.
. Con intervalo QT basal > 500 milisegundos.
. Estén cursando un embarazo o estén llevando una vida sexual activa sin medidas efectivas de anticoncepción.
Advertencias y precauciones
Fingolimod tiene un efecto inmunosupresor que puede incrementar el riesgo de cáncer a la piel y linfoma, así como de infecciones oportunistas graves. En virtud de lo anterior, se debe reevaluar el balance beneficio-riesgo de la terapia en pacientes que tengan factores adicionales para desarrollar cáncer.
Antes de iniciar la terapia, se debe examinar a todos los pacientes en busca de lesiones cutáneas, y monitorearlos al menos cada 6-12 meses, según criterio médico. Se debe advertir a los pacientes que deben evitar la exposición a la luz solar sin protección. Estos pacientes no deberán recibir fototerapia con radiación UVB ni foto quimioterapia PUVA.
Se debe considerar la posible aparición de infecciones oportunistas, incluyendo leucoencefalopatía multifocal progresiva. El efecto inmunosupresor de Fingolimod aumenta el riesgo de infecciones virales (herpes simple, varicela zoster, virus papiloma humano), fúngicas (meningitis criptocócica) o bacterianas (micobacterias atípicas), muchas de ellas graves.
Si se considera necesario interrumpir el tratamiento con Fingolimod, se debe hacer un seguimiento de los pacientes durante este periodo para detectar signos indicativos de un posible efecto rebote. Se debe informar a los pacientes, antes de iniciar el tratamiento, sobre el riesgo potencial de un aumento severo de incapacidad, luego de haber discontinuado el tratamiento.
Se debe realizar pruebas para detectar lesiones nuevas o empeoramiento de las preexistentes, mediante imágenes de resonancia magnética, en caso de producirse un aumento en la discapacidad. En tal caso, se debe comenzar con el tratamiento adecuado, según sea necesario.
Mujeres en edad fértil/ Anticoncepción en mujeres
Antes de iniciar el tratamiento en mujeres en edad fértil, es necesario disponer del resultado negativo de un test de embarazo y se les debe advertir del riesgo grave potencial para el feto y de la necesidad de utilizar métodos anticonceptivos efectivos durante el tratamiento con Fingolimod. Como la eliminación de Fingolimod del organismo dura aproximadamente dos meses después de la interrupción del tratamiento, el riesgo potencial sobre el feto puede persistir, y por ello la contracepción debe continuarse durante este periodo.
Embarazo
Durante el tratamiento, las mujeres no deben quedarse embarazadas y se recomienda una anticoncepción activa. Si una mujer se queda embarazada durante el tratamiento con Fingolimod, se recomienda la interrupción del tratamiento.
Los estudios en animales han mostrado toxicidad para la reproducción, incluyendo pérdida fetal y defecto en los órganos. Además, se sabe que el receptor sobre el que actúa Fingolimod (receptor esfingosina 1-fosfato) interviene en la formación vascular que tiene lugar durante la embriogénesis. Hay datos limitados relativos al uso de Fingolimod en mujeres embarazadas. No hay datos de los efectos de Fingolimod sobre el parto y el alumbramiento.
Lactancia
Durante la lactancia Fingolimod se excreta en la leche de los animales tratados. Debido a la posibilidad de que Fingolimod pueda causar reacciones adversas graves en los lactantes, las mujeres que reciben Fingolimod deben interrumpir la lactancia.
Reacciones adversas
A nivel internacional, se han reportado casos de carcinoma de células basales, así como de otras neoplasias de la piel, entre las que se incluyen: melanoma maligno, carcinoma de células escamosas, carcinoma de células de Merckel y sarcomas de Kaposi.
Se han descrito cuadros de fibrilación ventricular y de muerte súbita con el uso de Fingolimod, especialmente en pacientes con antecedentes personales de algún tipo de patología cardiaca. Durante la experiencia post comercialización, se han observado casos de exacerbación grave de la enfermedad en algunos pacientes, tras la interrupción del tratamiento con Fingolimod.
FOLLETO DE INFORMACIÓN AL PACIENTE
Advertencias y precauciones
Fingolimod aumenta el riesgo de desarrollar cáncer, especialmente cáncer de piel. Siga las siguientes recomendaciones para disminuir este riesgo:
. Informe a su médico inmediatamente si nota algún nódulo en la piel, manchas o heridas abiertas que no cicatrizan durante semanas. Los síntomas de un cáncer de piel pueden incluir crecimiento anormal o cambios en el tejido de la piel (p. ej. lunares inusuales).
. Antes de comenzar el tratamiento, se requiere un examen de la piel. Durante el tratamiento, se le realizarán controles periódicos, si aparece algún problema en la piel, su médico puede derivarle a un dermatólogo, quien puede decidir si es importante controlarle de forma más seguida.
. Evite su exposición al sol y a los rayos UV mediante el uso de ropa protectora adecuada y la aplicación frecuente de protectores solares con un índice alto de protección UV.
Fingolimod reduce el número de glóbulos blancos de la sangre, que se encargan de combatir las infecciones.
. Durante el tratamiento con Fingolimod (y hasta dos meses después de interrumpirlo), usted puede contraer infecciones con mayor facilidad o que empeore una que ya padece. Si tiene fiebre, síntomas parecidos a la gripe, dolor de cabeza acompañado de rigidez en la nuca, sensibilidad a la luz, náuseas y/o confusión, contacte inmediatamente con su médico.
. Si cree que su enfermedad está empeorando (siente debilidad o cambios visuales) o si advierte cualquier síntoma nuevo, informe a su médico inmediatamente, porque pueden ser síntomas de una infección cerebral grave, aunque poco común, llamada leucoencefalopatía multifocal progresiva.
. Se ha notificado infección por el virus del papiloma humano (que provoca papilomas, displasia, verrugas y cáncer), en pacientes tratados con Fingolimod. Su médico valorará si necesita vacunarse antes de iniciar el tratamiento. Si es mujer, su médico también le recomendará realizarse revisiones ginecológicas periódicas.
Fingolimod está contraindicado en pacientes con enfermedades cardiacas. Informe a su médico si presenta las siguientes condiciones:
. Latidos irregulares o anormales, electrocardiograma alterado, enfermedad cardiaca, insuficiencia cardiaca, ha sufrido de desmayos repentinos o disminución de los latidos cardiacos. Además, si está tomando otros medicamentos que bajan su frecuencia cardiaca, puede ser que Fingolimod no sea el tratamiento adecuado para usted.
Luego de la suspensión del medicamento, existe el riesgo de que se produzca una reactivación de la enfermedad. Usted debe buscar atención médica inmediata si experimenta signos o síntomas nuevos o que los existentes empeoran ya que deben ser manejados apropiadamente.
Embarazo y lactancia
Si está embarazada o cree que podría estarlo, o si tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento. También consulte con su médico si se encuentra en periodo de lactancia.
Su médico podría pedirle la realización de una prueba de embarazo antes de iniciar el tratamiento con Fingolimod, para asegurarse de que no está embarazada. Se debe evitar quedarse embarazada durante el tratamiento con Fingolimod, y hasta dos meses después de su interrupción, debido a que el medicamento puede causar daño al bebé. Consulte con su médico acerca de los métodos que puede utilizar para evitar el embarazo durante el tratamiento con Fingolimod y los dos meses adicionales después de la interrupción del tratamiento.
Si se queda embarazada durante el tratamiento con Fingolimod, deje de tomar el medicamento e informe inmediatamente a su médico. Su médico y usted deberán decidir qué es lo mejor para usted y su bebé.
La madre que esté en tratamiento con Fingolimod no deberá dar pecho. Fingolimod pasa a la leche materna y existe el riesgo de que el bebé pueda presentar efectos adversos, algunos de ellos graves.
Posibles efectos adversos
De frecuencia "no conocida": Se han reportado casos de carcinoma de células basales, así como de otras neoplasias de la piel.
Se han descrito cuadros de fibrilación ventricular y de muerte súbita con el uso de Fingolimod, especialmente en pacientes con antecedentes personales de algún tipo de patología cardiaca. Se ha observado casos de exacerbación grave de la enfermedad en algunos pacientes tras la interrupción del tratamiento con Fingolimod.
2. Determínase que los titulares de los registros sanitarios de los productos farmacéuticos que a continuación se indican, deberán someter a la aprobación de este Instituto, los folletos de información al profesional y paciente, que incluyan los aspectos señalados en el punto anterior, en un plazo que no exceda de 90 días, contados desde la fecha de publicación de esta resolución.
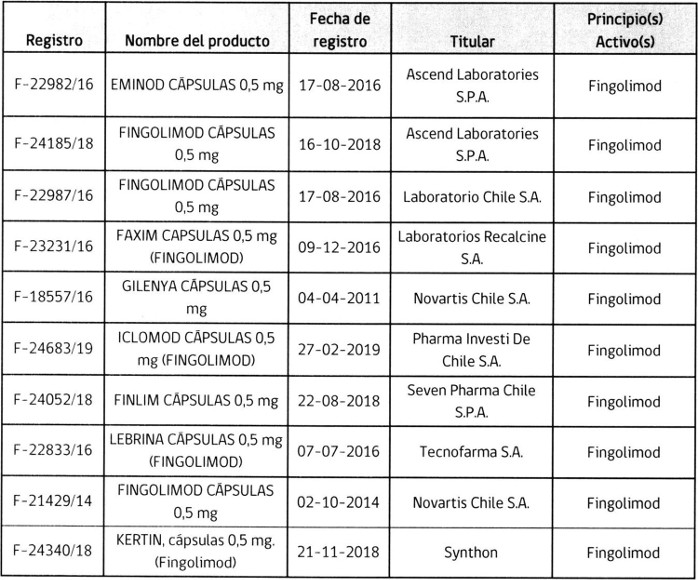 .
. Anótese, comuníquese y publíquese en el Diario Oficial y en la página web del Instituto de Salud Pública de Chile.- Guisela Zurich Reszczynski, Jefa (S) Subdepartamento Autorizaciones y Registros Sanitarios, Agencia Nacional de Medicamentos.