INSTRUYE ACTUALIZAR FOLLETOS DE INFORMACIÓN AL PROFESIONAL Y AL PACIENTE PARA LOS PRODUCTOS FARMACÉUTICOS QUE CONTIENEN OLANZAPINA EN SU COMPOSICIÓN
Núm. 4.491 exenta.- Santiago, 25 de noviembre de 2019.
Visto estos antecedentes:
1. El comunicado de seguridad de medicamentos publicado por la Food and Drug Administration (FDA) de Estados Unidos, con fecha 05/10/2016, en el que se informa acerca de casos poco frecuentes de "Síndrome de Reacción a Fármacos con Eosinofilia y Síntomas Sistémicos" o DRESS, por sus siglas en inglés, atribuido a la sustancia activa olanzapina. Como consecuencia, la FDA instruyó agregar una nueva advertencia al etiquetado de todos los productos farmacéuticos que contengan dicho principio activo, que estén bajo su jurisdicción. La base de datos del sistema de reportes de eventos adversos de la FDA (FAERS) registra 23 casos reportados de DRESS vinculados a olanzapina desde 1996, cuando el primer producto conteniendo aquel principio activo fue aprobado en el mundo. DRESS es un síndrome de reacción a fármacos, potencialmente mortal, con una tasa de mortalidad de hasta el 10%.
2. Los folletos de información al profesional y al paciente de los registros sanitarios de olanzapina vigentes en Chile, algunos de los cuales carecen de las advertencias mencionadas, o éstas resultan insuficientes.
Considerando que:
El principio activo olanzapina se utiliza como medicamento antipsicótico, para tratar trastornos de salud mental como esquizofrenia y desorden bipolar, disminuyendo las alucinaciones y otros síntomas psicóticos, como el pensamiento desorganizado, propio de estos cuadros;
1. Olanzapina está incluida en la canasta GES para el tratamiento de la Esquizofrenia, el Trastorno Bipolar y de la Depresión con psicosis, alto riesgo suicida o refractariedad, por lo que es una terapia esencial en el sistema de salud público de nuestro país;
2. La FDA ha entregado las siguientes recomendaciones, tanto a profesionales de la salud como pacientes, respecto de las advertencias y precauciones anteriormente detalladas:
. Pacientes que consumen algún producto que contienen en su formulación olanzapina, y manifiestan fiebre con rash y ganglios linfáticos inflamados o hinchazón en la cara, deben buscar atención medica de inmediato. La combinación y presencia de dichos síntomas comúnmente son observados en el "Síndrome de Reacción a Fármacos con Eosinofilia y Síntomas Sistémicos". No deje de tomar olanzapina ni cambie su dosis sin antes hablar con su médico tratante. La suspensión repentina del medicamento puede ser dañina sin la supervisión directa de un profesional.
. Los profesionales de la Salud deben interrumpir inmediatamente un tratamiento con olanzapina si se sospecha de DRESS. Actualmente no existe un tratamiento específico para dicho síndrome. Se debiera considerar un tratamiento con corticoesteroides sistémicos en caso de haber compromiso orgánico. Cuando se prescribe este medicamento, el profesional de la salud debe explicar a sus pacientes los signos y síntomas de las reacciones severas a la piel que pueden manifestarse, y en qué casos ellos deben buscar atención médica inmediata.
3. El Instituto de Salud Pública, en base a su evaluación, considera necesaria la actualización de las secciones advertencias, precauciones y reacciones adversas de los folletos de información, tanto al paciente como al profesional, de todos los productos farmacéuticos contienen olanzapina, respecto de la manifestación del DRESS.
Teniendo presente:
Los artículos 96º y 97º de la ley Nº 20.724, que modifica el Código Sanitario en materia de regulación de farmacias y medicamentos; los artículos 63º, 64º, 71º, 218º, 219º y 220º del Reglamento del Sistema Nacional de Control de los Productos Farmacéuticos de uso Humano, aprobado por decreto supremo Nº 3 de 2010 del Ministerio de Salud; los artículos 59º letra b) y 61º letra b), del DFL Nº 1 de 2005, y las facultades delegadas por la resolución exenta Nº 56 de 11 de enero de 2019, del Instituto de Salud Pública de Chile, dicto la siguiente
Resolución:
1.- Establécese que los titulares de registros sanitarios de los productos farmacéuticos que contienen el principio activo olanzapina en su composición, deberán incluir en los folletos de información al profesional y al paciente, la información que, en cada caso, se indica a continuación:
FOLLETO DE INFORMACIÓN AL PROFESIONAL
Advertencias y Precauciones
Síndrome de Reacción a Fármacos con Eosinofilia y Síntomas Sistémicos (DRESS):
Se han informado casos de DRESS en pacientes tratados con olanzapina. DRESS puede presentarse como una reacción cutánea (como rash o dermatitis exfoliativa), acompañada de eosinofilia, fiebre, y/o linfadenopatía, pudiendo tener complicaciones sistémicas, como hepatitis, nefritis, neumonitis, miocarditis, y/o pericarditis. DRESS es una reacción que puede llegar a ser fatal. Si sospecha de DRESS, discontinúe el tratamiento con olanzapina. Informe al paciente o a su cuidador que debe consultar a su médico lo más pronto posible si empieza con cualquier signo o síntomas que pueden estar asociado a DRESS.
Reacciones Adversas:
Experiencia post-comercialización:
Síndrome de Reacción a Fármacos con Eosinofilia y Síntomas Sistémicos (DRESS)
FOLLETO DE INFORMACIÓN AL PACIENTE
Reacciones adversas:
Síndrome de Reacción a Fármacos con Eosinofilia y Síntomas Sistémicos (DRESS):
DRESS puede presentarse con el uso de olanzapina. Las características de DRESS pueden incluir erupciones en la piel, fiebre, ganglios inflamados y la afectación de órganos internos como: hígado, riñón, pulmones y corazón. DRESS podría llegar a ser fatal, por lo tanto, comuníquese con su doctor inmediatamente si usted presenta algunos de estos signos.
2.- Determínase que los titulares de los registros sanitarios de los productos farmacéuticos que a continuación se indican, deberán someter a la aprobación de este Instituto los folletos de información al profesional y paciente, que incluyan los aspectos señalados en el punto anterior, en un plazo que no exceda de 90 días, contados desde la fecha de publicación de esta resolución, a menos que éstos ya consideren los cambios solicitados.
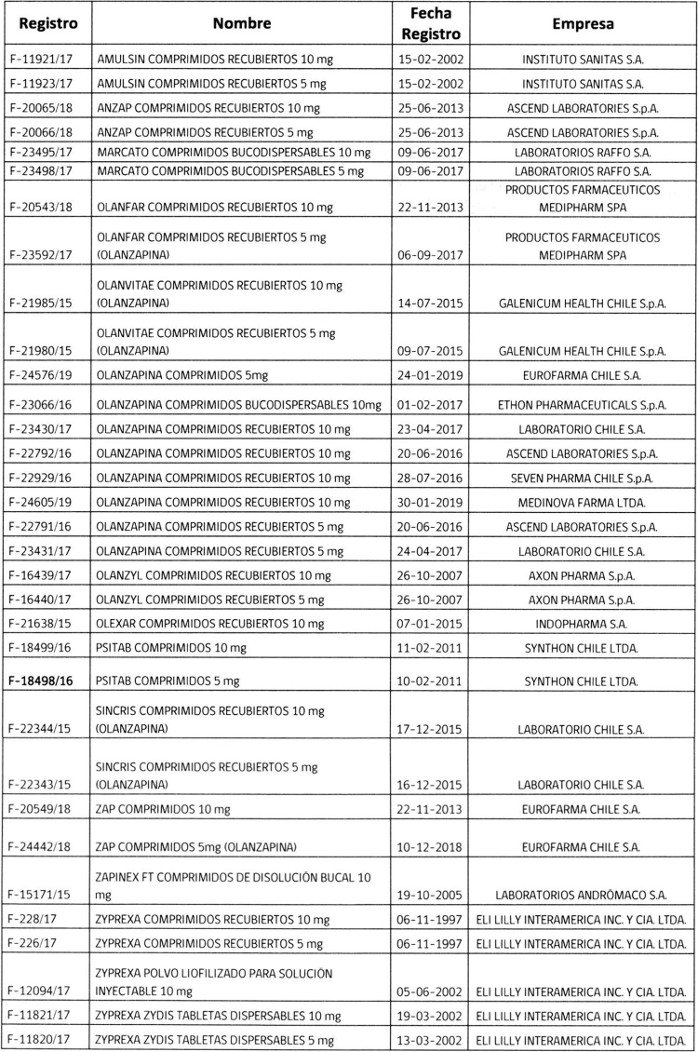 .
. 3.- Establécese que todo registro sanitario de producto farmacéutico inyectable que contenga el principio activo olanzapina, que se conceda o sea solicitado con posterioridad a la publicación de la presente resolución en el Diario Oficial, deberá cumplir con las exigencias establecidas en ésta.
Anótese, comuníquese y publíquese en el Diario Oficial y la página web del Instituto de Salud Pública.- Andrea Pando Seisdedos, Jefa (S) Subdepartamento Autorizaciones y Registros Sanitarios, Agencia Nacional de Medicamentos.