INSTRUYE ACTUALIZAR FOLLETOS DE INFORMACIÓN AL PROFESIONAL Y AL PACIENTE PARA LOS PRODUCTOS FARMACÉUTICOS QUE CONTIENEN FINASTERIDA EN SU COMPOSICIÓN
Núm. 4.739 exenta.- Santiago, 11 de diciembre de 2019.
Visto estos antecedentes:
1. El reporte de seguridad de medicamentos de fecha 24 de mayo del 2017 publicado por la Agencia Reguladora (MHRA) (Medicines and Healthcare products Regulatory Agency), del Reino Unido, el cual informa la recepción de reportes de reacciones adversas como depresión y, en raros casos, pensamientos suicidas, en hombres adultos que consumen medicamentos que contienen en su formulación el principio activo finasterida, tanto para las concentraciones de 1 mg (Propecia®), como de 5 mg (Proscar®), ambas marcas comerciales registradas bajo su jurisdicción. La depresión y los pensamientos suicidas se han reportado en hombres con y sin un historial previo de depresión. El estado de ánimo deprimido había sido previamente asociado con este medicamento; sin embargo, una revisión reciente de la evidencia sugiere que puede ocurrir una depresión más significativa a la ya pesquisada, por lo que la agencia reguladora instruye la actualización de la información referida a las precauciones de dichos productos, con el fin de que estas reflejen lo anterior.
2. Las publicaciones científicas recientes identificadas en la base de datos PUBMED, entre las que destaca el estudio Association of Suicidality and Depression With 5 ? -Reductase Inhibitors publicado en JAMA Internal Medicine 2017; 177(5): 683-691 el cual, si bien no logra demostrar un incremento en el riesgo de suicidio asociado con el uso de los inhibidores de 5 ? -reductasa, sí detectó un incremento en el riesgo de autolesión y depresión en hombres mayores de 66 años, al compararlos con hombres no expuestos del mismo rango etario.
3. Los folletos de información al profesional y al paciente de los registros sanitarios de finasterida vigentes tanto en el Reino Unido como en España para sus concentraciones de 1 mg y 5 mg, los que reflejan advertencias relacionadas con este nuevo riesgo identificado.
4. Los folletos de información al profesional y al paciente de los registros sanitarios de finasterida vigentes en Chile, los que carecen de las advertencias mencionadas para su uso en pacientes, o bien, éstas son insuficientes.
Considerando que:
1. El principio activo finasterida es un inhibidor 5 ? -reductasa tipo 2, que en dosis de 1 mg está indicado para el tratamiento de la alopecia androgénica en hombres adultos, y en dosis de 5 mg, lo está tanto para el tratamiento como para el control de la hiperplasia prostática benigna;
2. La depresión, de acuerdo a la definición del Ministerio de Salud, es una alteración patológica del estado de ánimo, caracterizada por un descenso del humor que termina en tristeza, acompañado de diversos síntomas y signos que persisten por a lo menos 2 semanas, cuyas características prominentes en todas las edades, incluyen alteraciones en el estado de ánimo, depresión o irritabilidad, cambios concomitantes en el sueño, el interés en las actividades, sentimientos de culpa, pérdida de energía, problemas de concentración, cambios en el apetito, el procesamiento psicomotor (retraso o agitación), e ideación suicida, siendo por estas razones, la principal causa de discapacidad en el mundo, en términos de número total de años de vida perdidos ajustados por discapacidad (AVISA);
3. Los folletos de información al profesional y al paciente de los productos farmacéuticos que contienen finasterida, en concentración tanto de 1 mg como de 5 mg, vigentes en el Reino Unido y España, incluyen esta nueva información en las secciones de advertencias y precauciones, y descripción de reacciones adversas. Con respecto a la frecuencia de aparición de la depresión, las agencias mencionadas la clasifican como poco frecuente para finasterida de 1 mg y desconocida para finasterida de 5 mg;
4. Si bien el Centro Nacional de Farmacovigilancia no ha recibido reportes relacionando el uso de finasterida con depresión o ideación suicida, sí registra 3 reportes que informan de casos de disfunción sexual en individuos de sexo masculino, efecto que puede incidir en un ánimo depresivo;
5. En virtud de lo expuesto, es importante advertir tanto a los pacientes como a los médicos y al resto del personal sanitario, de este riesgo, de forma que puedan identificarlo oportunamente y adoptar la conducta de resguardo correspondiente; y
Teniendo presente:
Los artículos 96° y 97° de la ley N° 20.724, que modifica el Código Sanitario en materia de regulación de farmacias y medicamentos; los artículos 63°, 64°, 71°, 218°, 219° y 220° del Reglamento del Sistema Nacional de Control de los Productos Farmacéuticos de Uso Humano, aprobado por decreto supremo N° 3 de 2010 del Ministerio de Salud; los artículos 59° letra b) y 61° letra b), del DFL N° 1 de 2005, y las facultades delegadas por la resolución exenta N° 56 de 11 de enero de 2019, del Instituto de Salud Pública de Chile, dicto la siguiente:
Resolución
1.- Establécese que, los titulares de registros sanitarios de los productos farmacéuticos que contienen el principio activo finasterida en su composición, deberán incluir en los folletos de información al profesional y al paciente, la información que, en cada caso, se indica a continuación:
FOLLETO DE INFORMACIÓN AL PROFESIONAL FINASTERIDA 5 mg
Advertencias y precauciones:
Alteración del estado de ánimo y depresión
Se han notificado alteraciones del estado de ánimo, incluyendo estado de ánimo deprimido, depresión y, con menor frecuencia, ideación suicida, en pacientes tratados con finasterida 5 mg. Se debe supervisar a los pacientes en relación con síntomas psiquiátricos y, si éstos ocurren, se debe indicar al paciente que busque consejo médico.
Reacciones Adversas:
Trastornos psiquiátricos
Frecuencia no conocida: depresión.
FOLLETO DE INFORMACIÓN AL PACIENTE FINASTERIDA 5 mg
Advertencias y precauciones:
Alteraciones del estado de ánimo y depresión
Se han comunicado alteraciones del estado de ánimo, como estado de ánimo deprimido, depresión y, con menor frecuencia, ideas de suicidio en pacientes tratados con finasterida. Si experimenta cualquiera de estos síntomas, consulte con su médico lo antes posible.
Reacciones Adversas:
Trastornos psiquiátricos
Frecuencia no conocida: depresión (sensación de tristeza importante y falta de interés).
FOLLETO DE INFORMACIÓN AL PROFESIONAL FINASTERIDA 1 mg
Advertencias y precauciones:
Alteraciones del estado de ánimo y depresión
Se han notificado alteraciones del estado de ánimo, incluido estado de ánimo deprimido, depresión y, con menor frecuencia, ideación suicida en pacientes tratados con finasterida 1 mg. Se debe supervisar a los pacientes en relación a síntomas psiquiátricos y, si éstos ocurren, se debe interrumpir el tratamiento con finasterida e indicar al paciente que busque consejo médico.
Reacciones Adversas:
Trastornos psiquiátricos
Poco frecuentes: Depresión.
FOLLETO DE INFORMACIÓN AL PACIENTE FINASTERIDE 1 mg
Advertencias y precauciones:
Alteraciones del estado de ánimo y depresión
Se han comunicado alteraciones del estado de ánimo, como estado de ánimo deprimido, depresión y, con menor frecuencia, ideas de suicidio en pacientes tratados con finasterida 1 mg. Si experimenta cualquiera de estos síntomas, deje de tomar finasterida 1 mg y consulte con su médico lo antes posible.
Reacciones Adversas:
Trastornos psiquiátricos
Poco frecuentes (pueden afectar hasta 1 de 100 pacientes): depresión (sensación de tristeza importante y falta de interés).
2.- Determínase que los titulares de los registros sanitarios de los productos farmacéuticos que a continuación se indican, deberán, en caso que sus folletos no cumplan con lo instruido en el punto anterior, someter a la aprobación de este Instituto, los folletos de información al profesional y paciente que incluyan los aspectos señalados, en un plazo que no exceda de 90 días, contados desde la fecha de publicación de esta resolución.
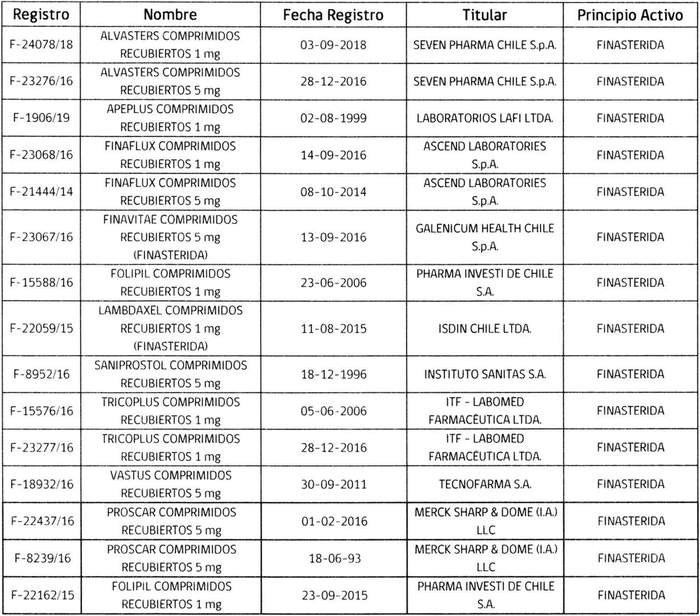
3.- Aclárase que todo registro sanitario de producto farmacéutico que contenga el principio activo finasterida en potencias de 1 o 5 mg, que se conceda o sea solicitado con posterioridad a la publicación de la presente resolución en el Diario Oficial, deberá cumplir con las exigencias establecidas en ésta.
Anótese, comuníquese y publíquese en el Diario Oficial y la página web del Instituto de Salud Pública.- Andrea Pando Seisdedos, Jefa (S) Subdepartamento Autorizaciones y Registros Sanitarios, Departamento Agencia Nacional de Medicamentos.