INSTRUYE ACTUALIZAR FOLLETOS DE INFORMACIÓN AL PROFESIONAL Y AL PACIENTE PARA LOS PRODUCTOS FARMACÉUTICOS QUE CONTIENEN DICLOFENACO (FORMULACIONES SISTÉMICAS) EN SU COMPOSICIÓN
Núm. 958 exenta.- Santiago, 9 de marzo de 2020.
Visto estos antecedentes:
1. Las conclusiones científicas y el respaldo para modificar los términos de autorización de comercialización para diclofenaco (formulaciones sistémicas), en relación con nuevos riesgos identificados denominados "síndrome de Kounis" y "fuga anastomótica", publicadas por la Agencia Europea de Medicamentos (EMA, por su sigla en inglés), las que tuvieron en cuenta el Informe de Evaluación del Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC por su siglas en inglés) sobre los informes periódicos de seguridad (IPS) para dicho medicamento.
2. La declaración del Grupo de Coordinación para Reconocimiento Mutuo y Procedimientos Descentralizados - Humanos de la EMA (CMDH por su sigla en inglés), señalando estar de acuerdo con las conclusiones científicas del Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC, por su sigla en inglés) y considerar necesario modificar las autorizaciones de comercialización del producto evaluado, en el ámbito de la evaluación única de ese IPS, concluyendo que el balance beneficio-riesgo de los productos farmacéuticos que contienen en su formulación diclofenaco (formulaciones sistémicas) no se modifica, ante los cambios propuestos.
3. Los folletos de información al profesional y al paciente de los registros sanitarios que en Chile contienen diclofenaco (formulaciones sistémicas), tanto como monodroga como en asociación, los que, en algunos de los casos, carecen de esta información y en otras esta resulta insuficiente o no se establece claramente la correlación positiva de los riesgos identificados (fuga anastomótica y síndrome de Kounis) con el uso de diclofenaco.
4. La literatura médica, que describe el síndrome de Kounis como "la isquemia miocárdica aguda relacionada con la liberación de mediadores inflamatorios que llevan a vasoespasmo coronario y/o complicación de una placa ateromatosa durante una reacción alérgica" y la fuga anastomótica como "la salida de contenido de la luz intestinal a través de la unión quirúrgica entre dos vísceras huecas", si bien persiste controversia respecto de esta última definición.
5. Las diferentes publicaciones científicas que respaldan la asociación de diclofenaco administrado por vía sistémica con el síndrome de Kounis; esencialmente, reportes de casos.
6. Las publicaciones científicas que respaldan la asociación de diclofenaco administrado por vía sistémica y fuga anastomótica gastrointestinal, entre ellas, un metaanálisis realizado por Modasi et al (2019), quienes observaron que el uso post operatorio de AINES se asoció con un mayor riesgo de fuga anastomótica, siendo los AINES no selectivos, los que fueron asociados con un mayor riesgo [OR 1,79 (1,47-2,18), p <0.00001]. Entre ellos, el diclofenaco se asoció con un aumento significativo de la tasa de fuga [OR 2,79 (1,96-3,96), p <0.00001].
7. Los reportes de sospechas de reacciones adversas contenidos en la Base de datos del Centro Nacional de Farmacovigilancia, en donde se registran dos casos descritos como Shock anafiláctico asociados a diclofenaco (formulaciones sistémicas) desde el año 2017.
Considerando que:
1. Las formulaciones sistémicas del principio activo diclofenaco, están clasificadas como analgésicos antiinflamatorios no esteroidales y se indican en el tratamiento de procesos inflamatorios dolorosos, el síndrome febril y en estados dolorosos post-operatorios.
2. Las conclusiones científicas a las que llegó el PRAC, basándose tanto en la revisión de literatura científica como en datos provenientes de casos reportados y expedientes de seguridad, sostienen que:
a. No puede excluirse una correlación positiva entre "fuga anastomótica" y diclofenaco (formulaciones sistémicas), por lo cual recomienda incluir esta información como advertencia en la ficha técnica de los productos que lo contienen. Acorde a lo anterior, el prospecto de esos productos, también debe ser actualizado.
b. No puede excluirse una relación causal entre "síndrome de Kounis" y diclofenaco (formulaciones sistémicas) por lo que recomienda incluir dicha información como advertencia y reacción adversa de frecuencia "no conocida" en la ficha técnica de estos productos, debiendo actualizarse también su prospecto.
3. El Instituto de Salud Pública de Chile realizó un estudio que reveló que, entre los 20 medicamentos más comercializados en el periodo junio 2015 a mayo 2016, diclofenaco en su formulación oral (dosis de 50 mg -100 mg) es uno de los principios activos más comprados en nuestro país. Las reacciones adversas de los medicamentos pueden presentarse con una frecuencia proporcional a su consumo, por lo que la población debiera saber reconocerlas y tomar las medidas adecuadas en caso de ser necesario.
4. El Instituto de Salud Pública, en base a su evaluación, considera necesaria la inclusión de las advertencias, recomendaciones y efectos adversos señalados en la presente resolución, en los folletos de información, tanto al paciente como al profesional, de todas las formulaciones sistémicas de los productos farmacéuticos que contienen diclofenaco.
Teniendo presente:
Los artículos 96º y 97º de la ley Nº 20.724, que modifica el Código Sanitario en materia de regulación de farmacias y medicamentos; los artículos 63º, 64º, 71º, 218º, 219º y 220º del Reglamento del Sistema Nacional de Control de los Productos Farmacéuticos de uso Humano, aprobado por decreto supremo Nº 3 de 2010 del Ministerio de Salud; los artículos 59º letra b) y 61º letra b), del DFL Nº 1 de 2005, y las facultades delegadas por la resolución exenta Nº 56 de 11 de enero de 2019, del Instituto de Salud Pública de Chile, dicto la siguiente:
Resolución:
1.- Establécese que los titulares de registros sanitarios de los productos farmacéuticos que contienen el principio activo diclofenaco (formulaciones sistémicas) en su composición, deberán incluir en los folletos de información al profesional y al paciente, la información que, en cada caso, se indica a continuación:
FOLLETO DE INFORMACIÓN AL PROFESIONAL
Advertencias y precauciones:
Efectos gastrointestinales
Los AINEs, incluido el diclofenaco, pueden aumentar el riesgo de fuga anastomótica gastrointestinal. Se recomienda una vigilancia médica estrecha y precaución cuando se utilice diclofenaco después de una intervención quirúrgica gastrointestinal.
Trastornos del sistema cardiaco
Al igual que con otros AINEs, con diclofenaco, en casos raros, pueden aparecer reacciones alérgicas, inclusive reacciones anafilácticas o anafilactoides, aunque no haya habido exposición previa al medicamento. Las reacciones de hipersensibilidad también pueden evolucionar a un síndrome de Kounis, una reacción alérgica grave que puede cursar con un infarto de miocardio. Los síntomas iniciales de estas reacciones pueden consistir en dolor torácico asociado a una reacción alérgica al diclofenaco.
Efectos Adversos
Trastornos del sistema cardiaco
Frecuencia no conocida: Síndrome de Kounis.
FOLLETO DE INFORMACIÓN AL PACIENTE
Advertencias y precauciones:
Efectos gastrointestinales
Informe a su médico si se ha sometido recientemente o se va a someter a una intervención quirúrgica del estómago o el intestino antes de usar diclofenaco, ya que diclofenaco puede, a veces, empeorar la cicatrización de las heridas en el intestino después de una intervención quirúrgica.
Trastornos del sistema cardiaco
Al igual que con otros antiinflamatorios no esteroidales (AINES), con diclofenaco, en casos raros, pueden aparecer reacciones alérgicas, inclusive reacciones anafilácticas o anafilactoides, aunque no haya habido exposición previa al medicamento. Las reacciones de hipersensibilidad también pueden evolucionar a un síndrome de Kounis, una reacción alérgica grave que puede cursar con un infarto de miocardio. Los síntomas iniciales de estas reacciones pueden consistir en dolor torácico asociado a una reacción alérgica al diclofenaco.
Efectos adversos
Trastornos del sistema cardiaco
Dolor de pecho, que puede ser un signo de una reacción alérgica potencialmente grave llamada síndrome de Kounis.
Si estos síntomas aparecen, informe inmediatamente a su médico.
2.- Determínase que los titulares de los registros sanitarios de los productos farmacéuticos que a continuación se indican, deberán, en caso que sus folletos no cumplan con lo instruido en el punto anterior, someter a la aprobación de este instituto, los folletos de información al profesional y paciente que incluyan los aspectos señalados, en un plazo que no exceda de 90 días, contados desde la fecha de publicación de esta resolución.
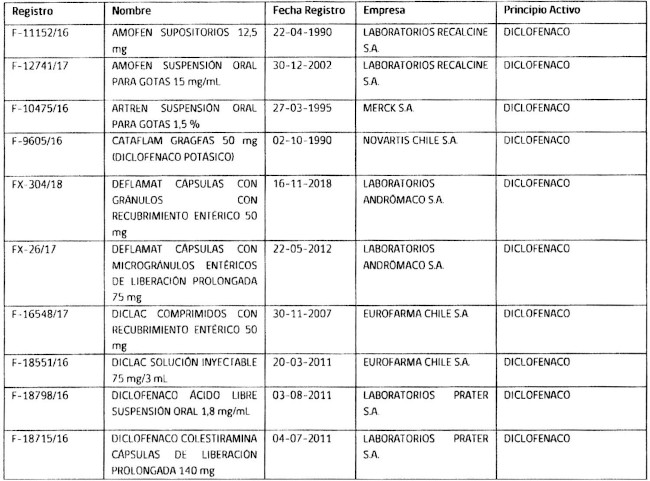 .
. .
. .
. .
. .
. .
. 3.- Establécese que todo registro sanitario de producto farmacéutico que contenga el principio activo diclofenaco (formulación sistémica), que se conceda o sea solicitado con posterioridad a la publicación de la presente resolución en el Diario Oficial, deberá cumplir con las exigencias establecidas en ésta.
Anótese, comuníquese y publíquese en el Diario Oficial y la página web del Instituto de Salud Pública.- Patricia Carmona Sepúlveda, Jefa Subdepartamento Autorizaciones y Registros Sanitarios, Departamento Agencia Nacional de Medicamentos, Instituto de Salud Pública de Chile.