APRUEBA FORMATO DE PRESENTACIÓN DE ANTECEDENTES PARA LAS SOLICITUDES DE REGISTRO SANITARIO DE PRODUCTOS FARMACÉUTICOS
Núm. 2.232 exenta.- Santiago, 14 de septiembre de 2020.
Visto:
Lo dispuesto en el artículo 43 del decreto supremo N° 3, de 2010, del Ministerio de Salud, que aprueba el Reglamento del Sistema Nacional de Control de Productos Farmacéuticos de Uso Humano.
Considerando:
Primero: Que, el artículo 59 letra b) del decreto con fuerza de ley N° 1, de 2005, del Ministerio de Salud, que fija texto refundido, coordinado y sistematizado del decreto ley N° 2.763, de 1979, y de las leyes N° 18.933 y N° 18.469, establece que corresponde a este Instituto ejercer las actividades relativas al control de calidad de medicamentos, lo que comprende, entre otras, la función de autorizar y registrar esos productos, de acuerdo con las normas que determine el Ministerio de Salud.
Segundo: Que, en el mismo sentido, el artículo 96 del Código Sanitario dispone que el Instituto de Salud Pública de Chile es la autoridad encargada en todo el territorio nacional del control sanitario de los productos farmacéuticos, de los establecimientos del área y de fiscalizar el cumplimiento de las disposiciones que sobre esta materia se contienen en dicho Código y sus reglamentos, agregando el artículo 97, por su parte, que esta autoridad sanitaria llevará un registro de todos los productos farmacéuticos evaluados favorablemente en cuanto a su eficacia, seguridad y calidad que deben demostrar y garantizar durante el período previsto para su uso.
Tercero: Que, en ese orden de ideas, con fecha 21 de agosto de 2020 se publicó en el Diario Oficial el decreto supremo N° 54, de 2019, del Ministerio de Salud, que introduce modificaciones al Reglamento del Sistema Nacional de Control de Productos Farmacéuticos de Uso Humano aprobado mediante decreto supremo N° 3, de 2010, de la misma Secretaría de Estado.
Cuarto: Que, de este modo, el nuevo inciso segundo del artículo 43 del reglamento señala que la solicitud de registro sanitario de medicamentos "se hará constar en un expediente, escrito o electrónico, que deberá ordenarse de acuerdo al formato que apruebe el Director del Instituto mediante resolución. En el referido expediente se asentarán los documentos presentados por los interesados, con expresión de la hora y fecha de presentación, otorgándose un número de referencia para su ingreso y seguimiento, previo pago del arancel correspondiente a la primera fase de admisibilidad de la solicitud".
Quinto: Que, para concretar el cometido señalado en el considerando precedente, debe tenerse en cuenta que la responsabilidad de las autoridades reguladoras nacionales de medicamentos para aprobar de forma oportuna el acceso a nuevos fármacos de calidad, seguridad y eficacia comprobada, ha obligado a establecer estrategias de armonización y convergencia regulatoria con el fin de optimizar el proceso de evaluación. De este modo, el objetivo de este Instituto es establecer un marco regulatorio claro, que permita a los regulados utilizar un estándar internacional para la presentación de antecedentes de productos que son sometidos a la evaluación de registro sanitario por parte de esta institución, y
Teniendo presente lo dispuesto en la Ley Orgánica Constitucional de Bases Generales de la Administración del Estado; en la Ley N° 19.880; en los Título I del Libro Cuarto y en los Títulos II y III del Libro Décimo, todos del Código Sanitario; lo dispuesto en el decreto supremo 3, de 2010, del Ministerio de Salud; en los artículos 59 letra b), 60 y 61 letra b) del decreto con fuerza de ley N° 1, de 2005, del Ministerio de Salud, que fija el texto refundido, coordinado y sistematizado del decreto ley N° 2.763, de 1979, y de las leyes N° 18.933 y N° 18.469; en la resolución N° 7, de 2019, de la Contraloría General de la República, y las facultades que me confiere el decreto N° 51, de 2020, del Ministerio de Salud, dicto la siguiente
Resolución:
1.- Apruébase el formato de presentación de antecedentes para las solicitudes de registro sanitario de productos farmacéuticos, cuyo tenor es el siguiente:
Módulo 1.- Información administrativa:
En este módulo se incorporan los requerimientos administrativos y legales de acuerdo con la legislación chilena. Dentro de los aspectos que se contemplan en este apartado, se pueden encontrar detalles de la solicitud, documentos legales, empresas participantes durante todo el ciclo de vida, lo que a su vez puede contemplar: fabricante, licenciante, acondicionador, entre otros. Adicionalmente, se presentan los folletos de información al paciente y profesional, así como los detalles del rótulo del producto.
 .
. .
. Módulo 2.- Resumen General:
La información presentada es un resumen general de las características del fármaco. En general, este módulo permite tener una visión general del producto y facilita a los revisores de las distintas disciplinas interconectar la información de cada módulo de forma de generar una evaluación integral, debido a que se engloban los aspectos que son revisados en extenso en los módulos de calidad, no clínicos y clínicos. Debe proporcionar el resumen general de la información de calidad, así como los resúmenes no clínicos escritos y tabulados y el resumen clínico. La organización de estos resúmenes se encuentra descrita a continuación:
 .
. .
. .
. Módulo 3.- Calidad:
La información presentada en este apartado está relacionada con la sustancia activa (identificado con la letra "S") y el producto terminado (identificado con la letra "P"). Esta sección contiene información técnica de estudios de validación, reportes detallados de la caracterización del principio activo, proceso de manufactura y controles en proceso, estudios de estabilidad, especificaciones del producto terminado, entre otras. Finalmente, este módulo permite conocer el desarrollo del producto desde la elaboración de la sustancia activa hasta el producto terminado, que es liberado por el sitio de manufactura.
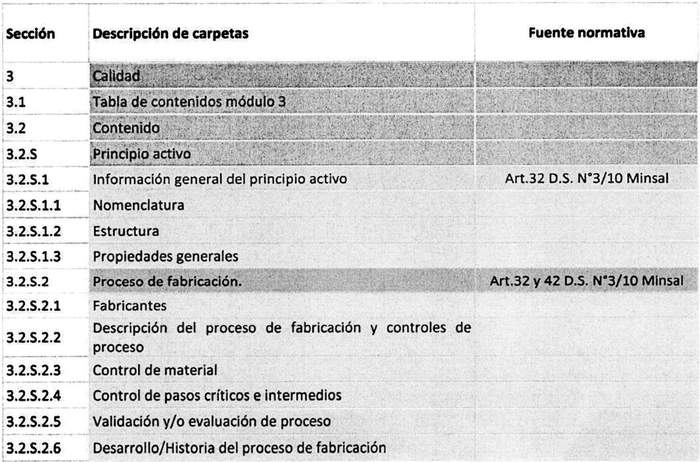 .
. .
. .
. Módulo 4.- Información no clínica:
La información presentada en este módulo corresponde a los estudios no clínicos o preclínicos para sustentar la seguridad del producto farmacéutico. Este apartado requiere la presentación de los estudios realizados con el fármaco, así como cualquier otra información que pueda ser de utilidad para validar la aprobación del registro sanitario.
 .
. .
. Módulo 5.- Información clínica:
Este módulo tiene como objetivo establecer la organización específica para la presentación de los reportes clínicos y su información relacionada para avalar la eficacia de los productos que son sometidos a registro sanitario. El módulo 5, además, presenta la información de estudios biofarmacéuticos que permiten la aprobación de productos sujetos a la demostración de bioequivalencia.
 .
. .
. 2.- Los antecedentes que se presenten en virtud del formato establecido en el numeral anterior, deberán ser aquellos que correspondan según los requisitos establecidos en la normativa nacional vigente y de acuerdo al tipo de procedimiento y de medicamento que se somete a evaluación de este Instituto.
3.- De conformidad con lo establecido en el artículo 54 B del decreto supremo N° 3, de 2010, del Ministerio de Salud, los antecedentes que se acompañen en el procedimiento acelerado de registro deberán ser los mismos antecedentes de respaldo entregados a la agencia reguladora extranjera que otorgó el registro, los que tendrán el carácter de obligatorios.
4.- La presente resolución entrará en vigencia una vez publicada en el Diario Oficial.
Anótese, comuníquese y publíquese su texto íntegro en el Diario Oficial.- Heriberto García Escorza, Director (S), Instituto de Salud Pública de Chile.