INSTRUYE ACTUALIZAR FOLLETOS DE INFORMACIÓN AL PROFESIONAL Y AL PACIENTE PARA LOS PRODUCTOS FARMACÉUTICOS QUE CONTIENEN MONTELUKAST EN SU COMPOSICIÓN
Núm. RM 2.053 exenta.- Santiago, 11 de mayo de 2022.
Visto estos antecedentes:
1. La evaluación de causalidad del reporte de sospecha de reacción adversa Nº FV2201-83360, realizada por el Subdepartamento Farmacovigilancia de este Instituto, en el cual se notifica un cuadro neuropsiquiátrico que se asoció al uso de montelukast, indicado en rinitis alérgica, y que se manifestó con una secuencia temporal razonable en relación con la administración del medicamento, por lo que se evaluó con causalidad probable.
2. El artículo "Reacciones Neuropsiquiátricas Asociadas al Uso de Montelukast" publicado por este Instituto en el año 2016, en su Boletín de Farmacovigilancia, que da a conocer este problema de seguridad con el fin de que, en la práctica clínica se puedan reconocer estas posibles reacciones adversas neurosiquiátricas, las que pueden aparecer desde el primer día o primera semana de tratamiento, pero con resolución rápida, y, en gran parte de los pacientes, sólo con la discontinuación de montelukast.
3. La existencia de evidencia científica que no consideran a los inhibidores de los leucotrienos, como el montelukast en el tratamiento de primera línea, para la rinitis alérgica.
4. Los registros sanitarios vigentes que contienen el principio activo montelukast en su formulación, cuyos antecedentes técnicos se encuentran contenidos en la base de datos Gicona, del Instituto de Salud Pública de Chile.
5. El comunicado de la Food and Drug Administration (FDA) que exige un recuadro de advertencia que refuerza la información existente sobre cambios graves relacionados con el comportamiento y el estado de ánimo con el uso de montelukast, y su reserva para el tratamiento de cuadros de rinitis alérgicas para pacientes que no tienen una adecuada respuesta o no pueden tolerar otros medicamentos.
6. Las fichas técnicas de productos registrados y vigentes que contienen montelukast en su formulación, de diferentes agencias reguladoras de medicamentos a nivel internacional, tales como la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), Therapeutic Goods Administration (TGA) de Australia, Health Canada y FDA de los Estados Unidos, los que contienen información más detallada respecto de las reacciones adversas neuropsiquiátricas vinculadas a montelukast.
7. Los reportes de sospechas de reacciones adversas contenidos en la Base de datos del Centro Nacional de Farmacovigilancia, en donde se registran, desde el año 2016 hasta febrero de 2022, 48 reportes de sospechas de reacción adversa para montelukast, 35 de las cuales son de tipo neuropsiquiátricas.
Considerando que:
1. Montelukast corresponde a un antagonista activo y selectivo de los receptores de leucotrienos indicado en Chile para el tratamiento y profilaxis del asma bronquial crónica en pacientes adultos y pediátricos desde los 12 meses de edad, el alivio de los síntomas de la rinitis alérgica estacional en adultos y pacientes pediátricos desde los 2 años de edad, y la rinitis alérgica perenne en adultos y pacientes pediátricos desde los 6 meses de edad;
2. La rinitis alérgica es una enfermedad altamente prevalente para la cual existen tratamientos seguros y eficaces para el tratamiento de la misma y que están ampliamente disponibles;
3. Existe la posibilidad de aparición de reacciones adversas neuropsiquiátricas que se asocian al uso de montelukast y la no identificación del fármaco como una posible causa puede dar lugar a la realización de pruebas diagnósticas y tratamientos innecesarios o reexposición tras reacciones adversas que pueden ser graves;
4. Existen numerosas publicaciones de agencias regulatorias de alta vigilancia sanitaria, que refuerzan y actualizan la información de seguridad con respecto a la aparición de reacciones neurosiquiátricas;
5. A raíz de la revisión de los folletos nacionales de productos farmacéuticos que contienen montelukast, se pudo corroborar que algunos de ellos, tanto folletos de información al profesional como al paciente, carecen de esta información actualizada, mientras que en otros resulta insuficiente;
6. El Instituto de Salud Pública, en base a su evaluación, considera necesaria la actualización de los folletos de información al profesional y paciente, de los productos farmacéuticos que contienen montelukast; y
Teniendo presente:
Los artículos 96 y 97 de la ley Nº 20.724, que modifica el Código Sanitario en materia de regulación de farmacias y medicamentos; los artículos 63°, 64°, 71°, 218°, 219° y 220° del Reglamento del Sistema Nacional de Control de los Productos Farmacéuticos de uso Humano, aprobado por decreto supremo Nº 3, de 2010, del Ministerio de Salud; los artículos 59° letra b) y 61° letra b), del DFL Nº 1 de 2005; y lo dispuesto en la resolución exenta Nº 191, del 5 de febrero de 2021, del Instituto de Salud Pública, dicto la siguiente:
Resolución:
1.- Establécese que los titulares de registros sanitarios de los productos farmacéuticos que contienen el principio activo montelukast en su composición, deberán incluir en los folletos de información al profesional y al paciente, la información que, en cada caso, se indica a continuación:
FOLLETO DE INFORMACIÓN AL PROFESIONAL
Agregar en ítem Indicaciones: Montelukast está indicado para el alivio de los síntomas de rinitis alérgica (rinitis alérgica estacional en adultos y pacientes pediátricos de 2 años de edad y mayores, y rinitis alérgica perenne en adultos y pacientes pediátricos de 6 meses de edad y mayores): Reservar su uso para pacientes que tienen una respuesta inadecuada o intolerancia a otros tratamientos.
Precauciones y advertencias
Se han informado eventos neuropsiquiátricos graves, con el uso de montelukast. Los tipos de eventos informados fueron muy variables e incluyeron, entre otros: agitación, agresión, depresión, trastornos del sueño, pensamientos y comportamientos suicidas (incluido el suicidio). Los mecanismos subyacentes a los eventos neuropsiquiátricos asociados con el uso de montelukast, actualmente no se comprenden bien.
Debido al riesgo de eventos de neuropsiquiátricos, es posible que los beneficios de montelukast no superen los riesgos en algunos pacientes, particularmente cuando los síntomas de la enfermedad pueden ser leves y pueden tratarse adecuadamente con otras terapias. Reserve el uso de montelukast para pacientes con rinitis alérgica que tienen una respuesta inadecuada o intolerancia a otros tratamientos. En pacientes con asma o broncoconstricción inducida por el ejercicio, considere los beneficios y riesgos antes de prescribir montelukast.
Analice los beneficios y los riesgos de montelukast con los pacientes y cuidadores cuando prescriba montelukast. Aconseje a los pacientes y/o cuidadores que estén atentos a cambios en el comportamiento o nuevos síntomas neuropsiquiátricos cuando tomen montelukast. Si se observan cambios en el comportamiento, o si se presentan nuevos síntomas neuropsiquiátricos o pensamientos y/o comportamientos suicidas, aconseje a los pacientes que descontinúen montelukast y busquen atención médica de inmediato.
Reacciones adversas
Trastornos psiquiátricos que incluyen, entre otros: agitación, comportamiento agresivo u hostilidad, ansiedad, depresión, desorientación, alteración de la atención, alteraciones del sueño incluyendo pesadillas, disfemia (tartamudeo), alucinaciones, insomnio, irritabilidad, deterioro de la memoria, síntomas obsesivo-compulsivos, inquietud, sonambulismo, depresión, pensamiento y comportamiento suicida (incluido el suicidio), tic y temblor.
FOLLETO DE INFORMACIÓN AL PACIENTE
¿Por qué mi médico me ha recetado montelukast?
Su médico le ha recetado montelukast para tratar lo siguiente, en personas que ya tomaron otros medicamentos que no funcionaron lo suficientemente bien, o en personas que no pudieron tolerar otros medicamentos:
. Alergias al aire libre que ocurren en algunas épocas del año (rinitis alérgica estacional) en adultos y niños 2 años en adelante.
. Alergias en interiores que ocurren todo el año (rinitis alérgica perenne) en adultos y niños de 6 meses en adelante
¿Qué debo saber antes y durante el tratamiento con montelukast?
Se han producido problemas graves de salud mental en personas que toman montelukast o incluso después de la interrupción del tratamiento. Esto puede suceder en personas con o sin antecedentes de problemas de salud mental. Deje de tomar montelukast e informe a su médico inmediatamente si usted o su hijo tienen algún problema inusual en el comportamiento o el pensamiento, incluyendo cualquiera de estos síntomas:
. agitación, incluyendo comportamiento agresivo u hostilidad
. problemas de atención
. sueños malos o vívidos
. depresión
. desorientación (confusión)
. sentirse ansioso
. irritabilidad
. alucinaciones (ver u oír cosas que son no realmente allí)
. problemas de memoria
. síntomas obsesivo-compulsivos
. inquietud
. sonambulismo
. tartamudeo
. pensamientos y acciones suicidas (incluido el suicidio)
. temblor
. problemas para dormir
. movimientos musculares descontrolados.
¿Qué efectos indeseables puede tener montelukast?
Cambios inusuales en el comportamiento o el pensamiento, incluyendo cualquiera de estos síntomas:
. agitación, incluyendo comportamiento agresivo u hostilidad
. problemas de atención
. sueños malos o vívidos
. depresión
. desorientación (confusión)
. sentirse ansioso
. irritabilidad
. alucinaciones (ver u oír cosas que son no realmente allí)
. problemas de memoria
. síntomas obsesivo-compulsivos
. inquietud
. sonambulismo
. tartamudeo
. pensamientos y acciones suicidas (incluido el suicidio)
. temblor
. problemas para dormir
. movimientos musculares descontrolados.
2.- Determínase que los titulares de los registros sanitarios de los productos farmacéuticos que a continuación se indican, deberán, en caso que sus folletos no cumplan con lo instruido en el punto anterior, someter a la aprobación de este Instituto, los folletos de información al profesional y paciente, que incluyan los aspectos señalados, en un plazo que no exceda de 90 días, contados desde la fecha de publicación de esta resolución:
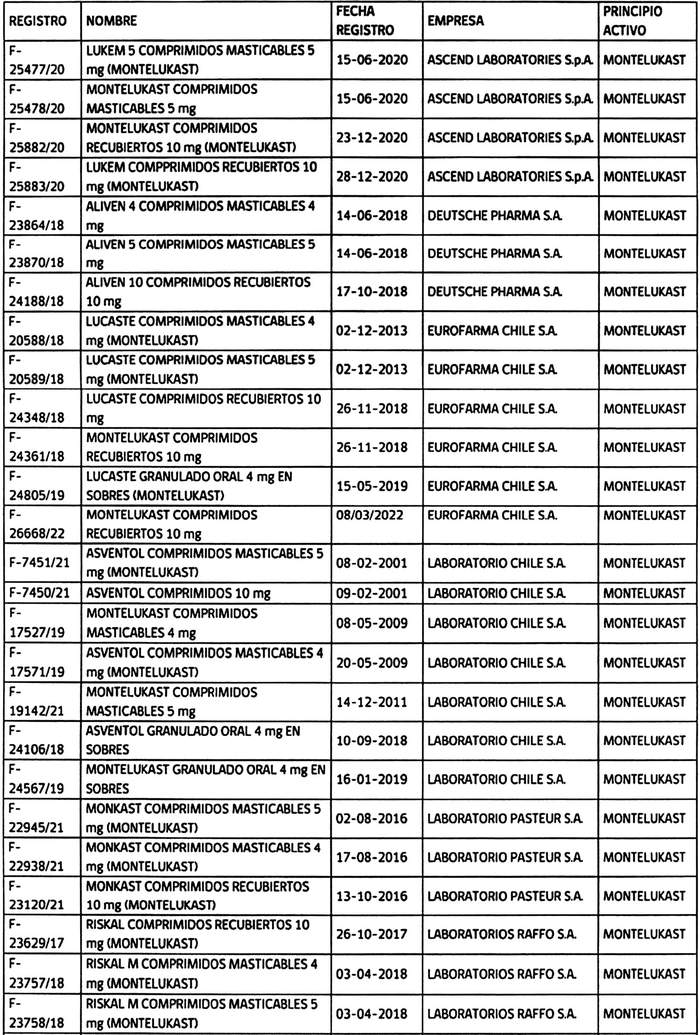

3.- Establécese que todo registro sanitario de producto farmacéutico que contenga el principio activo montelukast, que se conceda o sea solicitado con posterioridad a la publicación de la presente resolución en el Diario Oficial, deberá cumplir con las exigencias establecidas en ésta.
Anótese, comuníquese y publíquese en el Diario Oficial y la página web del Instituto de Salud Pública.- Alexis Aceituno Álvarez, Jefe Subdepartamento de Registro Sanitario de Productos Farmacéuticos Bioequivalentes, Agencia Nacional de Medicamentos.