MODIFICA RESOLUCIÓN Nº 1.881 EXENTA DE 2022 DEL ISP EN EL SENTIDO QUE INDICA
Núm. 3.975 exenta.- Santiago, 6 de septiembre de 2022.
Visto:
La resolución exenta Nº 1.881, de 29 de abril de 2022, que establece la obligatoriedad de implementar método de ensayo para la determinación del Complejo Burkholderia cepacia, microorganismos objetables, en materias primas y productos terminados que indica; en el decreto supremo Nº 3, de 2010, del Ministerio de Salud, Reglamento del Sistema Nacional de Control de Productos Farmacéuticos; en la ley Nº 19.880 que establece bases de los procedimientos administrativos que rigen los actos de los órganos de la Administración del Estado.
Considerando:
1º Que, la constatación de la presencia de Complejo Burkholderia cepacia (CBC) en sistemas de producción, almacenamiento y distribución de agua purificada de los laboratorios farmacéuticos de producción, evidenció un potencial riesgo en la presencia de dicho Complejo en algunos productos farmacéuticos, ante lo cual, mediante resolución exenta Nº 1.881, de 29 de abril de 2022, publicada en el Diario Oficial el 6 de junio de 2022, se estableció lo siguiente:
- (1º) La obligatoriedad para los laboratorios de control de calidad pertenecientes a los laboratorios de producción farmacéutica o laboratorios externos de control de calidad de implementar un método microbiológico de ensayo apropiado para la determinación del Complejo Burkholderia cepacia, microorganismo objetable, cuyo alcance corresponderá a materias primas como agua calidad farmacéutica (producción propia o suministro externo) y/o materias primas cuyo contenido de agua (actividad de agua -a w- ) esté por sobre 0,6 (aw > 0,6), así como para productos farmacéuticos terminados no estériles a base de agua, tales como preparaciones acuosas de uso oral, oromucosal, dérmicas, nasales y/o preparaciones para inhalación; con el fin de garantizar que los componentes de un producto farmacéutico y el lote del producto terminado antes de su distribución se encuentren libres de este contaminante.
Los establecimientos de producción farmacéutica que posean sistemas propios de generación, almacenamiento y distribución de agua purificada (laboratorios farmacéuticos de producción y/o recetarios magistrales) deberán incorporar este método como parte de los programas de monitoreo rutinario de dichos sistemas.
- (2º) La obligatoriedad de incorporar como parámetro microbiológico la ausencia del Complejo de Burkholderia cepacia en las especificaciones de producto terminado de medicamentos no estériles a base de agua, con registro sanitario vigente, tales como preparaciones acuosas de uso oral, oromucosal, dérmicas, nasales y/o preparaciones para inhalación.
Para tales efectos deberá presentar ante este Instituto los antecedentes correspondientes a la siguiente prestación Modificación de Especificaciones de Producto Farmacéutico o Pesticida (por producto), código de la prestación 4111020, pagando el arancel correspondiente.
El requerimiento, señalado en el primer párrafo, aplica también sobre preparados magistrales u oficinales, en conformidad al Art. 47º del DS 79/2010 del Ministerio de Salud.
- (3º) Implementar el método analítico para la detección del complejo Burkholderia cepacia el capítulo <60> Examen Microbiológico de Productos no Estériles: Pruebas para el Complejo Burkholderia cepacia de la Farmacopea de Estados Unidos de América (USP), u otro método de detección validado.
A causa de la existencia de métodos de control alternativos al recomendado; producto del advenimiento de nuevas tecnologías en el ámbito de la microbiología, se requerirá de la validación completa de ellos para su implementación.".
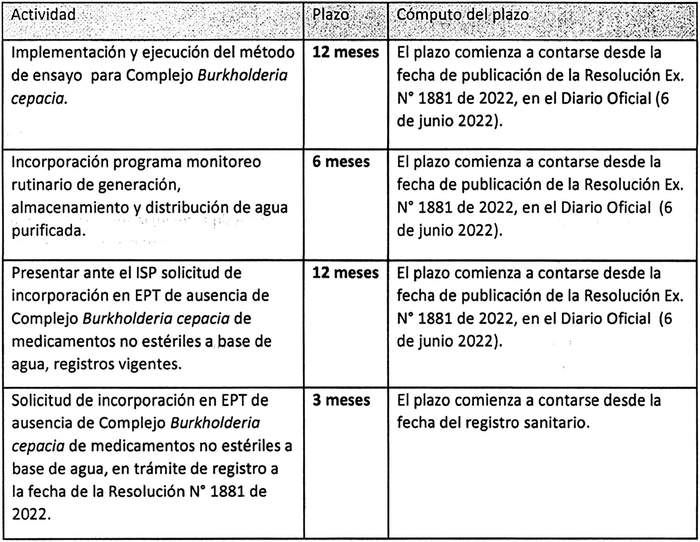
2º Que, para las disposiciones anteriores, en la misma resolución Nº 1.881/2022 (numeral 4) se dispusieron los siguientes plazos: i) 3 meses para la implementación de método de ensayo para Complejo Burkholderia cepacia; ii) 6 meses para la incorporación de programa de monitoreo rutinario de generación, almacenamiento y distribución de agua purificada; iii) 6 meses para la solicitud de incorporación en EPT de ausencia de Complejo Burkholderia cepacia en medicamentos no estériles a base de agua, registros vigentes; iv) 3 meses para Solicitud de incorporación en EPT de ausencia de Complejo Burkholderia cepacia en medicamentos no estériles a base de agua, de registros en trámite a la fecha de la resolución; v) 12 meses para efectuar estudios de aptitud de método microbiológico para el Complejo Burkholderia cepacia, según la resolución exenta Nº 262, de 2019 (disponibilidad de resultados en inspecciones de rutina).
3º Que, los plazos dispuestos para las exigencias señaladas serían contabilizados desde que esa resolución -exenta Nº 1.881, de 29 de abril de 2022- fuera publicada en el Diario Oficial, lo cual aconteció el 6 de junio de 2022.
4º Que, en presentación de la Asociación Industrial de Laboratorios Farmacéuticos A.G. (Asilfa), de 22 de junio de 2022, precedida por audiencia de lobby ante el Departamento Agencia Nacional de Medicamentos, se expone la solicitud de que el plazo para la implementación del método de ensayo (3 meses), sea extendido a 12 meses y que las modificaciones a las especificaciones de producto terminado no deban ser ingresadas como una modificación, lo cual genera una alta carga administrativa y económica para los titulares de registros.
5º Que, en presentación escrita de la Cámara de la Innovación Farmacéutica (CIF), de 1 de agosto de 2022, se solicita la ampliación del plazo para implementar el método de ensayo para Complejo Burkholderia cepacia a 12 meses, lo cual permitiría obtener las pruebas de aptitud para cada producto aplicable, o bien, se aclare la posible confusión en relación al plazo de 3 meses dispuesto para la implementación del método de ensayo.
6º Que, el Subdepartamento Laboratorio Nacional de Control de Anamed, durante el mes de julio del presente, ha tomado conocimiento de una disminución global de stock del insumo denominado "Enzimas Suplemento selectivo Burkholderia Cepacia Selective Supplement", para el cual el proveedor advierte un tiempo muy prolongado de importación. Lo anterior, podría ser un factor de demora en el cumplimiento de la resolución Nº 1.881, de 2022, emitida por esta autoridad sanitaria.
7º Que, en virtud de los argumentos presentados por las asociaciones y titulares señalados y lo pesquisado por las áreas técnicas correspondientes, en relación a la efectiva disminución de insumos que requiere el método exigido, resulta plausible y conveniente ampliar el plazo para la implementación de método de ensayo para el complejo Burkholderia cepacia.
8º Que, en coherencia con extender el plazo de 3 a 12 meses para la implementación del método CBC, se establecerá la aclaración de la expresión implementación del método de ensayo para Complejo Burkholderia cepacia, la cual significa tener a disposición todos los reactivos necesarios, medios de cultivos, cepas de referencia, realizar la capacitación del personal y contar con la aptitud de método microbiológico finalizada, se exceptúa de este último al agua de uso farmacéutico.
9º Que, para la debida coherencia, se extenderá también el plazo otorgado para la obligación de solicitar la incorporación en Especificaciones de Producto Terminado (EPT), la "ausencia de Complejo Burkholderia cepacia" de medicamentos no estériles a base de agua, en los registros vigentes.
10º Que, los plazos que se extienden mediante la presente se contabilizarán, desde la publicación en el Diario Oficial de la resolución Ex. Nº 1.881, de 2022.
11º Que, en otro orden de ideas, en presentación escrita de BPH S.A., del 8 de agosto de 2022, se solicita que las modificaciones a las especificaciones de producto, a fin de incorporar como parámetro microbiológico la ausencia del Complejo de Burkholderia cepacia, sea realizada mediante trámite gratuito, en atención a que la obligación de realizar dicha modificación nace por la dictación de un acto de Autoridad, invocando el principio de gratuidad de los procedimientos administrativos contemplado en el artículo 6 de la ley Nº 19.880; solicitud que será aceptada y dispuesta en este mismo acto.
Teniendo presente:
Lo dispuesto en las disposiciones contenidas en los artículos 94º, 96º y 97º del Código Sanitario; en el Reglamento del Sistema Nacional de Control de Productos Farmacéuticos, aprobado por decreto supremo Nº 3, de 2010, del Ministerio de Salud; en los artículos 59º letra b) y 61º del DFL Nº 1, de 2005; en la ley Nº 19.880 que establece bases de los procedimientos administrativos que rigen los actos de los órganos de la Administración del Estado; en la resolución Nº 7, de 2019, de la Contraloría General de la República; y las facultades que me otorga el decreto Nº 51, de 2020, del Ministerio de Salud, dicto la siguiente:
Resolución:
1.- Modifíquese la resolución Nº 1.881, de 2022, en orden a ampliar los plazos para la implementación, incorporación y ejecución del ensayo para Complejo Burkholderia cepacia, debiendo reemplazarse el punto 4 resolutivo, por el siguiente:
"4. Establécese los siguientes plazos para la implementación y fiscalización del punto 1, con las pertinentes distinciones:
2.- Déjese establecido que, se entenderá como implementación del método de ensayo para Complejo Burkholderia cepacia tener a disposición todos los reactivos necesarios, medios de cultivos, cepas de referencia, capacitación del personal y contar con aptitud de método microbiológico finalizada -se exceptúa de esto último al agua de uso farmacéutico- y todo aquello que permita ejecutar los ensayos dentro del plazo estipulado.
3.- Déjese establecido que, los preparados magistrales u oficinales no estériles en base a agua, como preparaciones acuosas de uso oral, oromucosal, dérmicas, nasales y preparaciones para inhalación, también están afectos a la exigencia de determinación de Complejo Burkholderia cepacia. En el caso de preparados magistrales, la determinación de Complejo Burkholderia cepacia es en las materias primas que forman parte del preparado, y, en el caso de los preparados oficinales, la determinación debe realizarse en el preparado final. Las bases galénicas que contengan agua en su composición también están sujetas a esa exigencia. Para todos estos efectos, se dispone del mismo plazo de 12 meses contados desde la publicación de la resolución Nº 1.881, de 2022.
4.- Téngase presente que las materias primas que deben implementar la determinación del Complejo Burkholderia cepacia, indicadas el numeral 1º de la resolución Nº 1.881/2022 son aquellas que forman parte de los productos farmacéuticos bajo esta misma exigencia.
5.- Elimínese el punto 2 resolutivo de la resolución exenta Nº 1.881, de 2022, en su reemplazo se dispone lo siguiente:
"2. Establécese la obligatoriedad de incorporar como parámetro microbiológico la ausencia del complejo de Burkholderia cepacia en las especificaciones de producto terminado de medicamentos no estériles a base de agua, tales como preparaciones acuosas de uso oral, oromucosal, dérmicas, nasales y/o preparaciones para inhalación.
Para tales efectos deberá presentar ante este Instituto los antecedentes correspondientes a la siguiente prestación Modificación de Especificaciones de Producto Farmacéutico o Pesticida (por producto), código de la prestación 4111020, cuya solicitud estará exenta de arancel.".
6.- Déjese establecido que las obligaciones estipuladas en la resolución Nº 1.881, de 2022, de este Instituto y las modificaciones que se le realizan por este acto, en ningún caso eximen al titular del registro sanitario a que, como responsable final de la seguridad y eficacia de su producto, realice una continua evaluación de la relación riesgo-beneficio del mismo, según lo establecido expresamente en el decreto Nº 3, de 2010, del Ministerio de Salud, Reglamento del sistema nacional de control de los productos farmacéuticos de uso humano.
7.- Manténgase la vigencia de todas las demás disposiciones de la resolución exenta Nº 1.881, de 2022, que no se han modificado mediante la presente resolución.
8.- Publíquese la presente resolución en el sitio web institucional www.ispch.cl, sin esperar su publicación en el Diario Oficial, para el oportuno conocimiento de los interesados.
Anótese, comuníquese y publíquese en el Diario Oficial.- Heriberto García Escorza, Director (S), Instituto de Salud Pública de Chile.