Artículo primero.- Modifícase el decreto exento Nº 500, de 1 de junio de 2012, del Ministerio de Salud, que aprobó la Norma Técnica Nº 136, denominada "Norma que determina los principios activos contenidos en los productos farmacéuticos que deben demostrar su equivalencia terapéutica y lista de productos farmacéuticos que sirven de referencia de los mismos", en la forma que se indica a continuación:
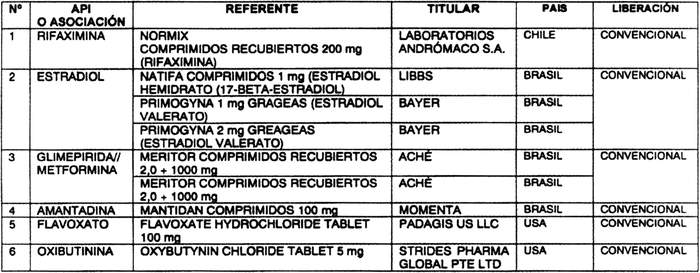
a) Agrégase a la "Lista de Productos de Referencia para los Estudios de Equivalencia Terapéutica", los siguientes productos de referencia:
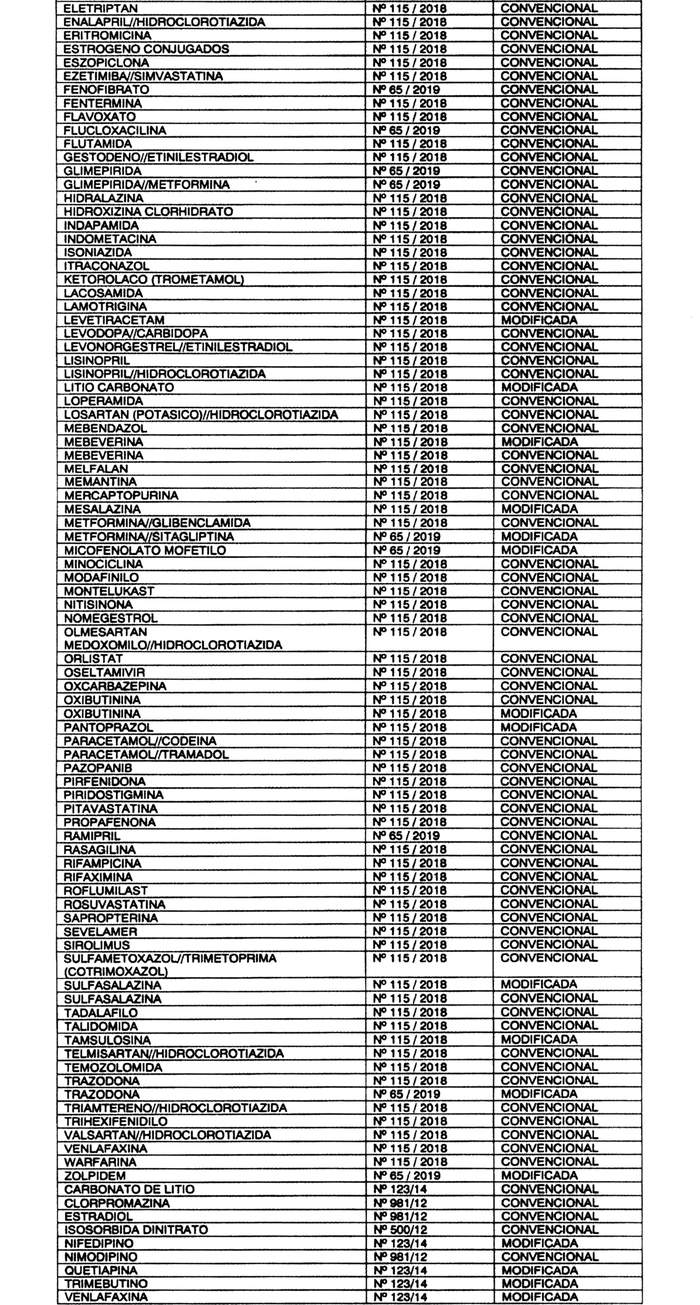
b) Otórgase plazo hasta el 31 de marzo de 2024, para cumplir con la exigencia de presentación de estudios de equivalencia terapéutica ante el Instituto de Salud Pública, para los productos farmacéuticos que contengan los "Principios Activos o Asociación" y bajo la "Forma de Liberación" que a continuación se indican:

c) Sustitúyase, el inciso segundo del artículo quinto, por el siguiente:
"Otórgase plazo hasta el 31 de marzo de 2024, para que a todo titular de registro sanitario de un producto farmacéutico que reúna alguna de las características descritas en el Punto 4.2. de la Norma Técnica Nº131, "Norma que define los criterios destinados a establecer la equivalencia terapéutica en productos farmacéuticos en Chile", aprobada mediante el decreto exento Nº 27, de fecha 18 de enero de 2012, del Ministerio de Salud, presente ante el Instituto de Salud Pública de Chile los antecedentes para demostrar su equivalencia terapéutica. El mismo plazo aplicará para productos farmacéuticos que deban cumplir con la señalada demostración y se presenten como formulaciones masticables, bucodispersables, dispersables, láminas bucodispersables o cualquier otra forma farmacéutica de administración oral, que difiera de aquella en la que se presenta el respectivo producto de referencia establecido para la realización de los estudios de equivalencia terapéutica".
d) Agrégase a continuación de la "Lista de Productos de Referencia para los Estudios de Equivalencia Terapéutica" una nueva lista denominada "Lista de Productos que sin perder su condición de Bioequivalente en Chile, podrán ser empleados como productos de referencia para los estudios de Equivalencia Terapéutica", cuyo detalle se indica a continuación:
LISTA DE PRODUCTOS QUE SIN PERDER SU CONDICIÓN DE BIOEQUIVALENTE EN CHILE, PODRÁN SER EMPLEADOS COMO PRODUCTOS DE REFERENCIA PARA LOS ESTUDIOS DE EQUIVALENCIA TERAPÉUTICA
