APRUEBA EXIGENCIAS DE MODIFICACIÓN DE RÓTULO Y FOLLETOS DE INFORMACIÓN AL PACIENTE Y AL PROFESIONAL PARA PRODUCTOS FARMACÉUTICOS CON EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR VEHÍCULOS Y OPERAR MAQUINARIAS
Núm. E6.267 exenta.- Santiago, 10 de septiembre de 2025.
Vistos:
Estos antecedentes; la providencia 2063, de fecha 5 de agosto de 2025, de la Fiscal del Instituto; la providencia 542, de fecha 30 de julio de 2025, del Jefe de Gabinete del Instituto; el memorándum 531, de fecha 30 de julio de 2025, del Jefe del Departamento Agencia Nacional de Medicamentos, y
Considerando:
Primero: Que, según datos de la Organización Mundial de la Salud, cada año aproximadamente 1,19 millones de personas fallecen como consecuencia de siniestros de tránsito y entre 20 y 50 millones de personas sufren traumatismos no mortales, muchos de los cuales provocarán una discapacidad. En tal sentido, si bien las causas son muy variadas, el impacto de los medicamentos en la conducción ha sido ampliamente documentado a nivel internacional.
Por su parte, en Chile cada año mueren en promedio 2.000 personas y cerca de 50.000 resultan lesionadas a causa de siniestros viales. Estas cifras resultan de especial consideración, ya que estos siniestros se encuentran entre las principales causas de muerte en el país y constituyen la primera causa de fallecimiento externo en niños, adolescentes y jóvenes.
Segundo: Que, la alta incidencia de enfermedades crónicas en la población chilena que requieren tratamientos farmacológicos resalta la importancia de etiquetar adecuadamente aquellos medicamentos que pueden afectar la capacidad para conducir. Ello, dado que el uso de fármacos es una variable que debe ser considerada dentro de los siniestros de tránsito, pues representa un riesgo desde que estos medicamentos pueden comprometer la seguridad de quien conduce y sus acompañantes.
Así, en un análisis de la siniestralidad vial del año 2023 en Chile (fuente Conaset) se puede observar que entre las principales causas se encuentra el uso de drogas y/o la fatiga en el conductor, representando el 5% de los fallecidos. Sin embargo, en Chile, no se cuenta con información específica que indique el impacto del uso de medicamentos, por lo que es razonable poder presumir un subregistro de esta variable.
Dicho ello, no puede desatenderse que los medicamentos pueden alterar las habilidades necesarias para conducir dependiendo del efecto que tengan sobre el sistema nervioso central, sean estimulantes, alucinógenos o depresores, y generan efectos como euforia, descoordinación, impaciencia, problemas de concentración y percepción, somnolencia o disminución del tiempo de reacción, entre otros.
A partir de lo anterior, se puede inferir que el consumo de ciertos medicamentos puede afectar significativamente la capacidad de conducción, abarcando dicha afectación tanto el control del vehículo como la toma de decisiones y la reacción ante imprevistos en el tránsito. Es por ello que el Ministerio de Transportes, a través de Conaset (Comisión Nacional de Seguridad de Tránsito de Chile), ha considerado necesario, en materia estrictamente sanitaria que es la que corresponde a este Instituto, incorporar esta información en los envases y folletos de medicamentos mediante una propuesta de trabajo conjunto con el Instituto de Salud Pública de Chile, accediendo este Servicio a la proposición y poder abordar esta brecha de datos, sin perjuicio que actualmente dicha información se encuentra disponible en los folletos médicos y los prospectos incluidos en los envases, se busca incorporarla a los envases para hacerla más visible y accesible, contribuyendo así a educar a la población sobre los riesgos asociados a la conducción bajo los efectos de medicamentos, a fin de contribuir a la disminución de la morbimortalidad relacionada con los siniestros viales. Esta iniciativa puede conjugarse en dicho objetivo con aquella relativa a los alcoholes y sus efectos cuyas advertencias se incorporan en su etiquetado abordando los efectos nocivos de su consumo, entre otros, para la conducción.
Tercero: Que, Chile no es el único país que ha buscado abordar esta materia, siempre tendiendo al resguardo de la salud pública y del adecuado conocimiento de los efectos que un determinado medicamento pueda provocar en las personas que lo consumen -sin perjuicio que, como se dijo, dicha información se encuentre contenida en cada registro sanitario, pues se estima de toda razonabilidad propenderse a la divulgación científica que se adecúe en mejor grado a la necesidad informativa que se busca concretar.
De esta manera, en una revisión de orden internacional, puede destacarse que, en 2012, se publicaron los resultados finales del proyecto DRUID (Driving Under the Influence of Drugs, Alcohol and Medicines), iniciativa de la Unión Europea destinada a estimar la magnitud del problema de la conducción bajo los efectos de sustancias psicoactivas y a examinar posibles contramedidas. El estudio concluyó que existe un aumento medio del riesgo de accidente cuando se conduce bajo los efectos de medicamentos psicoactivos, en tanto que, desde la perspectiva normativa, se determinó que no deben establecerse umbrales específicos para estos medicamentos. Además, se identificó que la contramedida más eficaz frente a la conducción bajo los efectos de sustancias es la información clara sobre los posibles efectos secundarios, por lo que se recomienda implantar un sistema de información exhaustivo dirigido a médicos, farmacéuticos y pacientes.
Así las cosas, menester es mencionar que el estudio del proyecto DRUID analizó la eficacia de los pictogramas en los envases de medicamentos para advertir sobre los riesgos al conducir, encontrando que la mayoría de los pacientes los consideraban claros y útiles, especialmente el modelo de clasificación DRUID, afirmando además que estos modificarían su comportamiento al volante si vieran estos símbolos. El proyecto también reveló que médicos y químicos-farmacéuticos carecen de formación suficiente sobre esta materia, por lo que se desarrolló una herramienta informática para mejorar su conocimiento y asesoramiento, con resultados positivos, especialmente entre los químicos farmacéuticos.
Por otro lado, la Declaración de Brasilia aprobada en noviembre de 2015 en la Segunda Conferencia Mundial de Alto Nivel sobre Seguridad Vial, encomienda a los estados miembros (incluyendo a Chile) que ya hayan adoptado medidas legislativas integrales para la utilización del cinturón de seguridad, las restricciones para niños o el uso de cascos, la conducción bajo los efectos del alcohol o la velocidad excesiva, a que presten atención a otros factores de riesgo como las condiciones médicas o medicamentos que puedan afectar la seguridad en la conducción.
Cuarto: Que, en la misma línea, en 2015 en el Reino Unido se estableció una normativa en la cual se establece como infracción conducir si se han consumido ciertas drogas (incluyendo medicamentos), de acuerdo con los niveles de concentración plasmática, entre las que se incluyen algunas comúnmente asociadas con el uso medicinal y dentro de las cuales pueden enunciarse la morfina, diazepam, clonazepam, flunitrazepam, lorazepam, oxazepam y temazepam.
A su turno, en Nueva Zelanda en el año 2022, se publicó una enmienda a la ley de transporte terrestre (conducción bajo los efectos de las drogas), en la que se establecen niveles de concentración sanguínea para las infracciones relacionadas con la conducción bajo los efectos de las drogas. Entre las sustancias señaladas se incluyen benzodiazepinas y otros hipnóticos, opioides y anfetaminas.
En el mismo sentido, en el caso de Brasil, la Asociación Brasileña de Medicina de Tránsito publicó en 2023 el documento "Principales drogas potencialmente nocivas para los conductores de vehículos de motor", con el objetivo de aportar evidencias científicas que puedan contribuir de forma significativa a la orientación de los médicos de tráfico, responsables de la evaluación médica de las personas que manifiestan interés por conducir vehículos a motor, así como de los profesionales responsables de la prescripción de medicamentos y de los conductores en general. En este documento se realiza un análisis de las siguientes familias farmacológicas involucradas: analgésicos, relajantes musculares, ansiolíticos, sedantes, hipnóticos, antidepresivos, antihistamínicos, hipoglicemiantes, anticonvulsivantes, antiparkinsionianos, anfetaminas, litio y cannabinoides.
Igualmente, en Estados Unidos existe una guía para la industria denominada "Evaluating Drug Effects on the Ability to Operate a Motor Vehicle" en la que se menciona que los estudios para evaluar un criterio de valoración de seguridad relevante, como el deterioro de la conducción, deben describirse en la sección estudios clínicos del etiquetado, y, además, en otras secciones del etiquetado según corresponda, incluyendo, entre otras, advertencias y precauciones, información de consejo al paciente y etiquetado aprobado por la FDA para el paciente (por ejemplo, prospecto, guía del medicamento).
Quinto: Que, a nivel de las distintas agencias de medicamentos, cabe señalar que se consultó en la materia a la Región Iberoamericana y el Caribe a través de la Red de Centros de Información de Medicamentos de Latinoamérica y Caribe (CIMLAC) a las cuales pertenece el Subdepartamento Farmacovigilancia del Instituto de Salud Pública, entre otras redes consultadas, obteniendo como respuesta que los siguientes países no disponen de un listado oficial de productos que puedan afectar la capacidad de conducción de vehículos y maquinarias: Argentina, Belice, Costa Rica, Cuba, Ecuador, Guatemala, México, Panamá, Paraguay, Uruguay y Venezuela.
En tanto, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) señaló poseer una lista oficial. La AEMPS desde el año 2007 cuenta con el Real Decreto 1345/2007, que establece la implementación de un símbolo o pictograma de advertencia en los envases de medicamentos que pudieran reducir la capacidad de conducir vehículos u operar maquinaria peligrosa del siguiente tenor: "Sobre fondo blanco, un triángulo equilátero rojo, con el vértice hacia arriba, y con un coche negro en el interior sobre fondo blanco. Su tamaño se adaptará al del envase; en todo caso, el lado del triángulo no será inferior a 10 mm".

A mayor abundamiento, en enero de 2008, la agencia referida, considerando que entre sus funciones está la de garantizar que los medicamentos se acompañen de la información necesaria para su uso correcto, puso en marcha un grupo de trabajo compuesto por técnicos y expertos de la propia agencia, del Observatorio Nacional de Seguridad Vial de la Dirección General de Tráfico, del Departamento de Farmacología y Terapéutica de la Facultad de Medicina de la Universidad de Valladolid, de los Consejos Generales de Colegios Oficiales de Médicos y Farmacéuticos, de Farmaindustria y de la Organización de Consumidores y Usuarios (OCU), a los que se añaden expertos en las áreas terapéuticas en estudio. Esto, para realizar una revisión detallada de los principios activos correspondientes a todos los grupos terapéuticos existentes, lo que abarca a más de 13.000 medicamentos autorizados (±2.500 principios activos). Dicha revisión comenzó por los grupos con mayores efectos en la conducción hasta completar todos los principios activos incluidos en la Clasificación Anatómica, Terapéutica y Química (ATC).
Como criterios principales de evaluación de la incorporación del pictograma de conducción se han considerado, por una parte, la existencia de estudios específicos sobre la capacidad de conducción en relación con ese principio activo y, por otra, la frecuencia de reacciones adversas asociadas a medicamentos que contienen ese principio activo que puedan afectar a la capacidad para conducir y utilizar máquinas (por ejemplo, alteraciones de la visión, somnolencia, mareos, vértigo, etc.) contenidas en la ficha técnica, así como la información disponible sobre el mecanismo de acción del principio activo. Así, se obtiene como normal general que cuando las reacciones adversas son muy frecuentes, es decir, frecuencia mayor del 10%, se considera necesaria la inclusión del pictograma, a la vez que, en los medicamentos con reacciones frecuentes, es decir, entre un 1% y un 10%, se tienen en cuenta otras consideraciones incluyendo la evaluación exhaustiva de la literatura científica y la discusión con expertos y, por lo general, no requiere la inclusión del pictograma.
Sin perjuicio de lo anterior, se evita el uso indiscriminado del pictograma para evitar que pierda su valor de llamar la atención sobre la información incluida en el prospecto, relativa a la capacidad para afectar a la conducción y operar maquinaria peligrosa. Asimismo, se tiene en cuenta que los posibles efectos de cada medicamento autorizado sobre la conducción y operación de maquinaria peligrosa son siempre objeto de evaluación y de información, en su caso, en el prospecto autorizado. De esta forma, la información sobre los principios activos cuya presencia en un medicamento conlleva la obligación de incorporar el pictograma de conducción se publica en la web de la AEMPS dentro del apartado de "medicamentos y conducción", conforme finaliza la revisión de cada subgrupo terapéutico.
Sexto: Que, atendido el panorama previamente expuesto, el Instituto de Salud Pública de Chile a través de su Departamento Agencia Nacional de Medicamentos, en conjunto con Conaset del Ministerio de Transportes y Telecomunicaciones, han determinado como necesario abordar la situación de aquellos medicamentos que afecten la capacidad de conducir vehículos y operar maquinarias, recogiendo la experiencia comparada y el fin de protección que con aquella se materializa. En tal sentido, se estima que existe una brecha que debe ser necesariamente atendida por las autoridades que tienen competencias tanto en medicamentos como en accidentes de tránsito, de tal manera de poder incorporar nuevas exigencias para productos farmacéuticos en relación a su etiquetado y folletos de información.
Séptimo: Que, para el logro de lo anterior debe tenerse en cuenta, en primer término, que acorde a lo dispuesto en el artículo 96 inciso primero del Código Sanitario "El Instituto de Salud Pública de Chile será la autoridad encargada en todo el territorio nacional del control sanitario de los productos farmacéuticos, de los establecimientos del área y de fiscalizar el cumplimiento de las disposiciones que sobre esta materia se contienen en este Código y sus reglamentos".
Dentro de las labores que la ley y sus reglamentos encomiendan, y mandan al Instituto a efectuar, se encuentran aquellas relativas al registro de los productos farmacéuticos en el país, sean estos de la naturaleza que corresponda a cada uno. En ese contexto le toca llevar, acorde al artículo 97 inciso primero del Código Sanitario, un registro de todos los productos farmacéuticos evaluados favorablemente en cuanto a su eficacia, seguridad y calidad que deben demostrar y garantizar durante el periodo previsto para su uso.
Así, puede obtenerse que el Instituto es el ente rector en materia de medicamentos, pudiendo controlar y supervigilar los mismos desde su desarrollo en el marco de investigaciones clínicas hasta la etapa de postcomercialización por medio de la fiscalización y farmacovigilancia. En aquella cadena de vida de los productos farmacéuticos puede el Instituto estudiar y analizar los valores de calidad, seguridad y eficacia de los mismos, con el fin de adoptar una serie de acciones a su respecto, las que pueden corresponder a recomendaciones, instrucciones, medidas sanitarias y/o sanciones según corresponda al mérito de cada caso en particular, abarcando por supuesto las actividades atingentes a medicamentos que se desarrollen en el marco de las atenciones de salud.
Desde luego, en este contexto, algunas de las materias en que el Instituto tiene plena competencia y facultades para pronunciarse e impartir instrucciones o requerir modificaciones se encuentran los rótulos de productos farmacéuticos y los folletos de información al paciente y al profesional que se encuentran aprobados en cada registro sanitario, así como también de aquellos que se sometan a dicho procedimiento.
El rótulo corresponde a un texto oficialmente autorizado que tiene por objetivo entregar información sanitaria clara y precisa a los usuarios, incluyendo las menciones que el reglamento exige como mínimas, así como "cualquiera otra indicación que se exija especial y adicionalmente en este reglamento o que el Instituto considere fundamentadamente necesaria al otorgar el registro o que se determine con posterioridad", según dispone el artículo 74 Nº 14 del decreto supremo 3, de 2010, del Ministerio de Salud.
Es decir, y como se adelantó, el legislador otorga herramientas al Instituto para obrar sobre los rotulados de los productos farmacéuticos, facultad que se extiende también a los folletos de información, tanto al paciente como al profesional, según se lee del artículo 199 en sus letras c) y d), del mismo decreto: "c) Folleto de información al profesional: Documento que contendrá a lo menos las características de la especialidad farmacéutica; aspectos farmacocinéticos, farmacodinámicos y toxicológicos del mismo; así como las indicaciones, dosificación, grupo etario al cual va dirigido, contraindicaciones, interacciones, precauciones y/o advertencias, reacciones adversas, dentro de las cuales es preciso señalar las que puedan presentarse durante el embarazo, lactancia o en poblaciones especiales; las medidas, a tomar en casos de sobredosis y otros aspectos, determinadas por la autoridad en base a la naturaleza e información científica disponible de un producto farmacéutico, con la finalidad de informar a los profesionales legalmente habilitados para prescribir o dispensar productos farmacéuticos. d) Folleto de información al paciente: Documento destinado a informar al paciente sobre una especialidad farmacéutica. Contendrá a lo menos la información referente a la indicación autorizada, advertencias, contraindicaciones, interacciones con otros productos, precauciones y toda otra información que la autoridad sanitaria determine en el registro, que permitan asegurar su correcto uso. El folleto de los productos farmacéuticos de venta directa deberá señalar además información acerca de la dosificación habitual para uso en particular y su modo de empleo aprobados en el registro".
Estas últimas disposiciones, con todo, deben siempre emplearse en forma conjugada con lo dispuesto en el artículo 205 del mismo reglamento, conforme al cual "Las modificaciones de los folletos de información al paciente y al profesional autorizados en el registro, podrán ser solicitadas por su titular, debiendo ser aprobadas o rechazadas mediante resolución fundada. Asimismo, el Instituto podrá, mediante resolución fundada, modificar los folletos autorizados previo aviso al titular, para que adopte las medidas que procedan" y, siempre, en consonancia con la facultad y atribución de orden general que detenta este Servicio según estatuye el artículo 64 de este reglamento: "El Instituto podrá exigir, mediante resolución fundada, que dentro de un plazo definido se realicen las modificaciones del registro que sean necesarias para garantizar la calidad, seguridad y eficacia en el uso de una o varias especialidades farmacéuticas, cuando mediante antecedentes científicos emanados de la Organización Mundial de la Salud, de organismos o entidades nacionales, internacionales o extranjeras o de su propia investigación, se forme la convicción que alguna de las condiciones de uso autorizadas presenta un riesgo en su seguridad y eficacia".
Octavo: Que, habiéndose alcanzado la convicción respecto a la necesidad de incorporar información en los productos farmacéuticos relativa a su capacidad para afectar la conducción de vehículos y la operación de maquinaria, se instruirá lo siguiente. En primer término, la modificación y ajuste de los rótulos y folletos de información al paciente y al profesional de los productos farmacéuticos ya registrados. Asimismo, incorporar la exigencia de dicha información para todos los fármacos que se sometan a registro a partir de la entrada en vigencia de esta resolución, en la forma que se dispondrá en la parte resolutiva de este acto administrativo.
Noveno: Que, las instrucciones previamente referidas fueron objeto de consulta pública, proceso que se extendió desde el 25 de agosto hasta el 3 de septiembre de 2025, recibiéndose un total de 19 observaciones. Todas estas fueron debidamente ponderadas por esta autoridad, incluyéndose en el texto definitivo aquellas que revestían mérito suficiente y de las cuales se dará cuenta en la parte resolutiva. Así las cosas, no queda sino sancionar administrativamente lo antes mencionado, de manera que
Teniendo presente:
Lo que ha prescrito el legislador en la ley Nº 18.575; en la ley Nº 19.880; lo señalado en los artículos 96 y siguientes del Código Sanitario; lo que ha consagrado al efecto el decreto supremo 3, de 2010, del Ministerio de Salud; el artículo 60 del DFL Nº 1, de 2005, del Ministerio de Salud; lo establecido en la resolución Nº 36, de 2024, de la Contraloría General de la República; y en uso de las facultades que al efecto me confiere el decreto 23, de 2024, del Ministerio de Salud, dicto la siguiente
Resolución:
1.- Instrúyese a los solicitantes de registros sanitarios de productos farmacéuticos, al momento de ingresar sus requerimientos, a cumplir con los siguientes lineamientos:
a) Revisar, evaluar, informar y declarar si el producto que somete al procedimiento de registro sanitario, cualquiera sea su clase, califica como un producto farmacéutico que puede afectar la capacidad de conducción.
Para ello, deberá usar como comparador el listado de referencia emitido por la Agencia Española de Medicamentos (AEMPS) disponibilizado gratuitamente en su sitio web: https://www.aemps.gob.es/ciudadania/medicamentos-y-conduccion/. Para desplegar el listado de referencia deberá seleccionar la opción "Listados de principios activos por grupos ATC y decisiones relativas a la incorporación del pictograma de la conducción".
Los listados incluyen los principios activos de medicamentos ordenados por grupos y subgrupos terapéuticos según la clasificación ATC.
b) Efectuado lo anterior, si el medicamento que se pretende registrar se encuentra comprendido dentro del listado de referencia, deberá incorporarse en el proyecto de rotulado de los envases secundarios el siguiente pictograma:

Los envases secundarios en alguna de sus caras, principales o laterales, deberán incorporar el pictograma de la conducción que consiste en un triángulo equilátero rojo con el vértice hacia arriba y un vehículo negro en el interior sobre fondo blanco, con la leyenda "Atención Conducción: Ver folleto". Respecto del color, a continuación, se entregan a modo de recomendación, alternativas que se pueden emplear:
* Vehículo negro, se sugiere usar color Pantone BLACK C.
* Triángulo rojo, se sugiere usar color Pantone 186 C, 485 C o 032C.
El tamaño del pictograma se adaptará al del envase y, en todo caso, el lado del triángulo no será inferior a diez milímetros, como se observa de la siguiente imagen como ejemplo:

c) Adicionalmente, si el producto que se pretende registrar es de aquellos comprendidos en el listado de referencia, deberá incluirse información respecto a la capacidad del medicamento de afectar la capacidad de conducción de vehículos y operación de maquinaria en los folletos de información al paciente y al profesional. A tales efectos, podrá tenerse en cuenta la propuesta de redacción del texto a incluir en los folletos que dispone la Agencia Española de Medicamentos, como se observa del siguiente ejemplo:
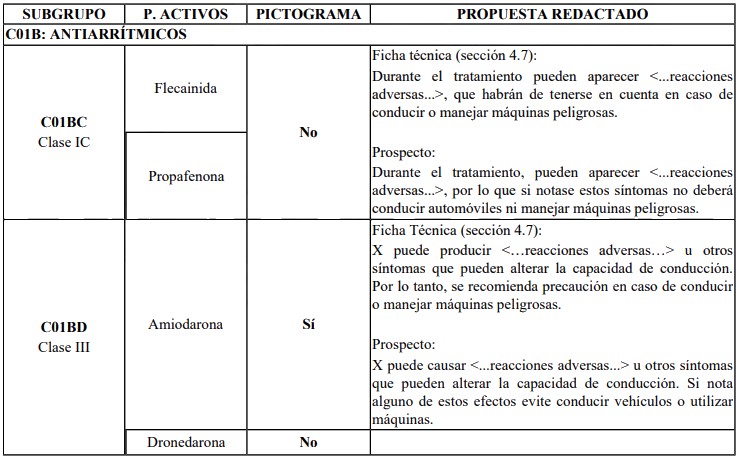
Si el solicitante opta por no seguir el texto sugerido, podrá este proponer un texto propio en los proyectos de folletos al paciente y profesional que contenga la información antes referida. Con todo, dicha mención deberá quedar claramente señalada en el ítem específico: "efectos en la capacidad de conducir vehículos y operar maquinaria".
2.- Instrúyese a los titulares de registros sanitarios de productos farmacéuticos a revisar y evaluar si los mismos califican como medicamentos que pueden afectar la capacidad de conducción de vehículos y operación de maquinaria. Para este fin, deberán utilizar el mecanismo comparador establecido en el numeral precedente.
Efectuado lo anterior, si los productos se encuentran en el listado de referencia, los titulares deberán proceder a incorporar el pictograma descrito en la letra b) del número anterior, así como la modificación de sus folletos de información al paciente y al profesional a efectos que estos consignen la información referida en la letra c) del número anterior (con la misma prevención respecto del texto a incluir).
3.- Hácese presente que quedan exceptuados de las instrucciones de los números anteriores aquellos productos en presentación de envases clínicos.
4.- Hácese presente que este acto administrativo tendrá vigencia desde la fecha de su publicación en el Diario Oficial para las nuevas solicitudes de registro sanitario.
Para los productos cuyas solicitudes de registro sanitario se encuentren en tramitación a la fecha de publicación del presente acto, el Instituto requerirá la información consignada en el numeral 1.- dentro del procedimiento respectivo. En este caso, el solicitante deberá realizar la verificación pertinente y proceder a la incorporación del pictograma e información complementaria en los folletos correspondientes.
Por su parte, para aquellos productos farmacéuticos que se encuentren registrados y comprendidos en el listado de referencia, los titulares tendrán un plazo de 36 meses para dar cumplimiento a la medida y agotar el stock de los productos que cuenten con el rotulado y folletos que se encuentren aprobados sin la información previamente referida.
Para los posteriores ajustes en el listado de referencia, por incorporación o eliminación de principios activos, se contará con un plazo de 12 meses para dar cumplimiento a lo instruido previamente.
5.- Establécese que la obligación de actualizar los rótulos y folletos de los productos deberá realizarse a través de la respectiva modificación de registro sanitario mediante presentación efectuada ante el Instituto a través de la prestación correspondiente.
6.- Téngase presente que para el caso de aquellos medicamentos registrados o que se pretendan registrar que no estén incluidos en el listado de referencia, por no estar registrados en España, pero cuyos principios activos puedan afectar la capacidad de conducción de vehículos u operación de maquinaria, o bien posean reacciones adversas que puedan afectarlas (como alteraciones de la visión, somnolencia, mareos, vértigo, etcétera) de manera muy frecuente, es decir, ≥ 10%, en la población, deberán igualmente cumplir con el requisito de incorporar el pictograma en el estuche del medicamento, así como también añadir información al efecto en los folletos de información al paciente y al profesional.
Para estos casos, la información de respaldo deberá ser presentada al Instituto, a través de la modificación de registro, quien evaluará lo acompañado y procederá según corresponda.
7.- Hácese presente que el cumplimiento de estas exigencias se verificará mediante programa de fiscalización.
8.- Publíquese el texto íntegro de este acto administrativo en el Diario Oficial y en el sitio web institucional www.ispch.cl.
Anótese, comuníquese y publíquese.- Fresia Catterina Ferreccio Readi, Directora Instituto de Salud Pública de Chile.