APRUEBA REGLAMENTO SANITARIO DE LOS ALIMENTOS
Núm. 977.- Santiago, 6 de agosto de 1996.- Visto: estos antecedentes; la necesidad de actualizar la normativa sobre productos alimenticios; lo establecido en los artículos 2º y 9º letra c) y en el Libro IV del Código Sanitario, aprobado por decreto con fuerza de ley Nº 725, de 1967 y en el artículo 4º letra b) y 6º del decreto ley Nº 2.763 de 1979 y teniendo presente las facultades que me confiere el artículo 32 Nº 8 de la Constitución Política del Estado
D e c r e t o:
Apruébase el siguiente Reglamento Sanitario de los Alimentos:
TITULO PRELIMINAR
Artículo 1.- Este Decreto 32, SALUD
Art. 1 N° 1
D.O. 28.11.2016 reglamento establece las condiciones sanitarias a que deberá ceñirse la producción, importación, elaboración, envase, almacenamiento, distribución y venta de alimentos para uso humano, así como las condiciones en que deberá efectuarse la publicidad de los mismos, con el objeto de proteger la salud y nutrición de la población y garantizar el suministro de productos sanos e inocuos.
Art. 1 N° 1
D.O. 28.11.2016 reglamento establece las condiciones sanitarias a que deberá ceñirse la producción, importación, elaboración, envase, almacenamiento, distribución y venta de alimentos para uso humano, así como las condiciones en que deberá efectuarse la publicidad de los mismos, con el objeto de proteger la salud y nutrición de la población y garantizar el suministro de productos sanos e inocuos.
Este reglamento se aplica igualmente a todas las personas, naturales o jurídicas, que se relacionen o intervengan en los procesos aludidos anteriormente, así como a los establecimientos, medios de transporte y distribución destinados a dichos fines.
Para la aplicación del presente reglamento regirán las definiciones y requisitos que su texto establece.
Artículo 2.- Alimento o producto alimenticio es cualquier substancia o mezclas de substancias destinadas al consumo humano, incluyendo las bebidas y todos los ingredientes y aditivos de dichas substancias.
Materia prima alimentaria es toda sustancia que para ser utilizada como alimento, precisa de algún tratamiento o transformación de naturaleza química, física o biológica.
Artículo 3.- Todos los alimentos y materias primas, deberán responder en su composición química, condiciones microbiológicas y caracteres organolépticos, a sus nomenclaturas y denominaciones legales y reglamentarias establecidas.
Los eventos biotecnológicos, que modifiquenDTO 115, SALUD
Art. primero Nº 1
D.O. 25.11.2003 determinados alimentos y/o materias primas alimentarias para consumo humano, y los alimentos, ingredientes y materias primas alimentarias nuevos, deberán figurar en la nómina dictada por el Ministerio de Salud para tales efectos, mediante la correspondiente norma técnica basada en la evidencia científica internacionalmente aceptada.
Art. primero Nº 1
D.O. 25.11.2003 determinados alimentos y/o materias primas alimentarias para consumo humano, y los alimentos, ingredientes y materias primas alimentarias nuevos, deberán figurar en la nómina dictada por el Ministerio de Salud para tales efectos, mediante la correspondiente norma técnica basada en la evidencia científica internacionalmente aceptada.
La autorización será otorgada mediante resolución por el Servicio de Salud competente.
NOTA:
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
Artículo 4.- Corresponderá a los Servicios de Salud el control sanitario de los alimentos y velar por el cumplimiento de las disposiciones relativas a esta materia del Código Sanitario y del presente reglamento, todo ello de acuerdo con las normas e instrucciones generales que imparta el Ministerio de Salud.
TITULO I
Principios Generales de Higiene de los Alimentos
Párrafo I
De los establecimientos de alimentos
Artículo 5.- Establecimientos de alimentos son los recintos en los cuales se producen, elaboran, preservan, envasan, almacenan, distribuyen, expenden y consumen alimentos y aditivos alimentarios.
Artículo 6.- La instalación, modificación estructuralDTO 475, SALUD
Art. Unico, N° 3
D.O. 13.01.2000 y funcionamiento de cualquier establecimiento de alimentos deberá contar con autorización del Servicio de Salud correspondiente.
Art. Unico, N° 3
D.O. 13.01.2000 y funcionamiento de cualquier establecimiento de alimentos deberá contar con autorización del Servicio de Salud correspondiente.
Artículo 7.- Al solicitar la autorización para la instalación de un establecimiento, el interesado deberá presentar, según corresponda:
a) autorización municipal de acuerdo a plano regulador;
b) plano o croquis de planta e instalaciones sanitarias a escala de la misma;
c) croquis de los sistemas de eliminación del calor, olor o vapor y sistema de frío;
d) descripción general de los procesos de elaboración;
e) materias primas que empleará;
f) rubros a los que se destinará;
g) sistemas de control de calidad sanitaria con que contará;
h) tipos de alimentos que elaborará;
i) sistema de eliminación de desechos.
Artículo 8.- LDecreto 40, SALUD
Art. 1° N° 1
D.O. 25.04.2024a autorización será válida por un plazo de tres años contado desde su otorgamiento y se entenderá automáticamente prorrogada por períodos iguales y sucesivos, a menos que el propietario o representante legal comunique su voluntad de no continuar sus actividades o que la autoridad sanitaria la deje sin efecto por motivos fundados, tales como: cuando el establecimiento de alimentos hubiere cesado sus actividades o esté siendo utilizado para un fin distinto de aquel para el que fue autorizado, de conformidad con el artículo 12 del presente reglamento.
Art. 1° N° 1
D.O. 25.04.2024a autorización será válida por un plazo de tres años contado desde su otorgamiento y se entenderá automáticamente prorrogada por períodos iguales y sucesivos, a menos que el propietario o representante legal comunique su voluntad de no continuar sus actividades o que la autoridad sanitaria la deje sin efecto por motivos fundados, tales como: cuando el establecimiento de alimentos hubiere cesado sus actividades o esté siendo utilizado para un fin distinto de aquel para el que fue autorizado, de conformidad con el artículo 12 del presente reglamento.
Artículo 9.- La autorización sólo podrá emitirse previa inspección del establecimiento y la solicitud de autorización deberá ser resuelta por el Servicio de Salud correspondiente dentro del plazo de treinta días hábiles contados desde que el requirente complete los antecedentes exigidos para ello. En dicho período deberán practicarse todas las visitas, inspecciones, análisis y otras actuaciones o diligencias necesarias para decidir sobre su aceptación o rechazo.
Artículo 10.- Para aquellos establecimientos que el Ministerio de Salud determine, la autorización podrá emitirse sin practicar una inspección previa.
Artículo 11.- Desde el inicio de su funcionamiento, el interesado deberá aplicar las prácticas generales de higiene en la manipulación incluyendo el cultivo, la recolección, la preparación, la elaboración, el envasado, el almacenamiento, el transporte, la distribución y la venta de alimentos, con objeto de garantizar un producto inocuo y sano.
Artículo 12.- Los establecimientos de alimentos no podrán utilizarse para un fin distinto de aquel para el que fueron autorizados.
Artículo 13.- La autoridad sanitaria deberá enrolar los establecimientos y para este efecto llevará un registro en el que se indicará el rubro o giro, su ubicación y el nombre del propietario.
Párrafo II
Definiciones
Artículo 14.- Para los fines de este reglamento se entenderá por:
a) adecuado: suficiente para alcanzar el fin que persigue este reglamento;
b) contaminación: la presencia de microorganismos, virus y/o parásitos, sustancias extrañas o deletéreas de origen mineral, orgánico o biológico, sustancias radioactivas y/o sustancias tóxicas en cantidades superiores a las permitidas por las normas vigentes, o que se presuman nocivas para la salud.
La presencia de cualquier tipo de suciedad, restos o excrementos.
Aditivos no autorizados por la reglamentación vigente o en cantidades superiores a las permitidas;
c) desinfección: la reducción del número de microorganismos a un nivel que no dé lugar a contaminación nociva del alimento, sin menoscabo de la calidad de él, mediante agentes químicos y/o métodos higiénicamente satisfactorios;
d) higiene de los alimentos: todas las medidas necesarias para garantizar la inocuidad y salubridad del alimento en todas las fases, desde su cultivo, producción, elaboración, envasado, transporte y almacenamiento hasta el consumo final;
e) limpieza: la eliminación de tierra, residuos de alimentos, polvo, grasa u otra materia objetable;
f) manipulación de alimentos: todas las operaciones del cultivo y recolección, producción, preparación, elaboración, envasado, almacenamiento, transporte, distribución y venta de los alimentos;
g) manipulador de alimentos: corresponde a toda persona que trabaje a cualquier título, aunque sea ocasionalmente, en lugares donde se produzca, manipule, elabore, almacene, distribuya o expenda alimentos;
h) material de envasado de alimentos: todos los recipientes, como latas, botellas, cajas de cartón u otros materiales, fundas y sacos, o material para envolver o cubrir, tal como papel laminado, película, papel, papel encerado, tela;
i) plagas: insectos, roedores, pájaros y otras especies menores capaces de contaminar directa o indirectamente los alimentos.
j) EsDecreto 40, SALUD
Art. 1° N° 2
D.O. 25.04.2024tructura de una instalación de alimentos: los elementos resistentes u orgánicos de una construcción, tales como: cimientos, muros soportantes, tabiques que separan salas o áreas, suelos, pilares, techumbres, torres y otros análogos que la componen.
Art. 1° N° 2
D.O. 25.04.2024tructura de una instalación de alimentos: los elementos resistentes u orgánicos de una construcción, tales como: cimientos, muros soportantes, tabiques que separan salas o áreas, suelos, pilares, techumbres, torres y otros análogos que la componen.
k) Modificación estructural: todo cambio en los elementos resistentes u orgánicos de una construcción, detallados en el literal anterior, que afecte el proceso de elaboración del producto o el producto terminado, en atención a lo dispuesto en los artículos 24 y 25 del presente reglamento. No se considerará modificación estructural las operaciones de mantención de la estructura de instalación de alimentos.
Párrafo III
De los requisitos de higiene en la zona de producción/recolección
Artículo 15.- No se permitirá cultivar, producir o recolectar alimentos en zonas contaminadas con agentes potencialmente nocivos o regadas con aguas sanitariamente inadecuadas, que puedan dar lugar a concentraciones inaceptables de agentes contaminantes en los alimentos.
Artículo 16.- Los alimentos se deberán proteger contra la contaminación por desechos de origen humano, animal, doméstico, industrial y agrícola cuya presencia pueda alcanzar niveles susceptibles de constituir riesgo para la salud.
Artículo 17.- Se deberán tomar precauciones adecuadas para que los desechos no se utilicen ni evacuen de manera que puedan constituir, a través de los alimentos, un riesgo para la salud.
Artículo 18.- El equipo y los recipientes que se utilicen en la recolección y la producción de alimentos deberán construirse y conservarse de manera que no constituyan un riesgo para la salud. Los envases que se reutilicen deberán ser de material y construcción tales que permitan una limpieza fácil y completa. Deberán limpiarse y mantenerse limpios y, en caso necesario, desinfectarse. Los recipientes usados para materias tóxicas deberán ser identificados y no podrán utilizarse para alimentos.
Artículo 19.- Los alimentos que no son aptos para el consumo humano deberán separarse durante la recolección y producción y eliminarse de tal forma que no puedan dar lugar a la contaminación de la producción, del agua o de otras materias alimentarias.
Artículo 20.- Los productos alimenticios y/o materias primas recolectados, se deberán almacenar en condiciones que confieran protección contra la contaminación y reduzcan al mínimo los daños y deterioros.
Artículo 21.- Los medios de transporte de los productos alimenticios recolectados deberán ser de materiales y construcción tales que permitan una limpieza fácil y completa. Deberán limpiarse y mantenerse limpios y en caso necesario, ser desinfectados o desinsectados con productos que no dejen residuos tóxicos.
Párrafo IV
Del proyecto y construcción de los establecimientos
Artículo 22.- Los establecimientos deberán estar situados en zonas alejadas de focos de insalubridad, olores objetables, humo, polvo y otros contaminantes y no expuestos a inundaciones.
Artículo 23.- Las vías de acceso y zonas de circulación que se encuentren dentro del recinto del establecimiento o en sus inmediaciones, deberán tener una superficie dura, pavimentada o tratada de manera tal que controlen la presencia de polvo ambiental.
Artículo 24.- Los Decreto 60,
SALUD
Art. 1, N° 1
D.O. 07.07.2018edificios e instalaciones deberán proyectarse de tal manera que las operaciones puedan realizarse en las debidas condiciones higiénicas y se garantice la fluidez del proceso de elaboración desde la llegada de la materia prima a los locales hasta la obtención del producto terminado, asegurando además condiciones de temperatura apropiadas para el proceso de elaboración y para el producto.
SALUD
Art. 1, N° 1
D.O. 07.07.2018edificios e instalaciones deberán proyectarse de tal manera que las operaciones puedan realizarse en las debidas condiciones higiénicas y se garantice la fluidez del proceso de elaboración desde la llegada de la materia prima a los locales hasta la obtención del producto terminado, asegurando además condiciones de temperatura apropiadas para el proceso de elaboración y para el producto.
Los establecimientos de alimentos en que se mantengan o almacenen materias primas alimentarias, alimentos en proceso, alimentos terminados y envases de alimentos deberán diseñarse de tal forma que éstos estén protegidos de la contaminación y/o alteración.
Los establecimientos destinados a la elaboración de alimentos, según las características del proceso, deberán contar con las siguientes áreas:
a) Recepción, selección, limpieza y preparación de las materias primas.
b) Producción.
c) Almacenamiento de materias primas, envases, etiquetas, alimentos en proceso y del producto terminado.
Artículo 25.- En las zonas de preparación de alimentos:
a) los pisos, se construirán de materiales impermeables, no absorbentes, lavables, antideslizantes y atóxicos; no tendrán grietas y serán fáciles de limpiar. Según el caso, se les dará una pendiente suficiente para que los líquidos escurran hacia las bocas de los desagües;
b) las paredes, se construirán de materiales impermeables, no absorbentes, lavables y atóxicos y serán de color claro. Hasta una altura apropiada para las operaciones, como mínimo 1.80 m, deberán ser lisas y sin grietas, fáciles de limpiar y desinfectar;
c) los cielos rasos deberán proyectarse, construirse y acabarse de manera que se impida la acumulación de suciedad y se reduzca al mínimo la condensación de vapor de agua y la formación de mohos y deberán ser
fáciles de limpiar;
d) las ventanas y otras aberturas deberán construirse de manera que se evite la acumulación de suciedad, y las que se abran deberán estar provistas de protecciones contra vectores. Las protecciones deberán ser removibles para facilitar su limpieza y buena conservación. Los alféizares de las ventanas deberán estar construidos con pendiente para evitar que se usen como estantes;
e) las puertas deberán ser de superficie lisa y no absorbente y, cuando así proceda, deberán tener cierre automático;
f) las escaleras, montacargas y estructuras auxiliares, como plataformas, escaleras de mano y rampas, deberán estar situadas y construidas de manera que no sean causa de contaminación de los alimentos. Las rampas deberán construirse con rejillas de inspección y deberán ser fácilmente desmontables para su limpieza y buena conservación;
g) todas las estructuras y accesorios elevados deberán instalarse de manera que se evite la contaminación directa o indirecta de alimentos y de la materia prima por condensación de vapor de agua y goteo y no se entorpezcan las operaciones de limpieza;
h) Los materiales de revestimiento aplicados a lasDTO 68, SALUD
Art. primero Nº 1
D.O. 23.01.2006 superficies de trabajo y a los equipos que puedan entrar en contacto directo con los alimentos, no deberán ceder sustancias tóxicas o contaminantes a los alimentos, modificando los caracteres organolépticos y de inocuidad.
Art. primero Nº 1
D.O. 23.01.2006 superficies de trabajo y a los equipos que puedan entrar en contacto directo con los alimentos, no deberán ceder sustancias tóxicas o contaminantes a los alimentos, modificando los caracteres organolépticos y de inocuidad.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 26.- La zona de preparación de alimentos deberá estar separada de los recintos destinados a alojamientos, servicios higiénicos, vestuarios y acopio de desechos.
Artículo 27.- Deberá disponerse de abundante abastecimiento de agua potable que se ajustará a lo dispuesto en la reglamentación vigente, a presión y temperatura conveniente, así como de instalaciones apropiadas para su almacenamiento, distribución y con protección contra la contaminación.
Artículo 28.- El hielo, utilizado en contacto directo con el alimento, deberá fabricarse con agua que se ajuste a lo dispuesto en el presente reglamento, y habrá de tratarse, manipularse, almacenarse y utilizarse de modo que esté protegido contra la contaminación.
Artículo 29.- El vapor de agua utilizado en contacto directo con alimentos no deberá contener ninguna sustancia que pueda contaminar el alimento.
Artículo 30.- El agua no potable que se utilice para la producción de vapor, refrigeración, lucha contra incendios y otros propósitos similares no relacionados con los alimentos, deberá trasportarse por tuberías completamente separadas, identificadas por colores, sin que haya ninguna conexión transversal ni sifonado de retroceso con las tuberías que conducen el agua potable.
Artículo 31.- Los establecimientos deberán disponer de un sistema eficaz de evacuación de aguas residuales, el que deberá mantenerse en buen estado de funcionamiento. Todos los conductos de evacuación (incluidos los sistemas de alcantarillado) deberán ser diseñados para soportar cargas máximas y deberán construirse de manera que se evite la contaminación del abastecimiento de agua potable.
Artículo 32: Todos los establecimientos deDTO 475, SALUD
Art. Unico, N° 5
D.O. 13.01.2000 producción, elaboración y transformación de alimentos deberán disponer de vestuarios y servicios higiénicos convenientemente situados y en número conforme a lo dispuesto por el Reglamento Sobre Condiciones Sanitarias y Ambientales Básicas en los Lugares de Trabajo.
Art. Unico, N° 5
D.O. 13.01.2000 producción, elaboración y transformación de alimentos deberán disponer de vestuarios y servicios higiénicos convenientemente situados y en número conforme a lo dispuesto por el Reglamento Sobre Condiciones Sanitarias y Ambientales Básicas en los Lugares de Trabajo.
Los servicios higiénicos deberán estar bien iluminados y ventilados y no tendrán comunicación directa con la zona donde se manipulen los alimentos. Los lavamanos contarán con grifos para el agua fría y caliente, provistos de jabón para lavarse las manos y medios higiénicos para secárselas, tales como toallas de papel, aire caliente u otros. Deberá ponerse rótulos en los que se indique al personal la obligación de lavarse las manos después de usar los servicios.
Las ventanas y otras aberturas deberán estar provistas de mallas protectoras contra vectores.
Artículo 33.- En las zonas de elaboración deberá disponerse de lavamanos provistos de jabón y medios higiénicos para secarse las manos, tales como, toallas de un solo uso o aire caliente.
Artículo 34.- Todo el establecimiento deberá tener una iluminación natural o artificial adecuada, que no deberá alterar los colores, y que permita la apropiada manipulación y control de los alimentos. La iluminación no deberá ser menor a:
540 lux en todos los puntos de inspección, 220 lux en las salas de trabajo, 110 lux en otras zonas.
Las lámparas que estén suspendidas sobre el material alimentario en cualquiera de las fases de producción, deben ser de fácil limpieza y estar protegidas para evitar la contaminación de los alimentos en caso de rotura.
Artículo 35.- Deberá proveerse una ventilación adecuada para evitar el calor excesivo, la condensación de vapor de agua y acumulación de polvo y para eliminar el aire contaminado. La dirección de la corriente de aire no deberá desplazarse de una zona sucia a una zona limpia. Las aberturas de ventilación deberán estar provistas de rejillas u otras protecciones de material anticorrosivo y que puedan retirarse fácilmente para su limpieza.
Artículo 36.- Deberá disponerse de instalaciones separadas del lugar de elaboración para el almacenamiento de los desechos y materiales no comestibles, donde permanecerán hasta su eliminación.
INCISO SUPRIMIDODTO 68, SALUD
Art. primero Nº 2
D.O. 23.01.2006
Art. primero Nº 2
D.O. 23.01.2006
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 37.- Los establecimientos de alimentos en que se mantengan, almacenen o exhiban alimentos o materias primas, que precisen de frío para su conservación deberán contar con refrigeradores, vitrinas refrigeradas o cámaras frigoríficas según corresponda, además estos equipos deberán estar provistos de un termómetro o de un dispositivo para el registro de su temperatura.
Párrafo V
De los requisitos de higiene de los establecimientos
Artículo 38.- Los establecimientos, sus equipos, utensilios y demás instalaciones, incluidos los desagües, deberán mantenerse en buen estado, limpios y ordenados.
INCISO SUPRIMIDODTO 68, SALUD
Art. primero Nº 3
D.O. 23.01.2006
Art. primero Nº 3
D.O. 23.01.2006
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 39.-Los desechos deberán retirarse de las zonas de manipulación y otras zonas de trabajo, cuantas veces sea necesario y por lo menos una vez al día.
Artículo 40.- Se deberá impedir el acceso de las plagas a los desechos. Inmediatamente después de su evacuación, los receptáculos utilizados para el almacenamiento y todo el equipo que haya entrado en contacto con los desechos deberán limpiarse. La zona de almacenamiento de desechos deberá, asimismo, mantenerse limpia.
Artículo 41.- Todo Decreto 75, SALUD
Art. 1 N° 1
D.O. 12.11.2019establecimiento de producción, elaboración y transformación de alimentos deberá establecer un programa de limpieza y, de ser necesario, de desinfección, a fin de asegurar que todas las partes de la instalación presenten una adecuada limpieza, de la forma como señala la letra a) del artículo 14 de este reglamento. Dicho programa deberá especificar superficies, elementos del o los equipos y utensilios que han de limpiarse; responsabilidad de tareas particulares; métodos y frecuencia de la limpieza; medidas de vigilancia de la misma y, de ser necesario, de la desinfección, para asegurar su idoneidad y eficacia. La necesidad de desinfección de superficies, elementos del equipo y utensilios se deberá evaluar de acuerdo a las materias primas, condición de éstas, procesos, productos y peligros que estén asociados a los mismos o que, razonablemente, se presuma que puedan estarlo.
Art. 1 N° 1
D.O. 12.11.2019establecimiento de producción, elaboración y transformación de alimentos deberá establecer un programa de limpieza y, de ser necesario, de desinfección, a fin de asegurar que todas las partes de la instalación presenten una adecuada limpieza, de la forma como señala la letra a) del artículo 14 de este reglamento. Dicho programa deberá especificar superficies, elementos del o los equipos y utensilios que han de limpiarse; responsabilidad de tareas particulares; métodos y frecuencia de la limpieza; medidas de vigilancia de la misma y, de ser necesario, de la desinfección, para asegurar su idoneidad y eficacia. La necesidad de desinfección de superficies, elementos del equipo y utensilios se deberá evaluar de acuerdo a las materias primas, condición de éstas, procesos, productos y peligros que estén asociados a los mismos o que, razonablemente, se presuma que puedan estarlo.
Todo el personal de aseo deberá estar capacitado en técnicas de limpieza y desinfección, según corresponda a los procedimientos aplicados en la instalación. Se deberán mantener registros de las capacitaciones realizadas
Artículo 42.- Para impedir la contaminación de los alimentos, todo el equipo y utensilios deberán mantenerse debidamente protegidos en estantes, vitrinas, u otros, después de limpiarse y desinfectarse.
Artículo 43.- Deberán tomarse precauciones adecuadas para impedir que el alimento se contamine cuando las salas, el equipo y los utensilios se limpien o desinfecten con agua y detergentes o con desinfectantes o soluciones de éstos. Los desinfectantes deberán ser apropiados al fin perseguido, debiendo eliminarse cualquier residuo de modo que no haya posibilidad de contaminación de los alimentos.
Artículo 44.- Inmediatamente después de terminar el trabajo de la jornada o cuantas veces sea necesario, deberán limpiarse minuciosamente los pisos, incluidos los desagües, las estructuras auxiliares y las paredes de la zona de manipulación de alimentos.
Artículo 45.- Las salas de vestuario, servicios higiénicos, vías de acceso y los patios situados en las inmediaciones de los locales y que sean partes de éstos, deberán mantenerse limpios.
Artículo 46.- Se prohíbe la entrada a las salasDTO 68, SALUD
Art. primero Nº 4
D.O. 23.01.2006 y áreas de elaboración de los establecimientos de alimentos de toda especie animal, excepto en los mataderos, de aquellas destinadas al faenamiento.
Art. primero Nº 4
D.O. 23.01.2006 y áreas de elaboración de los establecimientos de alimentos de toda especie animal, excepto en los mataderos, de aquellas destinadas al faenamiento.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 47.- Deberá aplicarse un programaDTO 475, SALUD
Art. Unico, N° 7
D.O. 13.01.2000 preventivo eficaz y continuo de lucha contra las plagas. Los establecimientos y las zonas circundantes deberán inspeccionarse periódicamente para cerciorarse de que no exista infestación.
Art. Unico, N° 7
D.O. 13.01.2000 preventivo eficaz y continuo de lucha contra las plagas. Los establecimientos y las zonas circundantes deberán inspeccionarse periódicamente para cerciorarse de que no exista infestación.
Artículo 48.- En caso que alguna plaga invada los establecimientos deberán adoptarse medidas de erradicación. El tratamiento con agentes químicos, físicos o biológicos sólo deberá aplicarse de acuerdo a la reglamentación vigente, por empresas autorizadas para tales efectos por la autoridad sanitaria correspondiente.
Artículo 49.- Sólo deberá emplearse plaguicidas si no pueden aplicarse con eficacia otras medidas de prevención. Antes de aplicar plaguicidas se deberá tener cuidado de proteger todos los alimentos, equipos y utensilios contra la contaminación. Después de aplicar los plaguicidas y a fin de eliminar los residuos, estos equipos y utensilios se deberán limpiar minuciosamente antes de volverlos a usar.
Artículo 50.- Se prohíbe la mantención de plaguicidas u otras sustancias tóxicas que puedan representar un riesgo para la salud, en las zonas de producción, elaboración, transformación, envase y almacenamiento de alimentos.
Artículo 51.- En Decreto 60,
SALUD
Art. 1, N° 2
D.O. 07.07.2018las zonas de manipulación de alimentos se prohíbe almacenar sustancias que puedan contaminar los alimentos ni depositar o guardar en ellas ropa u otros objetos personales.
SALUD
Art. 1, N° 2
D.O. 07.07.2018las zonas de manipulación de alimentos se prohíbe almacenar sustancias que puedan contaminar los alimentos ni depositar o guardar en ellas ropa u otros objetos personales.
Párrafo VI
De los requisitos de higiene del personal
Artículo 52.- La Decreto 75, SALUD
Art. 1 N° 2
D.O. 12.11.2019dirección del establecimiento será responsable de que todas las personas que manipulen alimentos reciban una instrucción adecuada y continua en materia de manipulación higiénica de los mismos e higiene personal. Se deberán mantener registros de tales instrucciones, su calendarización, programas, listas de asistencia y evaluaciones, si corresponde.
Art. 1 N° 2
D.O. 12.11.2019dirección del establecimiento será responsable de que todas las personas que manipulen alimentos reciban una instrucción adecuada y continua en materia de manipulación higiénica de los mismos e higiene personal. Se deberán mantener registros de tales instrucciones, su calendarización, programas, listas de asistencia y evaluaciones, si corresponde.
Artículo 53.- La empresa tomará las medidas necesarias para evitar que el personal que padece o es portador de una enfermedad susceptible de transmitirse por los alimentos, o tenga heridas infectadas, infecciones cutáneas, llagas o diarrea, trabaje en las zonas de manipulación de alimentos en las que haya probabilidad que pueda contaminar directa o indirectamente a éstos con microorganismos patógenos. Toda persona que se encuentre en esas condiciones debe comunicar inmediatamente al supervisor su estado de salud.
Artículo 54.- INCISO ELIMINADODTO 79, SALUD
Nº 1
D.O. 24.06.2003
Nº 1
D.O. 24.06.2003
El personal que manipule alimentos no deberá atender pagos del público, sea recibiendo o entregando dinero, no deberá realizar tareas que puedan contaminar sus manos y ropas de trabajo.
Artículo 55.- El Decreto 31, SALUD
Art. 1 N° 1
D.O. 28.10.2017personal que manipula alimentos deberá lavarse siempre las manos cuando su nivel de limpieza pueda afectar la inocuidad de los alimentos, antes de iniciar el trabajo, inmediatamente después de haber hecho uso de los servicios higiénicos, después de manipular material contaminado y todas las veces que sea necesario.
Art. 1 N° 1
D.O. 28.10.2017personal que manipula alimentos deberá lavarse siempre las manos cuando su nivel de limpieza pueda afectar la inocuidad de los alimentos, antes de iniciar el trabajo, inmediatamente después de haber hecho uso de los servicios higiénicos, después de manipular material contaminado y todas las veces que sea necesario.
Artículo 56.- Los manipuladores deberán mantener una esmerada limpieza personal mientras estén en funciones debiendo llevar ropa protectora, tal como: cofia o gorro que cubra la totalidad del cabello, y delantal. Estos artículos deben ser lavables, a menos que sean desechables y mantenerse limpios. Este personal no debe usar objetos de adorno en las manos cuandoDTO 475, SALUD
Art. Unico, N° 8
D.O. 13.01.2000 manipule alimentos y deberá mantener las uñas de las manos cortas, limpias y sin barniz.
Art. Unico, N° 8
D.O. 13.01.2000 manipule alimentos y deberá mantener las uñas de las manos cortas, limpias y sin barniz.
Artículo 57.- En las zonas en que se manipulen alimentos deberá prohibirse todo acto que pueda contaminar los alimentos, como: comer, fumar, masticar chicle, o realizar otras prácticas antihigiénicas, tales como escupir.
Artículo 58.- Si para manipular los alimentos se emplean guantes, éstos se mantendrán en perfectas condiciones de limpieza e higiene. El uso de guantes no eximirá al operario de la obligación de lavarse las manos cuidadosamente.
Artículo 59.- Se deberá evitar la presencia de personas extrañas en las salas donde se manipulen alimentos. En la eventualidad que esto suceda se tomarán las precauciones para impedir que éstas contaminen los alimentos. Las precauciones deben incluir el uso de ropas protectoras.
Artículo 60.- La responsabilidad del cumplimiento por parte del personal de todos los requisitos señalados en este párrafo, deberá asignarse al personal supervisor competente, sin que ello implique exclusión de esta responsabilidad a los propietarios del establecimiento.
Párrafo VII
De los requisitos de higiene en la elaboración de los
alimentos
Artículo 61.- En la elaboración sólo deberán utilizarse materias primas e ingredientes en buen estado de conservación, debidamente identificados, exentos de microorganismos o sustancias tóxicas en cantidades superiores a las aceptadas en este reglamento u otras materias extrañas.
Artículo 62.- Las Decreto 60,
SALUD
Art. 1, N° 3
D.O. 07.07.2018materias primas, ingredientes, alimentos en proceso y envases almacenados en los locales del establecimiento deberán mantenerse en condiciones que eviten su deterioro y contaminación, considerando aspectos tales como: naturaleza del producto, infraestructura, características de los envases, tratamientos térmicos o de preservación a que serán sometidos.
SALUD
Art. 1, N° 3
D.O. 07.07.2018materias primas, ingredientes, alimentos en proceso y envases almacenados en los locales del establecimiento deberán mantenerse en condiciones que eviten su deterioro y contaminación, considerando aspectos tales como: naturaleza del producto, infraestructura, características de los envases, tratamientos térmicos o de preservación a que serán sometidos.
Artículo 63.- El flujo del personal, vehículos y de materias primas en las distintas etapas del proceso, debe ser ordenado y conocido por todos los que participen en la elaboración, para evitar contaminación cruzada.
Artículo 64.- Todo el equipo que haya entrado en contacto con materias primas o con material contaminado deberá limpiarse, desinfectarse y verificarse el grado de limpieza antes de entrar en contacto con productos terminados.
Artículo 65.- En la manipulación de los alimentos sólo deberá utilizarse agua de calidad potable.
Artículo 66.- DeberánDecreto 4,
SALUD
Art. 1 Nº 1
D.O. 09.01.2013 existir registros de producción, distribución y control de los alimentos y materias primas y conservarse, como mínimo, durante 90 días posteriores a la fecha de vencimiento o plazo de duración del producto. Los alimentos de duración indefinida deberán mantener el registro, al menos, durante tres años.
SALUD
Art. 1 Nº 1
D.O. 09.01.2013 existir registros de producción, distribución y control de los alimentos y materias primas y conservarse, como mínimo, durante 90 días posteriores a la fecha de vencimiento o plazo de duración del producto. Los alimentos de duración indefinida deberán mantener el registro, al menos, durante tres años.
En el registro deberá identificarse la procedencia del alimento y/o materia prima, como etapa anterior, y el destino del producto, como etapa posterior.
Artículo 67.- Los productos terminados deberán almacenarse y transportarse en condiciones adecuadas de temperatura y humedad que garantice su aptitud para el consumo humano.
Artículo 68.- El transporte de alimentosDTO 45, SALUD
Art. único Nº 1
D.O. 12.07.2006 perecibles que requieren frío para su conservación en estado fresco, enfriado y/o congelado, sólo podrá realizarse en vehículos o medios de transporte con carrocera cerrada, con equipos capaces de mantener la temperatura requerida según el tipo de producto y lo establecido en este reglamento, provistos de termómetros que permitan su lectura desde el exterior y deberán mantenerse en todo momento en perfectas condiciones de higiene y limpieza.
Art. único Nº 1
D.O. 12.07.2006 perecibles que requieren frío para su conservación en estado fresco, enfriado y/o congelado, sólo podrá realizarse en vehículos o medios de transporte con carrocera cerrada, con equipos capaces de mantener la temperatura requerida según el tipo de producto y lo establecido en este reglamento, provistos de termómetros que permitan su lectura desde el exterior y deberán mantenerse en todo momento en perfectas condiciones de higiene y limpieza.
Además, deberán contar con autorización sanitaria otorgada por la autoridad sanitaria en cuyo territoro de competencia registre el domicilio el propietario o su representante legal. Esta autorización será válida por un plazo de tres años contados desde la fecha de su otorgamiento.
NOTA:
El artículo transitorio del DTO 45, Salud, publicado el 12.07.2006, dispone que la sustitución de la presente norma, rige 12 meses después de su publicación.
El artículo transitorio del DTO 45, Salud, publicado el 12.07.2006, dispone que la sustitución de la presente norma, rige 12 meses después de su publicación.
Artículo 69.- Los establecimientos de prDTO 45, SALUD
Art. único Nº 2
D.O. 12.07.2006oducción, elaboración, preservación y envase de alimentos deberán cumplir con las Buenas Prácticas de Fabricación (BPF) mencionadas en este reglamento, en forma sistematizada y auditable.
Art. único Nº 2
D.O. 12.07.2006oducción, elaboración, preservación y envase de alimentos deberán cumplir con las Buenas Prácticas de Fabricación (BPF) mencionadas en este reglamento, en forma sistematizada y auditable.
Además, aquellos que la autoridad sanitaria determine dentro de su correspDecreto 126, SALUD
Art. 1
D.O. 20.11.2014ondiente área de competencia, según los criterios establecidos por resolución del Ministerio de Salud, deberán implementar las metodologías de Análisis de Peligros y Puntos Críticos de Control (HACCP), en toda su línea de producción, conforme lo establecido en la Norma Técnica que, para tales efectos, dicte ese mismo Ministerio.
Art. 1
D.O. 20.11.2014ondiente área de competencia, según los criterios establecidos por resolución del Ministerio de Salud, deberán implementar las metodologías de Análisis de Peligros y Puntos Críticos de Control (HACCP), en toda su línea de producción, conforme lo establecido en la Norma Técnica que, para tales efectos, dicte ese mismo Ministerio.
Artículo 70.- Los procedimientos de laboratorio utilizados en el control de calidad, deberán ajustarse a métodos normalizados y reconocidos por organismos oficiales nacionales e internacionales, con el fin de que los resultados puedan ser comparables y reproducibles.
Párrafo VIII
De los requisitos de higiene en el expendio
Artículo 71.- En los establecimientos donde se expendan alimentos que necesitan conservarse a baja temperatura, se deberá contar con sistemas de frío que aseguren las características propias del producto, los que deberán mantenerse de acuerdo a las recomendaciones técnicas de los fabricantes.
Asimismo, los establecimientos donde se expendanDTO 475, SALUD
Art. Unico, N° 10
D.O. 13.01.2000 alimentos a granel de alto riesgo de contaminación, tales como productos lácteos, productos cárnicos, productos congelados y encurtidos, entre otros, deberán contar con vitrinas que permitan conservar este tipo de alimentos, de acuerdo a sus características y a las recomendaciones del fabricante y su diseño será tal que impida el autoservicio por parte del público.
Art. Unico, N° 10
D.O. 13.01.2000 alimentos a granel de alto riesgo de contaminación, tales como productos lácteos, productos cárnicos, productos congelados y encurtidos, entre otros, deberán contar con vitrinas que permitan conservar este tipo de alimentos, de acuerdo a sus características y a las recomendaciones del fabricante y su diseño será tal que impida el autoservicio por parte del público.
El fraccionamiento y expendio de los alimentos señalados en el inciso anterior, deberá ser realizado por un manipulador de alimentos, especificamente destacado para tales efectos.
Los productos alimenticios de venta a granel expuestos en vitrina deberán exhibir la identificación del fabricante o productor.
En los establecimientos deberán mantenerse los antecedentes de origen y fechas de elaboración y vencimiento de los productos sujetos a este tipo de comercialización, de manera tal que, estén disponibles para la autoridad sanitaria cuando ésta lo requiera.
Decreto 60,
SALUD
Art. 1, N° 4
D.O. 07.07.2018El almacenamiento de alimentos en establecimientos destinados al expendio deberá realizarse de modo de mantener los productos protegidos de la contaminación y/o alteración conforme a las características de los alimentos que se expenden.
SALUD
Art. 1, N° 4
D.O. 07.07.2018El almacenamiento de alimentos en establecimientos destinados al expendio deberá realizarse de modo de mantener los productos protegidos de la contaminación y/o alteración conforme a las características de los alimentos que se expenden.
Artículo 72.- Tanto el local como los equipos, superficies de trabajo y utensilios deberán mantenerse en perfectas condiciones de limpieza. La vajilla, cubiertos y cristalería, después de lavados con agua corriente y jabón u otro detergente, deben ser tratados con agua caliente y/o vapor de agua por dos minutos y sumergidos por veinte segundos, por lo menos, en una solución que contenga sesenta partes por millón de cloro libre, con posterior enjuague con agua corriente. Donde no se desinfecten los vasos, copas y tazas, será obligatorio el empleo de utensilios de único uso y de material autorizado. No se permite el uso de vajilla, platos, vasos, copas y tazas que presenten trizaduras o bordes rotos.
Artículo 73.- Los locales donde se expenden alimentos para su consumo en el mismo establecimiento deberán contar además de lo dispuesto en el artículo 32 de este reglamento, con servicios higiénicos gratuitosDTO 214, SALUD
Art. primero I Nº1
D.O. 04.02.2006 para uso del público, separados para cada sexo, los que deberán mantenerse en todo momento en perfectas condiciones de higiene, limpieza y ventilación. Deberán estar dotados de papel higiénico en cantidad necesaria para el uso de los excusados, dispositivos de jabón líquido para el lavado de manos y de medios higiénicos para secárselas, tales como toallas de papel o aire caliente.
Art. primero I Nº1
D.O. 04.02.2006 para uso del público, separados para cada sexo, los que deberán mantenerse en todo momento en perfectas condiciones de higiene, limpieza y ventilación. Deberán estar dotados de papel higiénico en cantidad necesaria para el uso de los excusados, dispositivos de jabón líquido para el lavado de manos y de medios higiénicos para secárselas, tales como toallas de papel o aire caliente.
Se exceptúa de esta obligación a los locales "al paso", los cuales sólo expenderán comida lista para llevar y/o atenderán público en la barra.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Artículo 74.- Los puestos emplazados en feriasDTO 214, SALUD
Art. primero I Nº2
D.O. 04.02.2006 libres, como también los quioscos, casetas y carros que carezcan de conexiones a las redes de agua potable, alcantarillado y los vendedores ambulantes, sólo podrán expender:
Art. primero I Nº2
D.O. 04.02.2006 libres, como también los quioscos, casetas y carros que carezcan de conexiones a las redes de agua potable, alcantarillado y los vendedores ambulantes, sólo podrán expender:
a) alimentos y bebidas envasados que provengan de fábricas autorizadas, que no requieran de protección del frío o del calor. Las bebidas serán vendidas en su envase original o de máquinas expendedoras que utilicen bases de premezclas;
b) frutas enteras, verduras, semillas y otros alimentos similares. Estos alimentos deberán almacenarse en buenas condiciones sanitarias;
c) algodón de azúcar, infusiones de té o café, en vasos desechables desde depósitos térmicos sellados, que provengan de establecimientos autorizados, y helados envasados que provengan, asimismo, de establecimientos autorizados;
d) pescados, mariscos y productos del mar, y carnesDTO 37, SALUD
Art. 1º Nº 1
D.O. 05.05.2004 de especies de abasto, de aves y los subproductos comestibles de todas estas especies, siempre y cuando dichos establecimientos reúnan los siguientes requisitos:
Art. 1º Nº 1
D.O. 05.05.2004 de especies de abasto, de aves y los subproductos comestibles de todas estas especies, siempre y cuando dichos establecimientos reúnan los siguientes requisitos:
- disponer de un sistema de agua corriente con un estanque que deberá abastecerse con al menos 150 litros de agua potable, al inicio de cada jornada y cada vez que sea necesario;
- disponer de un estanque hermético de recepciónDTO 214, SALUD
Art. primero I Nº2
D.O. 04.02.2006 de las aguas utilizadas, cuya capacidad sea igual o mayor a la del estanque de agua limpia;
Art. primero I Nº2
D.O. 04.02.2006 de las aguas utilizadas, cuya capacidad sea igual o mayor a la del estanque de agua limpia;
- disponer de un sistema de frío, que permita mantener a temperatura de refrigeración (0° C -
5° C), los productos alimenticios antes señalados, durante toda la jornada de trabajo de la feria.
e) Hielo granDecreto 24, SALUD
Art. 1 Nº 1
D.O. 19.11.2013izado saborizado con jarabes naturales o artificiales, en la medida que se cumplan los siguientes requisitos:
Art. 1 Nº 1
D.O. 19.11.2013izado saborizado con jarabes naturales o artificiales, en la medida que se cumplan los siguientes requisitos:
- Ser elaborado en máquinas granizadoras especialmente diseñadas para tales efectos y que, por sus características de funcionamiento, el alimento no sea objeto de manipulación directa.
- Utilizar hielo y jarabes que provengan de establecimientos autorizados.
- Utilizar cucharas o bombillas y vasos desechables.
- Disponer de un sistema o material de almacenamiento, transporte y expendio que permita mantener una temperatura, para la conservación del hielo, de 0 ºC o menos durante la jornada de trabajo.
- Preservar los insumos en condiciones que impidan su contaminación
f) Quesos y Decreto 118, SALUD
Art. 1 N° 1
D.O. 07.10.2014cecinas provenientes de fábricas autorizadas, fraccionados y envasados en las mismas fábricas, siempre y cuando dichos puestos de venta dispongan de un sistema de frío que permita mantener a temperatura de refrigeración (máximo 5º C) los productos alimenticios antes señalados. En el caso de cecinas crudas maduradas, éstas podrán mantenerse sin refrigeración, pero en lugar seco y fresco (máximo 12º C). Queda prohibido el fraccionamiento de los alimentos anteriormente mencionados en tales puestos
Art. 1 N° 1
D.O. 07.10.2014cecinas provenientes de fábricas autorizadas, fraccionados y envasados en las mismas fábricas, siempre y cuando dichos puestos de venta dispongan de un sistema de frío que permita mantener a temperatura de refrigeración (máximo 5º C) los productos alimenticios antes señalados. En el caso de cecinas crudas maduradas, éstas podrán mantenerse sin refrigeración, pero en lugar seco y fresco (máximo 12º C). Queda prohibido el fraccionamiento de los alimentos anteriormente mencionados en tales puestos
g) Frutas y Decreto 11, SALUD
Art. 1 N° 1
D.O. 06.06.2016verduras frescas lavadas, trozadas o peladas y envasadas provenientes de establecimientos autorizados para dichos fines, siempre que dichos puestos de venta dispongan de un sistema de frío que permita mantener a temperatura de refrigeración (máximo 5° C) los productos alimenticios antes señalados. Los envases deberán cubrir totalmente los alimentos y constituir una barrera eficaz contra la contaminación.
Art. 1 N° 1
D.O. 06.06.2016verduras frescas lavadas, trozadas o peladas y envasadas provenientes de establecimientos autorizados para dichos fines, siempre que dichos puestos de venta dispongan de un sistema de frío que permita mantener a temperatura de refrigeración (máximo 5° C) los productos alimenticios antes señalados. Los envases deberán cubrir totalmente los alimentos y constituir una barrera eficaz contra la contaminación.
Las implementaciones exigidas precedentemente para la comercialización de los productos aliDTO 37, SALUD
Art. 1º Nº 1
D.O. 05.05.2004menticios señalados en la letra d) deberán mantenerse en perfectas condiciones, en forma permanente.
Art. 1º Nº 1
D.O. 05.05.2004menticios señalados en la letra d) deberán mantenerse en perfectas condiciones, en forma permanente.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que las modificaciones introducidas al presente artículo rigen a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que las modificaciones introducidas al presente artículo rigen a contar de 180 días desde su publicación.
Artículo 74 a.- Los quioscos, casetas y carrosDTO 214, SALUD
Art. primero I Nº3
D.O. 04.02.2006 podrán elaborar y expender fruta fresca confitada, frutos secos confitados, palomitas de maíz y algodón de azúcar, bajo las siguientes condiciones:
Art. primero I Nº3
D.O. 04.02.2006 podrán elaborar y expender fruta fresca confitada, frutos secos confitados, palomitas de maíz y algodón de azúcar, bajo las siguientes condiciones:
a) Instalación de material sólido, lavable, de tamaño suficiente y con toldo o techo para protegerse de las condiciones climáticas.
b) Disponer de un depósito o contenedor, lavable y con tapa, que asegure la protección de las materias primas.
c) Los cilindros de gas deberán estar instalados y ser utilizados cumpliendo con las medidas de seguridad que garanticen la salud del trabajador y la comunidad, conforme a las disposiciones de la autoridad competente.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Artículo 74 b.- Los Decreto 11, SALUD
Art. 1 N° 2
D.O. 06.06.2016 quioscos, casetas y carros podrán freír, hornear y expender: masas sin relleno, empanadas de queso y productos vegetales. Asimismo, podrán expender frutas y verduras frescas lavadas, trozadas o peladas y demás vegetales procesados y envasados provenientes de establecimientos autorizados para dichos fines. Además, de elaborar y expender infusiones de té, café y demás estimulantes y fruitivos, emparedados fríos y calientes a base de cecinas cocidas, cumpliendo los siguientes requisitos:
Art. 1 N° 2
D.O. 06.06.2016 quioscos, casetas y carros podrán freír, hornear y expender: masas sin relleno, empanadas de queso y productos vegetales. Asimismo, podrán expender frutas y verduras frescas lavadas, trozadas o peladas y demás vegetales procesados y envasados provenientes de establecimientos autorizados para dichos fines. Además, de elaborar y expender infusiones de té, café y demás estimulantes y fruitivos, emparedados fríos y calientes a base de cecinas cocidas, cumpliendo los siguientes requisitos:
a) Carro o soporte físico de la instalación de material sólido, lavable, de tamaño suficiente. y deberá contar con una estructura protegida que delimite el espacio de manipulación de alimentos.
b) Disponer de un sistema de agua potable corriente mediante un estanque con capacidad de provisión mínima de 100 litros, que permita su reabastecimiento cada vez que sea necesario, y que asegure el correcto lavado de manos y utensilios que se utilicen. Para el lavado de manos deberá contarse con lavamanos, jabón y toallas de papel desechables como único sistema de secado.
c) Disponer de un estanque hermético de recepción de las aguas utilizadas, cuya capacidad sea mayor a las del estanque de agua limpia.
d) Disponer de un sistema de frío que permita mantener la temperatura de refrigeración, de las masas, vegetales procesados y cecinas, entre 0° y 5° C y de un dispositivo para el control permanente de la temperatura.
e) Disponer de un depósito o contenedor para las materias primas que no requieran refrigeración que asegure mantenerlas protegidas y aisladas del medio ambiente
f) Los aceites o mantecas utilizados en frituras deberán cumplir lo establecido en el Título X, párrafo V del presente Reglamento.
g) Disponer de un depósito lavable con tapa para la acumulación de desperdicios, los que deberán ser retirados y eliminados cuantas veces sea necesario y por lo menos una vez al día.
h) Los cilindros de gas deberán estar instalados y ser utilizados cumpliendo con las medidas de seguridad que garanticen la salud del trabajador y la comunidad, conforme a las disposiciones de la autoridad competente.
i) Contar con acceso a servicios higiénicos a 75 metros de distancia como máximo.
j) Los carros, quioscos y casetas que no cuenten con estructura protegida deberán poseer un toldo y sólo podrán expender emparedados a base de cecinas cocidas, las cuales se deberán mantener debidamente refrigeradas y para su expendio sólo se podrán calentar a través de un sistema aislado del medio ambiente.
Todas las materias primas utilizadas deberán provenir de establecimientos autorizados. Los aderezos y salsas, además, deberán expenderse en envases unitarios sellados y rotulados para asegurar su inocuidad y evitar la contaminación cruzada. Sólo se permitirá la elaboración y expendio de aderezos a base de vegetales (tomate, palta) en aquellos quioscos o carros que cuenten estructura cerrada, estos aderezos deberán mantenerse en refrigeración y en recipientes cerrados y no podrán ser de acceso directo de los consumidores.
Los manipuladores de alimentos deberán dar cumplimiento a las medidas estipuladas en el Título I Párrafo VI. "De los requisitos de higiene del personal", del presente reglamento.
Para otorgar la autorización la autoridad sanitaria deberá disponer de los antecedentes que acrediten que el lugar en que se ubicará el quiosco, carro o caseta está determinado para tales efectos por la autoridad comunal correspondiente.
Artículo 75.- Se permite la venta de la bebida tradicional "Mote con Huesillos" provenientes deDTO 475, SALUD
Art. Unico, N° 12
D.O. 13.01.2000 establecimientos autorizados en carros móviles especialmente diseñados para tales efectos, los cuales tendrán una vitrina para el mote y dispondrán de un doble estanque para el jugo y además de cucharas y vasos desechables. Deberán contar con depósitos con tapa para la acumulación y posterior eliminación de desperdicios.
Art. Unico, N° 12
D.O. 13.01.2000 establecimientos autorizados en carros móviles especialmente diseñados para tales efectos, los cuales tendrán una vitrina para el mote y dispondrán de un doble estanque para el jugo y además de cucharas y vasos desechables. Deberán contar con depósitos con tapa para la acumulación y posterior eliminación de desperdicios.
Se permiteDecreto 118, SALUD
Art. 1 N° 2
D.O. 07.10.2014 la venta de jugos de frutas cítricas en carros móviles especialmente diseñados para tales efectos, los cuales tendrán, formando parte de su estructura, un estanque para el agua potable con capacidad mínima de 30 litros, un lavamanos, un receptáculo para el agua utilizada con una capacidad igual o superior a la del estanque de agua potable, una vitrina para la fruta, un depósito con tapa para la acumulación y posterior eliminación de los desperdicios, un sistema de extracción del jugo de frutas por prensado, un dispensador de vasos y bombillas desechables. Para el lavado de las superficies, se deberá disponer de un sistema de aplicación de agua y detergente por aspersión y de secado con toallas desechables. La materia prima deberá estar lavada y almacenada en buenas condiciones sanitarias. La elaboración del jugo deberá hacerse a pedido y en presencia del comprador. No se permite la adición de agua, hielo u otro ingrediente al producto final. Además, deberán cumplir con lo dispuesto en la letra i) del artículo 74b.
Art. 1 N° 2
D.O. 07.10.2014 la venta de jugos de frutas cítricas en carros móviles especialmente diseñados para tales efectos, los cuales tendrán, formando parte de su estructura, un estanque para el agua potable con capacidad mínima de 30 litros, un lavamanos, un receptáculo para el agua utilizada con una capacidad igual o superior a la del estanque de agua potable, una vitrina para la fruta, un depósito con tapa para la acumulación y posterior eliminación de los desperdicios, un sistema de extracción del jugo de frutas por prensado, un dispensador de vasos y bombillas desechables. Para el lavado de las superficies, se deberá disponer de un sistema de aplicación de agua y detergente por aspersión y de secado con toallas desechables. La materia prima deberá estar lavada y almacenada en buenas condiciones sanitarias. La elaboración del jugo deberá hacerse a pedido y en presencia del comprador. No se permite la adición de agua, hielo u otro ingrediente al producto final. Además, deberán cumplir con lo dispuesto en la letra i) del artículo 74b.
Párrafo IX
De los requisitos de higiene de los mataderos
Artículo 76.- Los mataderos de aves y otras especies distintas del ganado, deberán estar ubicados en un sector permitido por el respectivo plano regulador y estar emplazados en un terreno normalmente no inundable y alejado de cualquier foco de insalubridad ambiental.
Decreto 83, SALUD
Art. 1 N° 1
D.O. 25.06.2010 Artículo 77.- Los mataderos de ganado se rigen por lo establecido en el Reglamento sobre estructura y funcionamiento de mataderos, establecimientos frigoríficos, cámaras frigoríficas y plantas de desposte y fija equipamiento mínimo de tales establecimientos, aprobado por decreto supremo Nº 94, de 2008, de los Ministerios de Agricultura y de Salud.
Art. 1 N° 1
D.O. 25.06.2010 Artículo 77.- Los mataderos de ganado se rigen por lo establecido en el Reglamento sobre estructura y funcionamiento de mataderos, establecimientos frigoríficos, cámaras frigoríficas y plantas de desposte y fija equipamiento mínimo de tales establecimientos, aprobado por decreto supremo Nº 94, de 2008, de los Ministerios de Agricultura y de Salud.
Artículo 78.- Mataderos son aquellos establecimientos donde se sacrifican y faenan reses, aves y otras especies animales destinadas a la alimentación humana. Deberán estar habilitados de tal forma que aseguren el faenamiento y preservación higiénica de las carnes.
Artículo 79.- Los mataderos de aves y otras especies distintas del ganado, deberán contar al menos con las siguientes dependencias: área destinada al lavado y desinfección del transporte de especies vivas, área de descarga, área de sacrificio, área de escaldado y desplumado cuando corresponda, área de eviscerado, área de enfriado y empaque, área de producto trozado, cámaras frigoríficas, área de lavado y desinfección de transporte de especies faenadas y área de despacho.
Artículo 80.- Los mataderos, a que se refiere el artículo 76 cuando corresponda, deberán disponer de secciones para el procesamiento de subproductos, aisladas de la línea de faena.
Además deberán disponer de un área para el sistema de tratamiento o destrucción de decomisos la que deberá estar separada del área de faenamiento.
Artículo 81.- Se prohíbe el sacrificio y elDTO 475, SALUD
Art. Unico, N° 13
D.O. 13.01.2000 faenamiento de animales destinados a la alimentación humana en locales o recintos no autorizados por la autoridad sanitaria.
Art. Unico, N° 13
D.O. 13.01.2000 faenamiento de animales destinados a la alimentación humana en locales o recintos no autorizados por la autoridad sanitaria.
No se permitirá la presencia dentro de la sala de faenamiento de personas ajenas a las tareas propias del matadero, la mantención de otros animales que no estén destinados al sacrificio, ni la salida o retiro de animales vivos del recinto, Decreto 83, SALUD
Art. 1 N° 2
D.O. 25.06.2010salvo circunstancias excepcionales, debidamente calificadas por la autoridad sanitaria.
Art. 1 N° 2
D.O. 25.06.2010salvo circunstancias excepcionales, debidamente calificadas por la autoridad sanitaria.
Párrafo X
De los requisitos de la inspección de los animales y sus
carnes
Decreto 83, SALUD
Art. 1 N° 3
D.O. 25.06.2010 Artículo 82.- La encierra de las reses deberá efectuarse por un período de tiempo de antelación al sacrificio, con el fin de permitir el reposo y el examen ante-mortem.
Art. 1 N° 3
D.O. 25.06.2010 Artículo 82.- La encierra de las reses deberá efectuarse por un período de tiempo de antelación al sacrificio, con el fin de permitir el reposo y el examen ante-mortem.
Artículo 83.- Todas las especies de reses, aves y otras especies animales destinadas al sacrificio serán sometidas a inspección médico-veterinaria por la autoridad de salud o por terceros en quienes ésta delegue sus funciones.
La inspección médico-veterinaria comprenderá, la inspección de las especies vivas (examen ante-mortem), la inspección de la canal, cabeza y vísceras (inspección post-mortem) y la supervisión de la disposición final de los animales o partes declarados no aptos para el consumo humano.
La supervisión de la higiene de la carne, con inclusión de la inspección de la carne, estará bajo la responsabilidad de un médico veterinario inspector oficial.
Las técnicas de inspección y el dictamen final respecto de la aptitud para el consumo de las carnes y subproductos, se efectuarán de acuerdo a las normas que para tales efectos dicte el Ministerio de Salud.
Los mataderos deberán contar además, con los instrumentos necesarios para la detección de triquina y otros parásitos.
Artículo 84.- La sangría, faenamiento y movilización interna de aves y de otras especies distintas de ganado, se hará en suspensión y los ganchos que soportan directamente la canal deben ser de acero inoxidable. Estas carnes en suspensión no deberán contactar con el piso o las paredes de las dependencias.
Artículo 85.- Todos los animales enfermos que se detecten en el examen ante-mortem, serán enviados a un corral especialmente habilitado para ello, el que se encontrará aislado de los otros corrales. El destino final de estos animales se realizará de acuerdo a la normativa vigente.
Artículo 86.- Los órganos, partes o especiesDTO 475, SALUD
Art. Unico, N° 14
D.O. 13.01.2000 enteras no aptas para el consumo humano, de las especies de abasto deberán ser destruidos o sometidos a tratamientos aprobados por la autoridad sanitaria, con el fin exclusivo de destinarlos al uso industrial no alimentario humano. Estas operaciones deberán realizarse en el recinto especialmente habilitado para ello, bajo la vigilancia y responsabilidad directa del médico veterinario, inspector de carnes.
Art. Unico, N° 14
D.O. 13.01.2000 enteras no aptas para el consumo humano, de las especies de abasto deberán ser destruidos o sometidos a tratamientos aprobados por la autoridad sanitaria, con el fin exclusivo de destinarlos al uso industrial no alimentario humano. Estas operaciones deberán realizarse en el recinto especialmente habilitado para ello, bajo la vigilancia y responsabilidad directa del médico veterinario, inspector de carnes.
Excepcionalmente la autoridad sanitaria podráDTO 214, SALUD
Art. primero I Nº 4
D.O. 04.02.2006 autorizar el retiro de estos productos de los establecimientos donde se faenen animales, con el fin exclusivo de su utilización en prácticas docentes o de investigación científica, a cuyo efecto requerirá los antecedentes que den cuenta de su identidad, condiciones de bioseguridad, de transporte, conservación, manejo y destino final y eventual destrucción posterior.
Art. primero I Nº 4
D.O. 04.02.2006 autorizar el retiro de estos productos de los establecimientos donde se faenen animales, con el fin exclusivo de su utilización en prácticas docentes o de investigación científica, a cuyo efecto requerirá los antecedentes que den cuenta de su identidad, condiciones de bioseguridad, de transporte, conservación, manejo y destino final y eventual destrucción posterior.
Artículo 87.- Los establecimientos señalados enDTO 475, SALUD
Art. Unico, N° 15
D.O. 13.01.2000 el artículo 76 y los mataderos de reses deberán mantener un registro diario de la procedencia de los animales y de las canales, partes y órganos declarados no aptos para el consumo humano, indicando las causas de inaptitud.
Art. Unico, N° 15
D.O. 13.01.2000 el artículo 76 y los mataderos de reses deberán mantener un registro diario de la procedencia de los animales y de las canales, partes y órganos declarados no aptos para el consumo humano, indicando las causas de inaptitud.
Párrafo XI
De los requisitos de higiene de las salas de desosado de
aves y otras especies distintas del ganado
Artículo 88.- Establecimiento o sala de desosado es aquel recinto donde se desosan y/o trozan aves y otras especies distintas del ganado, destinadas a la alimentación humana.
Deberán contar con una sala para realizar el desosado, la preparación de cortes y preempaque y una sala para operaciones de empaque.
Artículo 89.- Las salas destinadas a las labores de desosado, trozado, empaque y pesaje deberán disponer de un dispositivo de enfriamiento que permita mantener unaDTO 68, SALUD
Art. primero Nº 5
D.O. 23.01.2006 temperatura no superior a 12ºC y un sistema de registro permanente de temperatura.
Art. primero Nº 5
D.O. 23.01.2006 temperatura no superior a 12ºC y un sistema de registro permanente de temperatura.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 90.- El traslado del producto obtenido en las salas de desosado debe realizarse exclusivamente en cajas o contenedores que garanticen la calidad higiénica del producto y que impidan su contaminación por agentes externos o del propio envase.
Artículo 91.- Empacadora de carne de ave u otras especies es el establecimiento destinado al envasado de carnes. Incluirá recepción, cámara frigorífica, cámara de trozado, sección de almacenamiento de cajas y sección para despuntes y huesos.
INCISO DEROGADODTO 115, SALUD
Art. primero Nº 2
D.O. 25.11.2003
Art. primero Nº 2
D.O. 25.11.2003
NOTA:
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
Párrafo XII
De los requisitos de higiene del transporte y expendioDTO 214, SALUD
Art. primero II
Nos. 1 y 2
D.O. 04.02.2006 de leches crudas
Art. primero II
Nos. 1 y 2
D.O. 04.02.2006 de leches crudas
Artículo 92.- El transporte de leches crudas deberá realizarse en envases destinados exclusivamente a este fin. Deberán ser de material inerte que permita su fácil lavado y desinfección antes y después de su uso. Sus tapas estarán ajustadas, sin accesorios destinados a corregir deficiencias del ajuste.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que las modificaciones introducidas al presente artículo rigen a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que las modificaciones introducidas al presente artículo rigen a contar de 180 días desde su publicación.
Artículo 93.- Se prohíbe el transporte de lechesDTO 214, SALUD
Art. primero II Nº3
D.O. 04.02.2006 o sus envases vacíos junto a animales, detergentes, desinfectantes, pesticidas, combustibles u otras sustancias químicas que signifiquen riesgo sanitario.
Art. primero II Nº3
D.O. 04.02.2006 o sus envases vacíos junto a animales, detergentes, desinfectantes, pesticidas, combustibles u otras sustancias químicas que signifiquen riesgo sanitario.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Artículo 94.- Decreto 71, SALUD
Art. 1 N° 1
D.O. 06.03.2019Cuando los productores expendan leche directamente al público, deben cumplir los siguientes requisitos:
Art. 1 N° 1
D.O. 06.03.2019Cuando los productores expendan leche directamente al público, deben cumplir los siguientes requisitos:
a) contar con un local de ventas autorizado;
b) mantener las leches enfriadas a temperaturasDTO 214, SALUD
Art. primero II Nº4
D.O. 04.02.2006 inferiores a 4°C; c) expender las leches dentro de las ocho horas siguientes a la ordeña.
Art. primero II Nº4
D.O. 04.02.2006 inferiores a 4°C; c) expender las leches dentro de las ocho horas siguientes a la ordeña.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que las modificaciones introducidas al presente artículo rigen a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que las modificaciones introducidas al presente artículo rigen a contar de 180 días desde su publicación.
TITULO II
De los alimentos
Párrafo I
Disposiciones generales
Artículo 95.- Para los efectos de la aplicación del presente Reglamento, la responsabilidad derivada de las actividades de producción, importación, envase y comercialización de alimentos corresponderá individual o conjuntamente, según determine el Servicio de Salud competente, al productor, importador, envasador, distribuidor, vendedor o tenedor del producto.
Artículo 96.- Se prohíbe la fabricación, tenencia, distribución, comercialización o transferencia de alimentos elaborados o envasados en el país que, aun siendo destinados a la exportación, provengan de establecimientos que no hayan sido autorizados por la autoridad de salud competente.
Artículo 97.- Los alimentos de exportación que no cumplan con las normas establecidas en el presente Reglamento deberán llevar impreso en su envase y en forma destacada e indeleble, la clave "Z". Estos alimentos no podrán ser comercializados en el país.
Artículo 98.- Alimento alterado es aquel que por causas naturales de índole física, química o biológica, o por causas derivadas de tratamientos tecnológicos, aisladas o combinadas, ha sufrido modificación o deterioro en sus características organolépticas, en composición y/o su valor nutritivo.
Artículo 99.- Alimento adulterado es aquel que haDTO 475, SLAUD
Art. Unico, N° 16
D.O. 13.01.2000 experimentado por intervención del hombre, cambios que le modifican sus características o cualidades propias sin que se declaren expresamente en el rótulo, tales como:
Art. Unico, N° 16
D.O. 13.01.2000 experimentado por intervención del hombre, cambios que le modifican sus características o cualidades propias sin que se declaren expresamente en el rótulo, tales como:
a) la extracción parcial o total de cualquiera de los componentes del producto original;
b) la sustitución parcial o total de cualquiera de los componentes del producto original por otros inertes o extraños, incluida la adición de agua u otro material de relleno;
c) la mezcla, coloración, pulverización o encubrimiento, en tal forma que se oculte su inferioridad o disminuya su pureza.
Artículo 100.- Alimento falsificado es aquel que:
a) se designe, rotule o expenda con nombre o calificativo que no corresponda a su origen, identidad, valor nutritivo o estimulante; y
b) cuyo envase, rótulo o anuncio, contenga cualquier diseño o declaración ambigua, falsa o que pueda inducir a error, respecto a los ingredientes que componen el alimento.
Artículo 101.- Alimento contaminado es aquel que contenga:
a) microorganismos, virus y/o parásitos, sustancias extrañas o deletéreas de origen mineral, orgánico o biológico, sustancias radioactivas y/o sustancias tóxicas en cantidades superiores a las permitidas por las normas vigentes, o que se presuman nocivas para la salud;
b) cualquier tipo de suciedad, restos o excrementos;
c) aditivos no autorizados por las normas vigentes o en cantidades superiores a las permitidas.
Artículo 102.- Se prohíbe la fabricación,DTO 475, SALUD
Art. Unico, N° 17
D.O. 13.01.2000 importación, tenencia, distribución, comercialización o transferencia a cualquier título, de alimentos alterados, contaminados, adulterados o falsificados.
Art. Unico, N° 17
D.O. 13.01.2000 importación, tenencia, distribución, comercialización o transferencia a cualquier título, de alimentos alterados, contaminados, adulterados o falsificados.
Artículo 103.- No podrá llevarse a efecto enajenación alguna de alimentos, materias primas procedentes de rezagos de aduanas, de empresas de transporte o de salvataje de incendios, catástrofes, y desastres sin la aprobación de la autoridad sanitaria.
Artículo 104.- El interesado o el martillero encargado de la subasta en su caso, deberá solicitar con a lo menos veinte días de anticipación a la enajenación, una visita de inspección para comprobar el estado sanitario de los productos, acompañando para el efecto el inventario de los mismos.
Artículo 105.- Los alimentos que impliquen unDTO 68, SALUD
Art. primero Nº 6
D.O. 23.01.2006 riesgo para la salud deberán ser decomisados por la autoridad sanitaria, pudiendo quedar retenidos bajo custodia de su dueño o tenedor con prohibición de efectuar su traslado, consumo, expendio o distribución a cualquier título. Para estos efectos los establecimientos de alimentos deberán definir un espacio físico suficiente y adecuado para el almacenamiento de productos alimenticios no aptos para el consumo humano, productos que deberán constar con una marca clara, inequívoca e indeleble, como por ejemplo, una X de color rojo u otro signo similar en términos de prohibición.
Art. primero Nº 6
D.O. 23.01.2006 riesgo para la salud deberán ser decomisados por la autoridad sanitaria, pudiendo quedar retenidos bajo custodia de su dueño o tenedor con prohibición de efectuar su traslado, consumo, expendio o distribución a cualquier título. Para estos efectos los establecimientos de alimentos deberán definir un espacio físico suficiente y adecuado para el almacenamiento de productos alimenticios no aptos para el consumo humano, productos que deberán constar con una marca clara, inequívoca e indeleble, como por ejemplo, una X de color rojo u otro signo similar en términos de prohibición.
Estos productos podrán ser destinados a uso industrial no alimentario o alimentación animal, siempre que su desnaturalización sea autorizada por la autoridad sanitaria competente y, en caso que ello no sea posible, o no sea de interés de su propietario, deberán ser destruidos, incluyendo su disposición final en recinto adecuado para ello.
La autorización sanitaria para la desnaturalización deberá concederse expresamente previo pago del arancel correspondiente, siendo el costo de la operación de cargo del interesado, o de su propietario o tenedor, según el caso.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Párrafo II
De la rotulación y publicidad
Artículo 106.- "Para los efectos de esteDTO 57, SALUD
Art. único Nº 1
D.O. 06.05.2005 reglamento se entiende por:
Art. único Nº 1
D.O. 06.05.2005 reglamento se entiende por:
1) Alimento sucedáneo: Aquel alimento destinado a parecerse a un alimento usual, por su textura, aroma, sabor u olor, y que se utiliza como un sustituto completo o parcial del alimento al que se parece;
2) Alimentos desecados: Corresponden a frutas, verduras, hortalizas o leguminosas deshidratadas, aun cuando adopten presentaciones farmacéuticas por vía oral;
3) Adición: Agregado de uno o más nutrientes o factores alimentarios, por ejemplo fibra dietética a un alimento, para fines nutricionales, en una concentración menor a un 10% de la Dosis Diaria de Referencia (DDR), por porción de consumo habitual para un nutriente particular;
4) Alimento, ingrediente y materia alimentaria nuevos: Aquel alimento, ingrediente y materia alimentaria obtenido a través de procesos de síntesis físico químicos o a través de procesos que ocurren en la naturaleza que no corresponden a moléculas o compuestos propios de la alimentación humana conocida;
5) Suplementación: Es la adición de nutrientes a la alimentación, con el fin de producir un efecto nutricional saludable o fisiológico característico;
6) Complementación: La adición de nutrientes a un alimento que carece de ellos o que los contiene sólo en cantidades mínimas con el propósito de producir un efecto nutricional; la complementación comprende los conceptos de adición, enriquecimiento o fortificación y suplementación, según el porcentaje del nutriente agregado, basado en las Dosis Diarias de Referencia y por porción de consumo habitual;
7) Declaración de nutrientes: Relación o enumeración normalizada del contenido de nutrientes de un alimento;
8) Declaración de propiedades nutricionales: Cualquier representación que afirme, sugiera o implique que un producto alimenticio posee propiedades nutricionales particulares, especialmente, pero no sólo en cuanto a su valor energético, contenido de proteínas, grasas y carbohidratos disponibles, sino también por su contenido de vitaminas, minerales y otros factores alimentarios, como por ejemplo colesterol y fibra dietética;
9) Declaración de propiedades saludables: Cualquier representación que afirme, sugiera o implique que existe una relación entre un alimento, un nutriente u otra sustancia contenida en un alimento y una condición relacionada con la salud;
10) Descriptor: El término o palabra con que se define o describe determinada característica que se le atribuye a un alimento;
11) Factor alimentario: Sustancias nutrientes y sustancias no nutrientes que cumplen un rol en nuestro organismo, tales como colesterol, fibra dietética y otros;
12) Enriquecimiento o fortificación: La adición de uno o más nutrientes o fibra dietética a un alimento, en una concentración de un 10% o más de la Dosis Diaria de Referencia (DDR) por porción de consumo habitual para un nutriente en particular;
1DTO 58, SALUD
Art. 1 N 1
D.O. 16.06.20073) envase: cualquier recipiente que contenga alimentos, que los cubra total o parcialmente.
Art. 1 N 1
D.O. 16.06.20073) envase: cualquier recipiente que contenga alimentos, que los cubra total o parcialmente.
14) Evento biotecnológico: Asociación o combinación de genes, provenientes de distintas especies, producto de la ingeniería genética, distinta o en distinto orden, respecto a la que se da en la naturaleza en forma espontánea;
15) Fecha o plazo de duración mínimo: Aquella fecha o aquel plazo en que expira el período en que el fabricante garantiza que el producto, conservado bajo determinadas condiciones de almacenamiento, si las hubiera, mantiene todas las cualidades significativas que se le atribuyen, tácita o explícitamente, sin que esto signifique que el producto no puede ser comercializado más allá de esta fecha o plazo. El uso de fecha o plazo de duración mínimo es optativo;
Esta fecha o plazo de duración mínimo podrá indicarse en forma de recomendación pudiendo utilizarse la expresión "consumir preferentemente antes de" u otras equivalentes;
16) Fecha de elaboración: Aquélla en que el alimento se convierte en el producto descrito en el envase;
17) Fecha de envasado: Aquélla en la que el alimento se coloca en el envase en que se venderá finalmente;
18) Fecha de vencimiento o plazo de duración: Aquella fecha o aquel plazo en que el fabricante establece que, bajo determinadas condiciones de almacenamiento termina el período durante el cual el producto conserva los atributos de calidad esperados. Después de esa fecha o cumplido este plazo el producto no puede ser comercializado.
Para los efectos de utilizar el plazo de duración, se entenderá que éste empieza a regir a partir de la fecha de elaboración.
La fecha de vencimiento o el plazo de duración deberán ser claramente definidos, no aceptándose en estos casos expresiones tales como "consumir preferentemente antes de", u otras equivalentes, que resten precisión o relativicen la fecha de vencimiento o el plazo de duración;
19) Ingrediente: Cualquier sustancia, incluidos los aditivos, que se emplee en la fabricación o preparación de un alimento y esté presente en el producto final, aunque sea en forma modificada;
20) Ingrediente caracterizante: Aquel ingrediente que le da al alimento atributos peculiares de modo de distinguirlo claramente de los demás alimentos de su mismo tipo;
21) Lote: Cantidad determinada de un alimento producido en condiciones esencialmente iguales;
22) Normalización o estandarización: La adición o extracción de nutrientes a un alimento con el fin de compensar las variaciones naturales en el contenido de nutrientes;
23) Nutriente: Cualquier sustancia normalmente consumida como un constituyente de un alimento, y que es necesaria para el crecimiento, desarrollo y mantenimiento normal del organismo o cuya deficiencia hace que se produzcan cambios bioquímicos o fisiológicos característicos;
24) Nutriente esencial: Toda sustancia consumida como constituyente de un alimento necesario para el crecimiento, desarrollo y mantenimiento de las funciones vitales y que no puede ser sintetizado en cantidadeDTO 58, SALUD
Art. 1º Nº 1
D.O. 16.06.2007s suficientes por el organismo humano;
Art. 1º Nº 1
D.O. 16.06.2007s suficientes por el organismo humano;
25) porción de consumo habitual: cantidad de alimento generalmente consumida por una persona en una oportunidad, definida en función de la parte comestible del producto y referida al producto tal como éste se comercializa.
Para productos alimenticios deshidratados, que se consuman reconstituidos, la porción de consumo habitual se informar de acuerdo a las instrucciones de reconstitución.
26) Restitución: La adición a un alimento, de uno o más nutrientes, que se han perdido en el curso del proceso de fabricación, de almacenamiento y manipulación, en cantidades tales que dan lugar a la recuperación de tales pérdidas;
27) Rotulación: Conjunto de inscripciones, leyendas o ilustraciones contenidas en el rótulo que informan acerca de las características de un producto alimenticio;
28) Rotulación o etiquetado nutricional: Toda descripción destinada a informar al consumidor sobre las propiedades nutricionales de un producto alimenticio. Comprende la declaración de nutrientes y la información nutricional complementaria;
29) Rótulo: Marbete, etiqueta, marca, imagen u otra materia descriptiva o gráfica, que se haya escrito, impreso, estarcido, marcado en relieve o hueco grabado o adherido al envase de un alimento;
Decreto 63, SALUD
Art. 1 Nº 1
D.O. 11.12.200930) Carbohidratos disponibles: El total de carbohidratos con exclusión de la fibra dietética.
Art. 1 Nº 1
D.O. 11.12.200930) Carbohidratos disponibles: El total de carbohidratos con exclusión de la fibra dietética.
31) Alimentos listos para consumo (LPC): alimentos destinados por el productor o el fabricante o envasador al consumo humano directo sin necesidad de cocinado u otro tipo de transformación eficaz para eliminar o reducir a un nivel aceptable los microorganismos peligrosos.
32) Hipersensibilidad alimentaria: reacciones adversas a los alimentos de oDecreto 88, SALUD
Art. 1 Nº 1
D.O. 06.01.2011rigen no tóxico. Se dividen en Alergia alimentaria e Hipersensibilidad no alérgica a los alimentos.
Art. 1 Nº 1
D.O. 06.01.2011rigen no tóxico. Se dividen en Alergia alimentaria e Hipersensibilidad no alérgica a los alimentos.
33) Alimento de referencia: aquel alimento homólogo que sirve como patrón de comparación para realizar y destacar una modificación nutricional, restringido al descriptor reducido y sus sinónimos. Este alimento de referencia deberá estar presente en el mercado y ser de propia fabricación y, sólo en su defecto, se podrán considerar otros alimentos homólogos, también presentes en el mercado.
34) Publicidad: Decreto 13, SALUD
Art. 1 N° 1
D.O. 26.06.2015Toda forma de promoción, comunicación, recomendación, propaganda, información o acción destinada a promover el consumo de un determinado producto.
Art. 1 N° 1
D.O. 26.06.2015Toda forma de promoción, comunicación, recomendación, propaganda, información o acción destinada a promover el consumo de un determinado producto.
36) Vegetales pre-elaborados: frutas u hortalizas, combinadas o no, procesadasDecreto 15, SALUD
Art. 1 N° 1
D.O. 02.08.2017 para su consumo de manera de mantenerlos organolépticamente frescos a través de operaciones como: remoción de partes no comestibles, picado, laminación, trituración, cubeteado, centrifugación, sanitización y envasado, a los que se les puede prolongar su vida útil a través de la disminución y control de la carga microbiológica y de las condiciones de envasado u otros procesos tecnológicos.
Art. 1 N° 1
D.O. 02.08.2017 para su consumo de manera de mantenerlos organolépticamente frescos a través de operaciones como: remoción de partes no comestibles, picado, laminación, trituración, cubeteado, centrifugación, sanitización y envasado, a los que se les puede prolongar su vida útil a través de la disminución y control de la carga microbiológica y de las condiciones de envasado u otros procesos tecnológicos.
NOTA:
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
NOTA 1
El numeral 1 del artículo 1 del Decreto 15, Salud, publicado el 02.08.2017, modifica el presente artículo en el sentido de incluir el numeral 36, sin embargo, no se encuentra en dicho texto el numeral 35, razón por la cual se ingresa a continuación del 34.
El numeral 1 del artículo 1 del Decreto 15, Salud, publicado el 02.08.2017, modifica el presente artículo en el sentido de incluir el numeral 36, sin embargo, no se encuentra en dicho texto el numeral 35, razón por la cual se ingresa a continuación del 34.
Artículo 107.- Todos los productos alimenticios queDTO 475, SALUD
Art. Unico, N° 20
D.O. 13.01.2000 se almacenen, transporten o expendan envasados deberán llevar un rótulo o etiqueta que contenga la información siguiente:
Art. Unico, N° 20
D.O. 13.01.2000 se almacenen, transporten o expendan envasados deberán llevar un rótulo o etiqueta que contenga la información siguiente:
a) nombre del alimento. El nombre deberá indicar la verdadera naturaleza del alimento en forma específica. Sin perjuicio del nombre podráDTO 115, SALUD
Art. primero Nº 4
D.O. 25.11.2003 indicarse su marca comercial. En los productos sucedáneos deberá indicarse claramente esta condición. Junto al nombre o muy cerca del mismo, deberán aparecer las palabras o frases adicionales necesarias para evitar que se induzca a error o engaño respecto a la naturaleza y condición física auténtica del alimento, que incluyen pero que no se limitan al tipo o medio de cobertura, a la forma de presentación o al tipo de tratamDecreto 88, SALUD
Art. 1 Nº 2
D.O. 06.01.2011iento al que haya sido sometido.
Art. primero Nº 4
D.O. 25.11.2003 indicarse su marca comercial. En los productos sucedáneos deberá indicarse claramente esta condición. Junto al nombre o muy cerca del mismo, deberán aparecer las palabras o frases adicionales necesarias para evitar que se induzca a error o engaño respecto a la naturaleza y condición física auténtica del alimento, que incluyen pero que no se limitan al tipo o medio de cobertura, a la forma de presentación o al tipo de tratamDecreto 88, SALUD
Art. 1 Nº 2
D.O. 06.01.2011iento al que haya sido sometido.
INCISO ELIMINADO.
b) contenido neto expresado en unidades del sistema métrico decimal o del sistema internacional, mediante el símbolo de la unidad o con palabra completa. No deberá acompañar a los valores del contenido neto ningún término de significado ambiguo.
Además de la declaración del contenido neto, en los alimentos envasados en un medio líquido deberá indicarse en unidades del sistema métrico decimal o del sistema internacional, el peso drenado del alimento;
c) En el caso de los alimentos naciDecreto 4,
SALUD
Art. 1 Nº 2
D.O. 09.01.2013onales, el nombre o razón social y domicilio del fabricante, elaborador, procesador, envasador o distribuidor, según sea el caso;
SALUD
Art. 1 Nº 2
D.O. 09.01.2013onales, el nombre o razón social y domicilio del fabricante, elaborador, procesador, envasador o distribuidor, según sea el caso;
d) país de origen, debe indicarse en forDTO 115, SALUD
Art. primero Nº 4
D.O. 25.11.2003ma clara, tanto en los productos nacionales como en los importados, conforme a las normas de rotulación establecidas, respecto a esta información, en el decreto Nº 297, de 1992, del Ministerio de Economía, Fomento y Reconstrucción, o en el que lo reemplace;
Art. primero Nº 4
D.O. 25.11.2003ma clara, tanto en los productos nacionales como en los importados, conforme a las normas de rotulación establecidas, respecto a esta información, en el decreto Nº 297, de 1992, del Ministerio de Economía, Fomento y Reconstrucción, o en el que lo reemplace;
e) Número Decreto 38, SALUD
Art. 1 N° 1
D.O. 02.02.2021y fecha de la resolución y el nombre de la Secretaría Regional Ministerial de Salud que autoriza el establecimiento que elabora o envasa el producto;
Art. 1 N° 1
D.O. 02.02.2021y fecha de la resolución y el nombre de la Secretaría Regional Ministerial de Salud que autoriza el establecimiento que elabora o envasa el producto;
f) fecha de elaboración o fecha de envasado del producto. Esta deberá ser legible, se ubicará en un lugar del envase de fácil localización y se indicará en la forma y orden siguiente :
- el día, mediante dos dígitos
- el mes, mediante dos dígitos o las tres primeras
letras del mes, y
- el año, mediante los dos últimos dígitos.
En aquellos productos cuya duración mínima sea menorDTO 475, SALUD
Art. Unico, N° 20
D.O. 13.01.2000 o igual a 90 días, podrá omitirse el año. En aquellos productos cuya duración mínima sea igual o mayor a tres meses, podrá omitirsDTO 475, SALUD
Art. Unico, N° 20
D.O. 13.01.2000e el día.
Art. Unico, N° 20
D.O. 13.01.2000 o igual a 90 días, podrá omitirse el año. En aquellos productos cuya duración mínima sea igual o mayor a tres meses, podrá omitirsDTO 475, SALUD
Art. Unico, N° 20
D.O. 13.01.2000e el día.
ELIMINADO
La industria podrá identificar la fecha de elaboración con la clave correspondiente al lote de producción. En este caso los registros de esta última deberán estar disponible en todo momento a la autoridad sanitaria;
g) fecha de vencimientoDTO 475, SALUD
Art. Unico, N° 20
D.O. 13.01.2000 o plazo de duración del producto. Esta información se ubicará en el envase en un lugar fácil de localizar y con una leyenda destacada. La fecha de vencimiento se indicará en la forma y orden establecido para la fecha de elaboración. El plazo de duración se indicará en términos de días o de meses o de años, según corresponda, utilizando siempre unidades enteras, a menos que se trate de "duración indefinida", caso en el cual deberá consignarse dicha expresión.
Art. Unico, N° 20
D.O. 13.01.2000 o plazo de duración del producto. Esta información se ubicará en el envase en un lugar fácil de localizar y con una leyenda destacada. La fecha de vencimiento se indicará en la forma y orden establecido para la fecha de elaboración. El plazo de duración se indicará en términos de días o de meses o de años, según corresponda, utilizando siempre unidades enteras, a menos que se trate de "duración indefinida", caso en el cual deberá consignarse dicha expresión.
Los productos que identifiquen la fecha de elaboración con la clave del lote de producción, deberán rotular la duración en términos de fecha de vencimiento, mientras que los que indiquen expresamente la fecha de elaboración podrán utilizar la fecha de vencimiento o plazo de duración.
Los productos que rotulen "duración indefinida" deberán necesariamente indicar la fecha de elaboración.
Se Decreto 38, SALUD
Art. 1 N° 2
D.O. 02.02.2021exceptúan de esta rotulación, las frutas y hortalizas frescas, incluidos los tubérculos, que no han sufrido modificaciones en sus caracteres o composición, esto es, que no hayan sido peladas, cortadas o tratadas de otra forma análoga, salvo las que fueren necesarias para la separación de las partes no comestibles.
Art. 1 N° 2
D.O. 02.02.2021exceptúan de esta rotulación, las frutas y hortalizas frescas, incluidos los tubérculos, que no han sufrido modificaciones en sus caracteres o composición, esto es, que no hayan sido peladas, cortadas o tratadas de otra forma análoga, salvo las que fueren necesarias para la separación de las partes no comestibles.
h) ingredientes, en el rótuloDTO 807, SALUD
N° 1
D.O. 03.02.1998
DTO 115, SALUD
Art. primero Nº 4
D.O. 25.11.2003 deberá figurar la lista de todos los ingredientes y aditivos que componen el producto, con sus nombres específicos, en orden decreciente de proporciones, con la excepción correspondiente a los saborizantes/aromatizantes, de acuerdo a lo establecido en el artículo 136 del presente reglamento.
N° 1
D.O. 03.02.1998
DTO 115, SALUD
Art. primero Nº 4
D.O. 25.11.2003 deberá figurar la lista de todos los ingredientes y aditivos que componen el producto, con sus nombres específicos, en orden decreciente de proporciones, con la excepción correspondiente a los saborizantes/aromatizantes, de acuerdo a lo establecido en el artículo 136 del presente reglamento.
Cuando el alimento, ingrediente o derivado sea o contenga alguno de los causantes de hipersensibilidad (alergenos alimentarios) reconocidos ofiDecreto 88, SALUD
Art. 1 Nº 2
D.O. 06.01.2011cialmente por resolución del Ministerio de Salud, publicada en el Diario Oficial, el o los alergenos deberán señalarse en la misma lista de ingredientes, con letra de tamaño igual o mayor a las letras de los ingredientes generales, o bajo el título "Contiene..." u otro similar. Si el ingrediente es un derivado de cualquiera de los alergenos reconocidos por la citada resolución, deberá rotularse el ingrediente y además el alergeno, como el ejemplo siguiente: caseína (leche) o caseína de leche.
Art. 1 Nº 2
D.O. 06.01.2011cialmente por resolución del Ministerio de Salud, publicada en el Diario Oficial, el o los alergenos deberán señalarse en la misma lista de ingredientes, con letra de tamaño igual o mayor a las letras de los ingredientes generales, o bajo el título "Contiene..." u otro similar. Si el ingrediente es un derivado de cualquiera de los alergenos reconocidos por la citada resolución, deberá rotularse el ingrediente y además el alergeno, como el ejemplo siguiente: caseína (leche) o caseína de leche.
Si el producto alimenticio tiene riesgo de contaminarse, desde la producción o elaboración hasta la comercialización, con los citados alergenos, se deberá incluir a continuación de la lista de ingredientes, cualquiera de las siguientes frases: "Puede contener...", "Contiene pequeñas cantidades de ...", "Contiene trazas de ..." o "Elaborado en líneas que también procesan...."; indicando el alergeno de que se trate;
i) aditivos, se debe indicar en el rótulo la incorporación de aditivos, en orden decreciente de concentraciones, con sus nombres específicos, con las excepciones indicadas en el título coDTO 57, SALUD
Art. único Nº 2 a)
D.O. 06.05.2005rrespondiente. Se debe incluir en la lista de ingredientes todo aditivo alimentario que haya sido empleado en las materias primas y otros ingredientes de un alimento, y que se transfiera a éste en cantidad suficiente para desempeñar en él una función tecnológica
Art. único Nº 2 a)
D.O. 06.05.2005rrespondiente. Se debe incluir en la lista de ingredientes todo aditivo alimentario que haya sido empleado en las materias primas y otros ingredientes de un alimento, y que se transfiera a éste en cantidad suficiente para desempeñar en él una función tecnológica
j) DTO 57, SALUD
Art. único Nº 2 b)
D.O. 06.05.2005información nutricional de acuerdo a lo establecido en el artículo 115 del presente reglamento; k) instrucciones para el almacenamiento, además de la fecha de duración mínima se debe indicar en la etiqueta las condiciones especiales que se requieran para la conservación del alimento, si de su cumplimiento depende la validez de la fecha de duración mínima. En caso de que, una vez abierto el envase, el producto necesite de refrigeración u otro ambiente especial, deberá también señalarse en la rotulación;
Art. único Nº 2 b)
D.O. 06.05.2005información nutricional de acuerdo a lo establecido en el artículo 115 del presente reglamento; k) instrucciones para el almacenamiento, además de la fecha de duración mínima se debe indicar en la etiqueta las condiciones especiales que se requieran para la conservación del alimento, si de su cumplimiento depende la validez de la fecha de duración mínima. En caso de que, una vez abierto el envase, el producto necesite de refrigeración u otro ambiente especial, deberá también señalarse en la rotulación;
l) instrucciones para su uso, el rótulo debe contener las instrucciones que sean necesarias sobre el modo de empleo, incluida la reconstitución, si es el caso, para asegurar la correcta utilización del alimento;
m) En el caso de lDecreto 4,
SALUD
Art. 1 Nº 3
D.O. 09.01.2013os productos importados, el nombre y domicilio del importador.
SALUD
Art. 1 Nº 3
D.O. 09.01.2013os productos importados, el nombre y domicilio del importador.
El importador estará obligado a mantener un registro de todas las partidas internadas al país, por un plazo mínimo de 90 días posteriores a la fecha de vencimiento o del plazo de duración del producto, según corresponda. Los alimentos de duración indefinida deberán mantener el registro, al menos, durante tres años.
Este registro deberá incluir los antecedentes de la destinación aduanera, los antecedentes sanitarios del producto, la autorización de uso y consumo, las claves de los lotes de producción o fechas de elaboración, la fecha de vencimiento, el país de origen, tipo de producto, la marca comercial, el nombre del proveedor extranjero y estará, en todo momento, a disposición de la Autoridad Sanitaria.
La clave del lote de producción o la fecha de elaboración deberá, además, estar estampada en el envase, permitiendo distinguir, inequívocamente, las distintas partidas o lotes de producción.
Los alimentos importados deberán cumplir con todas las demás normas de etiquetado vigentes en aquello no expresamente regulado en este literal. La autorización de internación y consumo se efectuará partida por partida, quedando, por lo tanto, sujetos a todos los controles que la Autoridad Sanitaria deba realizar conforme a lo dispuesto en el presente reglamento; n) el alimento y/o materia prima para consumo humano, modificados por medio de eventos biotecnológicos, que presenten características nutricionales distintas a las del alimento y/o materia prima convencional, deberá hacer mención de ellas en el rótulo, de acuerdo a lo establecido en los artículos 113 y 115 al 120 de este reglamento.
NOTA:
El artículo transitorio del DTO 475, Salud, publicado el 13.01.2000, establece un plazo de seis meses, a partir de la publicación en el D.O. de dicho decreto, para dar cumplimiento a lo señalado en el artículo 107, letra g) de este decreto, respecto a la rotulación de la fecha de vencimiento o plazo de duración. En el caso de bebidas comercializadas en envases retornables, cuya rotulación sea impresa directamente en el envase, el plazo será de dos años.
El artículo transitorio del DTO 475, Salud, publicado el 13.01.2000, establece un plazo de seis meses, a partir de la publicación en el D.O. de dicho decreto, para dar cumplimiento a lo señalado en el artículo 107, letra g) de este decreto, respecto a la rotulación de la fecha de vencimiento o plazo de duración. En el caso de bebidas comercializadas en envases retornables, cuya rotulación sea impresa directamente en el envase, el plazo será de dos años.
NOTA: 1
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
NOTA: 2
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
Artículo 108.- Además los productos importados deberán cumplir con todas las disposiciones de rotulación estipuladas en el presenteDecreto 88, SALUD
Art. 1 Nº 3
D.O. 06.01.2011 Reglamento. Cualquier información especificada en este Reglamento y que no haya sido considerada en la rotulación original, que no esté en castellano o no esté indicada de acuerdo a lo establecido en este Reglamento, se deberá colocar en una etiqueta adherida permanentemente al envase, de un tamaño y ubicación adecuados.
Art. 1 Nº 3
D.O. 06.01.2011 Reglamento. Cualquier información especificada en este Reglamento y que no haya sido considerada en la rotulación original, que no esté en castellano o no esté indicada de acuerdo a lo establecido en este Reglamento, se deberá colocar en una etiqueta adherida permanentemente al envase, de un tamaño y ubicación adecuados.
Artículo 109.- La información en el rótulo deberá estar en idioma castellano, pudiendoDecreto 31, SALUD
Art. 1 N° 1
D.O. 13.12.2016 repetirse eventualmente en otro idioma. Los datos deberán señalarse con caracteres visibles, indelebles y fáciles de leer en circunstancias normales de compra y uso. En el caso de envases transparentes, se prohíbe la colocación de información obligatoria en el reverso de la etiqueta adherida al envase. No se permitirá sobreimpresión o cualquier modificación de la información contenida en el rótulo original, salvo autorización por escrito de la autoridad sanitaria, con las siguientes excepciones:
Art. 1 N° 1
D.O. 13.12.2016 repetirse eventualmente en otro idioma. Los datos deberán señalarse con caracteres visibles, indelebles y fáciles de leer en circunstancias normales de compra y uso. En el caso de envases transparentes, se prohíbe la colocación de información obligatoria en el reverso de la etiqueta adherida al envase. No se permitirá sobreimpresión o cualquier modificación de la información contenida en el rótulo original, salvo autorización por escrito de la autoridad sanitaria, con las siguientes excepciones:
1) Los productos importados cuya rotulación esté en otro idioma o no cumpla con las exigencias del presente reglamento en lo que a rotulación se refiere.
2) Los productos que utilicen la sobreimpresión o modificación de la información en el rótulo en conformidad a las disposiciones del artículo 120 bis del presente reglamento, incluyendo el ajuste de la información nutricional que debe declararse o eliminando información incompatible con dicho descriptor, cuando corresponda
Artículo 110.- La rotulación y publicidad de cualquier tipo no deberá contener palabras, ilustraciones y/u otras representaciones gráficas queDTO 115, SALUD
Art. primero Nº 5
D.O. 25.11.2003 puedan inducir a equívocos, engaños o falsedades, o que de alguna forma sean susceptibles de crear una impresión errónea respecto a la naturaleza, composición o calidad del producto. Asimismo, no deberán sugerirse ni indicarse efectos terapéuticos, curativos ni posologías.
Art. primero Nº 5
D.O. 25.11.2003 puedan inducir a equívocos, engaños o falsedades, o que de alguna forma sean susceptibles de crear una impresión errónea respecto a la naturaleza, composición o calidad del producto. Asimismo, no deberán sugerirse ni indicarse efectos terapéuticos, curativos ni posologías.
En aquellos alimentos o productos alimenticios queDTO 115, SALUD
Art. primero Nº 5
D.O. 25.11.2003 contengan saborizantes/aromatizantes
Art. primero Nº 5
D.O. 25.11.2003 contengan saborizantes/aromatizantes
(saborizante/aromatizante natural, saborizante/aromatizante idéntico a natural y/o saborizante/aromatizante artificial), se admitirá la representación gráfica del alimento o sustancia cuyo sabor caracteriza al producto, aunque éste no lo contenga, debiendo acompañar el nombre del alimento con las expresiones: "Sabor a ..." o "Sabor ..." llenando el espacio en blanco con el nombre del sabor o sabores caracterizantes, con letras en idéntico color, realce y visibilidad.
Para destacar la ausencia de nutrientes, Decreto 88, SALUD
Art. 1 Nº 4
D.O. 06.01.2011factores alimentarios o ingredientes, natural o normalmente ausentes en un alimento, deberá hacerse en términos genéricos y no como una característica exclusiva del alimento que lo declara.
Art. 1 Nº 4
D.O. 06.01.2011factores alimentarios o ingredientes, natural o normalmente ausentes en un alimento, deberá hacerse en términos genéricos y no como una característica exclusiva del alimento que lo declara.
NOTA:
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
Artículo 110 bis: Tratándose de cualquier alimento o producto alimenticio que, en su composición nutricional, contenga energía, sodio, azúcares o grasa saturada en cantidades superiores a las establecidas en la Tabla Nº1 del artículo 120 bis de este reglamento, no se podrá realizar publicidad dirigida a menores de 14 años, cualquiera sea el lugar donde ésta se realice.
Para estos efectos, se podrá considerar que la publicidad está dirigida a este grupo etario si emplea, entre otros elementos, personajes y figuras infantiles, animaciones, dibujos animados, juguetes, música infantil, si contempla la presencia de personas o animales que atraigan el interés de menores de 14 años, o si contiene declaraciones o argumentos fantásticos acerca del producto o sus efectos, voces infantiles, lenguaje o expresiones propias de niños, o situaciones que representen su vida cotidiana, como son la escuela, el recreo o los juegos infantiles. Esta calificación deberá ser fundada.
De igual manera, en la publicidad de estos alimentos no se podrán utilizar aplicaciones interactivas, juegos, concursos u otros elementos similares, dirigidos a menores de 14 años.
Del mismo modo, también se entiende que la publicidad de tales alimentos o productos alimenticios está dirigida a menores de 14 años, cuando se realiza en programas o sitios web dirigidos a ese público objetivo; o cuando estos programas o sitios web capten una audiencia de menores de 14 años, mayor al 20%. Tampoco podrán publicitarse dichos alimentos o productos alimenticios en espacios publicitarios durante, entre o inmediatamente antes o después de la difusión de dichos programas o sitios web.
Los alimentos o productos alimenticios que, en su composición nutricional, contengan energía, sodio, azúcares o grasa saturada en cantidades superiores a las establecidas en la Tabla Nº1 del artículo 120 bis de este reglamento, no podrán ofrecerse o entregarse gratuitamente a los menores de 14 años, ni utilizar ganchos comerciales dirigidos a éstos, no relacionados con la promoción propia del producto, tales como: juguetes, accesorios, adhesivos, incentivos u otros similares.
Estos alimentos o productos alimenticios no se podrán expender, comercializar, promocionar ni publicitar dentro de los establecimientos de educación parvularia, básica o media.
La publicidad de estos alimentos que se efectúe por medios de comunicación masivos, deberá llevar un mensaje que promueva hábitos de vida saludable, cuyas características serán determinadas por decreto supremo del Ministerio de Salud dictado "por orden del Presidente de la República".
Se exceptuarán de las disposiciones de este artículo, los alimentos o las mezclas de éstos, a los que no se les haya añadido azúcares, miel, jarabes, sodio o grasas saturadas.
Artículo 110 ter.- Cuando Decreto 24
Art. 1 N° 1
D.O. 28.11.2017a un alimento o producto alimenticio se le haya adicionado sodio, azúcares o grasas saturadas, y su contenido supere el valor establecido para estos nutrientes en la Tabla N° 1 del artículo 120 bis de este reglamento, o bien, cuando se le haya adicionado azúcares, miel, jarabes o grasas saturadas, y su contenido de energía supere el valor de energía establecido en esa misma tabla, no se podrá realizar ningún tipo de publicidad destinada a promover el consumo de ellos en todas las transmisiones de cine y televisión entre las 06:00 y las 22:00 horas.
Art. 1 N° 1
D.O. 28.11.2017a un alimento o producto alimenticio se le haya adicionado sodio, azúcares o grasas saturadas, y su contenido supere el valor establecido para estos nutrientes en la Tabla N° 1 del artículo 120 bis de este reglamento, o bien, cuando se le haya adicionado azúcares, miel, jarabes o grasas saturadas, y su contenido de energía supere el valor de energía establecido en esa misma tabla, no se podrá realizar ningún tipo de publicidad destinada a promover el consumo de ellos en todas las transmisiones de cine y televisión entre las 06:00 y las 22:00 horas.
Se exceptúa de la medida señalada en el inciso anterior, la publicidad en todos los servicios de televisión y cine realizada durante la transmisión de eventos o espectáculos deportivos, culturales, artísticos o de beneficencia social, cuando cumplan los siguientes requisitos copulativos:
a) Que la publicidad se encuentre acotada a la exhibición del nombre del producto o su marca.
b) Que la publicidad no esté destinada o dirigida, directa o indirectamente a menores de 14 años.
c) Que, el evento o espectáculo no sea organizado o financiado, exclusivamente, por la empresa interesada en la publicidad del producto o por sus coligadas o relacionadas.
d) Que la publicidad no muestre situaciones de consumo que induzcan a este ni al producto promocionado, tales como: personas o personajes ingiriendo el producto o situaciones que enuncien o hagan inferir su ingesta.
No se aplicarán las disposiciones de este artículo a los alimentos o mezclas de éstos a los que no se les haya añadido azúcares, miel, jarabes, sodio o grasas saturadas.
Artículo 111.- La información debe colocarse en el envase de manera que no se separe del mismo. Cuando el envase esté cubierto por una envoltura no transparente, en ésta deberá figurar toda la información necesaria.
Artículo 112.- Cuando en el etiquetado de un alimento se destaque la presencia o el contenido de uno o más ingredientes caracterizantes, o cuando la descripción del alimento produzca el mismo efecto, deberá declararse el porcentaje de él o los ingredientes masa/masa, en el producto final.DTO 57, SALUD
Art. único Nº 3
D.O. 06.05.2005 Se excluyen de la aplicación de este artículoDecreto 88, SALUD
Art. 1 Nº 5
D.O. 06.01.2011, aquellos ingredientes que son objeto de condiciones o criterios específicos de rotulación, en otros artículos del presente Reglamento o en sus resoluciones complementarias.
Art. único Nº 3
D.O. 06.05.2005 Se excluyen de la aplicación de este artículoDecreto 88, SALUD
Art. 1 Nº 5
D.O. 06.01.2011, aquellos ingredientes que son objeto de condiciones o criterios específicos de rotulación, en otros artículos del presente Reglamento o en sus resoluciones complementarias.
NOTA:
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
Artículo 113.- En el etiquetado nutricional seDTO 57, SALUD
Art. único Nº 4
D.O. 06.05.2005 podrá facultativamente, incorporar información nutricional complementaria y cuando corresponda, deberán rotular junto al nombre principal del alimento o formando parte del mismo o junto a la información nutricional, en caracteres destacados, el descriptor nutricional correspondiente de acuerdo a lo establecido en el artículo 120 de este reglamento.
Art. único Nº 4
D.O. 06.05.2005 podrá facultativamente, incorporar información nutricional complementaria y cuando corresponda, deberán rotular junto al nombre principal del alimento o formando parte del mismo o junto a la información nutricional, en caracteres destacados, el descriptor nutricional correspondiente de acuerdo a lo establecido en el artículo 120 de este reglamento.
NOTA:
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
Artículo 114.- Todos los alimentos que en suDTO 58, SALUD
Art. 1º Nº 2
D.O. 16.06.2007 rotulación o publicidad declaren propiedades saludables o, cuando su descripción produzca el mismo efecto, quedarán afectos a la declaración de nutrientes tal como lo establece el presente reglamento. Las declaraciones de propiedades saludables deberán ser científicamente reconocidas o consensuadas internacionalmente y deberán estar enmarcadas dentro de las normas técnicas sobre directrices nutricionales aprobadas por resolución del Ministerio de Salud, la que se publicará en el Diario Oficial.
Art. 1º Nº 2
D.O. 16.06.2007 rotulación o publicidad declaren propiedades saludables o, cuando su descripción produzca el mismo efecto, quedarán afectos a la declaración de nutrientes tal como lo establece el presente reglamento. Las declaraciones de propiedades saludables deberán ser científicamente reconocidas o consensuadas internacionalmente y deberán estar enmarcadas dentro de las normas técnicas sobre directrices nutricionales aprobadas por resolución del Ministerio de Salud, la que se publicará en el Diario Oficial.
Tanto la declaración de propiedades saludables como la declaración de propiedades nutricionales de un alimento o cuando su descripción produzca ese mismo efecto, en su rotulación y/o publicidad, no podrán hacer asociaciones falsas, inducir el consumo innecesario de un alimento ni otorgar sensación de protección respecto de una enfermedad o condición de deterioro de la salud.
Será responsabilidad del fabricante, importador y/o envasador final, que toda la información en el rótulo sea fidedigna y dé cumplimiento a lo establecido en el presente reglamento.
Artículo 115.- Todos los alimentos envasadosDTO 58, SALUD
Art. 1º Nº 3
D.O. 16.06.2007 listos para su entrega al consumidor final deberán obligatoriamente incorporar en su rotulación la siguiente información nutricional:
Art. 1º Nº 3
D.O. 16.06.2007 listos para su entrega al consumidor final deberán obligatoriamente incorporar en su rotulación la siguiente información nutricional:
a) Valor energético o energía expresado en calorías (unidad de expresión kcal), las cantidadesDecreto 14, SALUD
Art. 1 N° 1
D.O. 18.10.2011 de proteínas, grasas totales, hidratos de carbono disponibles o carbohidratos disponibles y azúcares totales, en gramos (unidad de expresión g) y el sodio en miligramos (unidad de expresión mg).
Art. 1 N° 1
D.O. 18.10.2011 de proteínas, grasas totales, hidratos de carbono disponibles o carbohidratos disponibles y azúcares totales, en gramos (unidad de expresión g) y el sodio en miligramos (unidad de expresión mg).
En aquellos productos cuyo contenido total de grasa sea igual o mayor a 3 gramos por porción de consumo habitual, deberán declararse además de la grasa total, las cantidades de ácidos grasos saturados, monoinsaturados, poliinsaturados y ácidos grasos trans, en gramos y el colesterol en miligramos.
En el caso de aquellos alimentos que contengan una cantidad igual o menor a 0,5 gramos de ácidos grasos trans por porción de consumo habitual, se aceptará como alternativa la declaración que el alimento no contiene más de 0,5 gramos de ácidos grasos trans por porción.
En el caso de aquellos alimentos que contengan una cantidad igual o menor a 35 miligramos de sodio por porción de consumo habitual, se aceptará como alternativa la declaración que el alimento no contiene más de 35 miligramos de sodio por porción.
En el caso de aquellos alimentos que contengan una cantidad igual o menor a 0,5 gramos de azúcares por porción de consumo habitual, se aceptará como alternativa la declaración que el alimento no contiene más de 0,5 gramos de azúcares por porción.
b) La cantidad de cualquier otro nutriente o factor alimentario, como fibra dietética y colesterol, acerca del que se haga una declaración de propiedades nutricionales y/o saludables.
Todos estos valores deben expresarse por 100 g o 100 ml y por porción de consumo habitual del alimento. Deberá señalarse el número de porciones que contiene el envase y el tamaño de la porción en gramos o mililitros y en medidas caseras.
Los valores que figuren en la declaración de nutrientes deberán ser valores medios ponderados derivados de datos específicamente obtenidos de análisis de alimentos realizados en laboratorios o de tablas de composición de alimentos debidamente reconocidas por organismos nacionales o internacionales, que sean representativos del alimento sujeto a la declaración.
Los límites de tolerancia para los valores de los nutrientes declarados en el rótulo, serán los siguientes:
Para Decreto 13, SALUD
Art. 1 N° 4
D.O. 26.06.2015aquellos alimentos que en su rotulación declaren mensajes nutricionales o saludables y para aquellos que utilicen descriptores nutricionales, con excepción de aquellos que rotulen el descriptor del artículo 120 bis del presente reglamento, los límites de tolerancia para el valor declarado del nutriente en cuestión, serán los siguientes:
Art. 1 N° 4
D.O. 26.06.2015aquellos alimentos que en su rotulación declaren mensajes nutricionales o saludables y para aquellos que utilicen descriptores nutricionales, con excepción de aquellos que rotulen el descriptor del artículo 120 bis del presente reglamento, los límites de tolerancia para el valor declarado del nutriente en cuestión, serán los siguientes:
i) cuando los nutrientes y factores alimentarios
sean expresados como proteínas, vitaminas,
minerales, fibra dietaria y/o grasas
monoinsaturadas y poliinsaturadas, deberán
estar presentes en una cantidad mayor o igual
al valor declarado en el rótulo;
ii) cuando los nutrientes y factores alimentarios
sean expresados como energía, hidratos de
carbono, azúcares, grasa total, colesterol,
grasa saturada, grasa trans y/o sodio,
deberán estar presentes en una cantidad
menor o igual al valor declarado en
el rótulo. La Decreto 13. SALUD
Art. 1 N° 5
D.O. 26.06.2015tolerancia anteriormente
Art. 1 N° 5
D.O. 26.06.2015tolerancia anteriormente
descrita, aplicará también para los
descriptores nutricionales referidos
en el artículo 120 bis del presente
reglamento.
Para aquellos alimentos que en su rotulación no destaquen mensajes nutricionales o saludables, ni utilicen descriptores nutricionales, los límites de tolerancia para el etiquetado nutricional serán los siguientes:
i) cuando los nutrientes y factores alimentarios
sean expresados como proteínas, vitaminas,
minerales, fibra dietaria y/o grasas
monoinsaturadas y poliinsaturadas, deberán
estar presentes en una cantidad mayor o
igual al 80% del valor declarado en el
rótulo;
ii) cuando los nutrientes y factores alimentarios
sean expresados como energía, hidratos de
carbono, azúcares, grasa total, colesterol,
grasa saturada, grasa trans y/o sodio, podrán
exceder sólo hasta un 20% del valor declarado
en el rótulo.
En cualquier caso, los límites de vitaminas, minerales y fibra dietaria no deberán sobrepasar los valores establecidos en la resolución Nº 393/02 y sus modificaciones, que fija Directrices Nutricionales sobre Uso de Vitaminas, Minerales y Fibras Dietéticas en Alimentos y la resolución 394/02 y sus modificaciones, que fija Directrices Nutricionales sobre Suplementos Alimentarios y sus contenidos en Vitaminas y Minerales, todas del Ministerio de Salud.
Para aquellos nutrientes cuyo porcentaje de variabilidad, en función de la especie y del tipo de manejo, sea superior a la tolerancia permitida, la empresa deberá mantener a disposición de la autoridad sanitaria los antecedentes técnicos que lo justifiquen.
Se exceptuarán del cumplimiento de lo anteriormente dispuesto en este artículo:
i) Los alimentos predefinidos, fraccionados y
envasados con antelación al momento de la
venta en el lugar de expendio, incluidos los
platos preparados, los que deberán cumplir
con lo establecido en el artículo 468 de
este reglamento;
ii) Los estimulantes o fruitivos sin agregado de
otros ingredientes, los aditivos, los
coadyuvantes de elaboración, las especias
solas o en mezclas sin otros ingredientes y
las frutas y hortalizas en su estado natural;
iii) Los alimentos que se comercialicen a granel,
los porcionados o fraccionados y los
preparados a solicitud del público, aunque
éstos se envasen al momento de la venta.
Facultativamente, se podrá hacer declaración de nutrientes en la etiqueta de los alimentos que no tengan obligatoriedad de hacerlo, la que en todo caso, deberá estar de acuerdo con lo establecido en el presente reglamento.
La expresión numérica de los nutrientes y factores alimentarios; la aproximación para expresar los valores de nutrientes y factores alimentarios y la expresión de los valores de las porciones de consumo habitual y de las medidas caseras, se realizarán de acuerdo a los siguientes criterios:
Expresión numérica de nutrientes y factores alimentarios:
Valores iguales o mayores a 100 Se declararán en
números enteros
Valores menores a 100 y Se declararán en
números enteros o con
mayores o iguales a 10 un decimal
Valores menores a 10 y Se declararán en
números enteros o
mayores o iguales a 1 hasta con dos decimales
Valores menores a 1 Se declararán hasta con
dos decimales
Criterios de aproximación para valores de nutrientes y factores alimentarios en cifras con decimales.
i) Si el dígito que se va a descartar es igual
o mayor que 5, se aumenta en una unidad el
dígito anterior.
ii) Si el dígito que se va a descartar es menor
que 5 se deja el dígito anterior.
La expresión numérica del núDecreto 88, SALUD
Art. 1 Nº 6
D.O. 06.01.2011mero de porciones de consumo habitual deberá ser en números enteros y la expresión del tamaño de la porción en medidas caseras puede ser en unidades, rebanadas, trozos, tazas, cucharadas u otras similares o sus partes, como por ejemplo media cucharada o 1/4 taza. Cuando el resultado de dividir el contenido del envase por el tamaño de la porción definida, no sea número entero, o cuando no sea fácilmente definible, las porciones se aproximarán con los criterios de aproximación matemática de los valores de nutrientes y factores alimentarios, anteriormente descritos. Cuando la aproximación matemática corresponda que sea al entero superior, será obligatorio el uso de la expresión "alrededor de" o la expresión "aprox.", acompañando al número entero obtenido. Cuando la aproximación matemática corresponda que sea al entero inferior, será facultativo el uso de la expresión "alrededor de" o la expresión "aprox.", acompañando al número entero obtenido.
Art. 1 Nº 6
D.O. 06.01.2011mero de porciones de consumo habitual deberá ser en números enteros y la expresión del tamaño de la porción en medidas caseras puede ser en unidades, rebanadas, trozos, tazas, cucharadas u otras similares o sus partes, como por ejemplo media cucharada o 1/4 taza. Cuando el resultado de dividir el contenido del envase por el tamaño de la porción definida, no sea número entero, o cuando no sea fácilmente definible, las porciones se aproximarán con los criterios de aproximación matemática de los valores de nutrientes y factores alimentarios, anteriormente descritos. Cuando la aproximación matemática corresponda que sea al entero superior, será obligatorio el uso de la expresión "alrededor de" o la expresión "aprox.", acompañando al número entero obtenido. Cuando la aproximación matemática corresponda que sea al entero inferior, será facultativo el uso de la expresión "alrededor de" o la expresión "aprox.", acompañando al número entero obtenido.
c) La declaración de nutrientes debeDecreto 14, SALUD
Art. 1 N° 2
D.O. 18.10.2011rá cumplir con las siguientes características:
Art. 1 N° 2
D.O. 18.10.2011rá cumplir con las siguientes características:
1) Las familias tipográficas que se utilizarán serán las Arial, Dax, Futura, Helvética, Myriad, Swiss y Univers, u otras familias equivalentes que posean igual peso y consistencia visual, de cortes y perfiles rectos, sin serif, y que incluyan versiones bold (negrita) y condensadas estandarizadas.
2) La altura mínima de las letras y números será de 1,2 milímetros medidos en la altura de una letra H mayúscula en las familias tipográficas previamente definidas o sus equivalentes, lo que equivale aproximadamente a 5 puntos tipográficos definidos en los softwares (programas) de diseño gráfico.
3) Los colores utilizados en la combinación del fondo con las letras y números con los que se entrega la información nutricional, deberán tener entre sí el máximo contraste posible, usándose para este fin colores planos o llenos, sin gradaciones de color o tramas.
4) La información deberá ordenarse de preferencia en forma vertical, usando dos columnas, una para la información por 100 g ó 100 ml (según corresponda) y otra para la información por porción de consumo habitual. Se aceptará un ordenamiento horizontal o división de la información en dos cuerpos o a renglón seguido.
NOTA:
El Art. 2º del DTO 58, Salud, publicado el 16.06.2007, dispuso que las modificaciones introducidas en el presente artículo referidas a la expresión numérica de nutrientes y factores alimentarios, la referida a los criterios de aproximación para valores de nutrientes y factores alimentarios y la referida a la expresión del número de porciones de consumo habitual y medidas caseras, entrarán en vigencia en el plazo de 12 meses desde su publicación.
El Art. 2º del DTO 58, Salud, publicado el 16.06.2007, dispuso que las modificaciones introducidas en el presente artículo referidas a la expresión numérica de nutrientes y factores alimentarios, la referida a los criterios de aproximación para valores de nutrientes y factores alimentarios y la referida a la expresión del número de porciones de consumo habitual y medidas caseras, entrarán en vigencia en el plazo de 12 meses desde su publicación.
Artículo 116.- Cuando se haga una declaración de propiedadesDecreto 14, SALUD
Art. 1 N° 3
D.O. 18.10.2011 nutricionales o saludables con respecto a la cantidad o el tipo de carbohidratos disponibles o hidratos de carbono disponibles deberá incluirse, además de lo prescrito en el artículo 115, la cantidad total de cualquier carbohidrato disponible o hidratos de carbono disponibles involucrada en la declaración o mensaje.
Art. 1 N° 3
D.O. 18.10.2011 nutricionales o saludables con respecto a la cantidad o el tipo de carbohidratos disponibles o hidratos de carbono disponibles deberá incluirse, además de lo prescrito en el artículo 115, la cantidad total de cualquier carbohidrato disponible o hidratos de carbono disponibles involucrada en la declaración o mensaje.
Cuando se haga declaración de propiedades nutricionales o saludables respecto a la fibra dietética, además de lo establecido en el artículo 115, deberá indicarse la cantidad de fibra dietética total, de fibra soluble, de fibra insoluble y de la(s) fibra(s) dietética(s) involucrada(s) en la declaración o mensaje.
Asimismo, cuando se declaren propiedades nutricionales o saludables respecto a la cantidad o tipo de ácidos grasos deberá indicarse inmediatamente a continuación de la declaración del contenido total de grasa, las cantidades de ácidos grasos saturados, ácidos grasos monoinsaturados, poliinsaturados, ácidos grasos trans y colesterol. Se exceptúan de esta obligatoriedad aunque hagan una declaración de propiedad, usen un descriptor nutricional o un mensaje saludable, a los alimentos que cumplen con los parámetros establecidos en el artículo 120 para el descriptor nutricional "libre de grasas total".
Artículo 117.- La declaración de propiedadesDTO 238, SALUD
Art. 1°, N° 2
D.O. 26.05.2000 nutricionales, la declaración de propiedades saludables, la declaración de nutrientes y la información nutricional complementaria, deberán ceñirse a las normas técnicas que imparta al respecto el Ministerio de Salud por resolución que se publicará en el Diario Oficial.
Art. 1°, N° 2
D.O. 26.05.2000 nutricionales, la declaración de propiedades saludables, la declaración de nutrientes y la información nutricional complementaria, deberán ceñirse a las normas técnicas que imparta al respecto el Ministerio de Salud por resolución que se publicará en el Diario Oficial.
Artículo 118.- Cuando se haga declaración deDTO 475, SALUD
Art. Unico, N° 26
D.O. 13.01.2000 nutrientes podrán enumerarse, además, las vitaminas y minerales que se hallen presentes en cantidades significativas, 5% o más de la ingesta recomendada para la población pertinente. Para la población mayor de cuatro años se usará la Dosis Diaria de Referencia (DDR), en energía, proteínas, vitaminas y minerales propuesta por el Codex Alimentarius, en el caso de la vitamina E, biotina, ácido pantoténico, cobre y selenio, que no están especificadas en el Codex Alimentarius, se utilizarán los valores propuestos por la Food and Drug Administration (FDA), References Daily Intakes (RDI).
Art. Unico, N° 26
D.O. 13.01.2000 nutrientes podrán enumerarse, además, las vitaminas y minerales que se hallen presentes en cantidades significativas, 5% o más de la ingesta recomendada para la población pertinente. Para la población mayor de cuatro años se usará la Dosis Diaria de Referencia (DDR), en energía, proteínas, vitaminas y minerales propuesta por el Codex Alimentarius, en el caso de la vitamina E, biotina, ácido pantoténico, cobre y selenio, que no están especificadas en el Codex Alimentarius, se utilizarán los valores propuestos por la Food and Drug Administration (FDA), References Daily Intakes (RDI).
Para lactantes y niños menores de cuatro años, embarazadas y nodrizas se utilizarán como Dosis Diaria de Referencia las respectivas RDI. En el caso del hierro y vitamina A se aceptará, como Dosis Diaria de Referencia durante el embarazo el valor de 30 mg/día para hierro y 800 mcg/día para vitamina A, establecidas en las Directrices Nutricionales del Ministerio de Salud.
La información numérica sobre vitaminas y minerales se expresará en unidades métricas, sistema internacional para 100 g o 100 ml, para una porción de consumo habitual expresada como porcentaje de la Dosis Diaria Recomendada de referencia y por envase si éste contiene sólo una porción. Además, esta información deberá especificarse por porción de consumo habitual en la etiqueta si se indica el número de porciones que contiene el envase.
Artículo 119.- La información nutricional complementaria, que facultativamente se podrá añadir a la declaración de nutrientes, tendrá por objeto facilitar la comprensión del consumidor del valor nutritivo del alimento y ayudarle a interpretar la declaración sobre él o los nutrientes. INCISO DEROGADODTO 238, SALUD
Art. 1°, N° 3
D.O. 26.05.2000
Art. 1°, N° 3
D.O. 26.05.2000
Artículo 120.- Para destacar las cualidades de cualquier tipo de alimento o producto alimenticio en cuanto Decreto 88, SALUD
Art. 1 Nº 7
D.O. 06.01.2011a contenido energético (energía o calorías), grasa total, grasa saturada, grasa trans, colesterol, azúcar, azúcares, sodio, vitaminas, minerales, proteínas, ácido docosahexaenoico (DHA), ácido eicosapentaenoico (EPA), otros nutrientes y fibra dietética, sólo se permitirá el uso de los descriptores que se indican en el presente Reglamento.
Art. 1 Nº 7
D.O. 06.01.2011a contenido energético (energía o calorías), grasa total, grasa saturada, grasa trans, colesterol, azúcar, azúcares, sodio, vitaminas, minerales, proteínas, ácido docosahexaenoico (DHA), ácido eicosapentaenoico (EPA), otros nutrientes y fibra dietética, sólo se permitirá el uso de los descriptores que se indican en el presente Reglamento.
El uso de un descriptor deberá ser seguido del nombre del respectivo nutriente, factor alimentario o de la palabra calorías o energía, según corresponda.
Se permite el uso de palabras en otro idioma o palabras de fantasía, que se asocien inequívocamente con características nutricionales, tales como light, diet, high, lite, low, delgadíssimo, flakin y soft, entre otras, siempre que cumplan con los parámetros de alguno de los descriptores autorizados en el presente Reglamento.
Cuando se usen palabras en otro idioma o palabras de fantasía asociadas con alguna característica nutricional, la superficie ocupada por el descriptor en la rotulación, deberá corresponder como mínimo al 33% de la superficie ocupada por la palabra en otro idioma o de fantasía de mayor tamaño y deberá ubicarse, al menos una vez, en la cara principal del envase, junto a la palabra en otro idioma o palabra de fantasía. Si la relación de superficie es mayor o igual a 50%, entonces el descriptor podrá ubicarse en cualquier cara.
A los efectos de aplicación de este artículo, para el cálculo de los respectivos porcentajes, deberá considerarse como superficie de referencia, la palabra en otro idioma y/o palabra de fantasía, de mayor tamaño, y deberá mantenerse siempre la condición de legibilidad de todos los descriptores presentes en el etiquetado del producto.
El descriptor reducido y sus sinónimos, no podrán usarse si el alimento cumple el requisito para ser descrito como bajo aporte. El descriptor bajo aporte no podrá utilizarse para destacar el contenido de azúcar o azúcares de un alimento.
En la declaración de propiedades nutricionales de los alimentos no se podrán usar dos descriptores simultáneamente para describir una misma propiedad.
Los descriptores: libre, bajo aporte, reducido y liviano en colesterol sólo podrán aplicarse a alimentos que sean libres de grasa trans (máximo 0,2 g de ácidos grasos trans por porción de consumo habitual) y que contengan por porción de consumo habitual máximo 2 g de grasa saturada.
Los alimentos que usen los descriptores que a continuación se indican, deberán ceñirse a lo establecido en el artículo 113 de este reglamento:
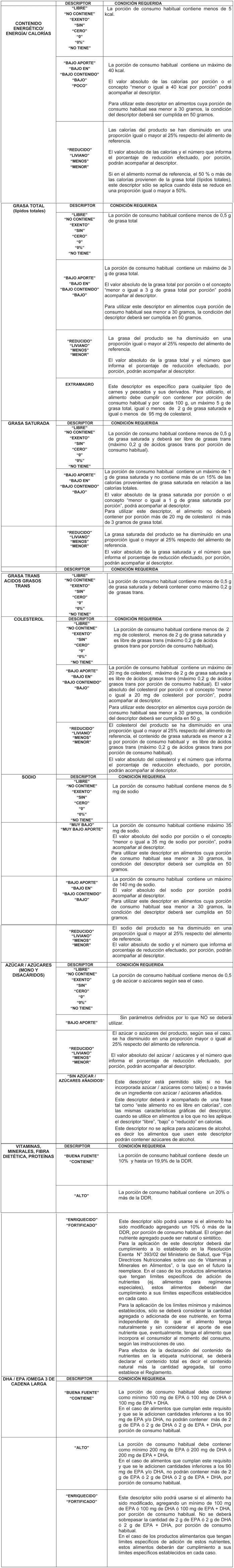
NOTA
El artículo 1 del Decreto 1, Salud, publicado el 13.07.2018 dispone reemplazar en el cuadro inserto en el presente artículo las secciones que establecen los descriptores nutricionales para "Vitaminas, Minerales, Fibra Dietética, Proteínas" y para "DHA / EPA / Omega 3 de Cadena Larga", junto con las condiciones requeridas para declarar tales descriptores, de la manera que la citada norma indica.
El artículo 1 del Decreto 1, Salud, publicado el 13.07.2018 dispone reemplazar en el cuadro inserto en el presente artículo las secciones que establecen los descriptores nutricionales para "Vitaminas, Minerales, Fibra Dietética, Proteínas" y para "DHA / EPA / Omega 3 de Cadena Larga", junto con las condiciones requeridas para declarar tales descriptores, de la manera que la citada norma indica.
"Artículo 120 bis: Cuando a un alimento o producto alimenticio se le haya adicionado sodio, azúcares o grasas saturadas, y su contenido supere el valor establecido en la Tabla Nº 1 del presente artículo, deberá rotular la o las características nutricionales relativas al nutriente adicionado. En el caso de la energía, se deberá rotular su contenido cuando se le haya adicionado azúcares, miel, jarabes, o grasas saturadas, y se supere el valor establecido en la referida tabla.
Tabla Nº1: Límites de contenido de energía, sodio, azúcares totales y grasas saturadas en alimentos.
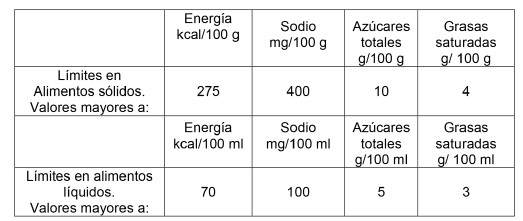 .
. Se exceptuarán de la obligación de rotulación, indicada en el inciso primero del presente artículo, los siguientes alimentos o productos alimenticios:
A. Los alimentos o las mezclas de éstos, a los que no se les haya añadido azúcares, miel, jarabes, sodio o grasas saturadas.
B. Los alimentos que se comercialicen a granel, los porcionados, los fraccionados y los preparados a solicitud del público, aunque éstos se envasen al momento de la venta.
C. Los siguientes alimentos del Título XXVIII, "De los Alimentos para Regímenes Especiales":
c.1 Párrafo II de las fórmulas para lactantes.
c.2 Párrafo III de las preparaciones comerciales de alimentos infantiles
(colados y picados), salvo aquellas que tengan adición de azúcares.
c.3 Párrafo IV de los alimentos para uso infantil procesados a base de
cereales, salvo aquellos que tengan adición de azúcares.
c.4 Párrafo V de los alimentos para uso médico o medicinal.
c.5 Párrafo VII de los alimentos para regímenes de control de peso.
D. Los siguientes alimentos del Título XXIX, "De los Suplementos Alimentarios y de los Alimentos para Deportistas":
d.1 Párrafo I, de los suplementos alimentarios.
d.2 En el Párrafo II, de los alimentos para deportistas, aquellos que
cumplan con los requisitos descritos en las letras a), b), c) y d)
del artículo 540.
E. Los edulcorantes de mesa libres de azúcar y calorías, regulados en el artículo 146 del presente reglamento.
Para los efectos de este artículo, se entenderá que un alimento es sólido o líquido según la unidad de medida utilizada en la declaración del contenido neto del alimento, es decir, será sólido si su contenido neto está expresado en gramos u otra medida equivalente, o líquido si su contenido neto está expresado en mililitros u otra medida equivalente. En el caso de los productos alimenticios que se consuman reconstituidos, se entenderá como sólido o líquido, según como sea el producto listo para consumir, de acuerdo a las instrucciones de reconstitución.
La forma de destacar las características nutricionales indicadas en el inciso primero de este artículo será rotulando un símbolo octagonal de fondo color negro y borde blanco, y en su interior el texto "ALTO EN", seguido de: "GRASAS SATURADAS", "SODIO", "AZÚCARES" o "CALORÍAS", en uno o más símbolos independientes, según corresponda. Las letras del texto deberán ser mayúsculas y de color blanco. Además, en el mismo símbolo, deberá inscribirse en letras blancas, la frase "Ministerio de Salud", según el diagrama Nº 1 del presente artículo.
El o los símbolos referidos se ubicarán en la cara principal de la etiqueta de los productos.
Las dimensiones del o los símbolos referidos estarán determinadas de acuerdo al área de la cara principal de la etiqueta, según el cuadro siguiente:
Cuadro Nº1: Dimensiones de símbolo.
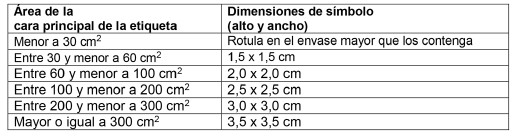 .
. En el caso de los envases cuya área de la cara principal de la etiqueta sea entre 30 cm² y menor a 60 cm², podrán rotularse el o los símbolos en otra cara visible del envase.
Cuando corresponda rotular más de un símbolo con el descriptor "ALTO EN", éstos deberán estar dispuestos uno junto al otro. El o los símbolos deberán rotularse de modo visible, indeleble y fácil de leer en circunstancias normales de compra y uso. En ningún caso, podrán ser cubiertos total o parcialmente.
Se exceptuarán de rotular el o los símbolos con el descriptor "ALTO EN" los alimentos envasados cuya área de la cara principal de la etiqueta sea menor a 30 cm², en cuyo caso este o estos símbolos deberán rotularse en el envase mayor que los contenga.
Cuando un alimento rotule el descriptor "ALTO EN", no podrá declarar, en su rótulo o en su publicidad, las propiedades nutricionales descritas en el artículo 120 del presente reglamento, cuando se trate del mismo nutriente o energía.
Cuando la información especificada en este artículo no haya sido considerada en el diseño de la gráfica original de la rotulación, se permitirá adherirla en la etiqueta o envase, de modo indeleble, y de acuerdo al tamaño, ubicación y demás características establecidas en este reglamento.
 .
. Artículo 121.- En envases cuya superficie mayor sea inferior a 10 cm2, podrá omitirse el número de lote, lista de ingredientes e instrucciones para elDTO 58, SALUD
Art. 1º Nº 4 a)
D.O. 16.06.2007
DTO 58, SALUD
Art. 1º Nº 4 b)
D.O. 16.06.2007 uso, datos que deberán colocarse en el envase mayor que los contenga.
Art. 1º Nº 4 a)
D.O. 16.06.2007
DTO 58, SALUD
Art. 1º Nº 4 b)
D.O. 16.06.2007 uso, datos que deberán colocarse en el envase mayor que los contenga.
Se exceptuarán de dar cumplimiento a lo establecido en el artículo 115 del presente reglamento, los alimentos envasados cuya superficie mayor (cara principal) sea inferior a 40 cm2, en cuyo caso la información deberá colocarse en el envase mayor que los contenga.
Párrafo III
De los envases y utensilios
Artículo 122.- Para los efectos de este reglamento se entiende por:
a) aparatos: los elementos mecánicos o equipos utilizables en la laboración, envasado, conservación y distribución de los alimentos;
b) embalajes: los materiales y estructuras que protegen a los alimentos, envasados o no, contra golpes o cualquier otro daño físico durante su almacenamiento y transporte;
c) envase: cualquier recipiente que contengaDTO 58, SALUD
Art. 1º Nº 5
D.O. 16.06.2007 alimentos, que los cubra total o parcialmente; d) envolturas: los materiales que protegen a los alimentos en su empaquetado permanente o en el momento de venta al público;
Art. 1º Nº 5
D.O. 16.06.2007 alimentos, que los cubra total o parcialmente; d) envolturas: los materiales que protegen a los alimentos en su empaquetado permanente o en el momento de venta al público;
e) equipo: al conjunto de maquinarias e instalaciones que se precisen en la producción, elaboración , fraccionamiento, envasado y expendio de alimentos;
f) recipientes: a los receptáculos destinados a contener por lapsos variables, materias primas, productos intermedios o alimentos en la industria y establecimientos de alimentos;
g) revestimiento: las cubiertas que íntimamente unidas a los utensilios, recipientes, envases, embalajes, envolturas y aparatos referidos en este artículo, los protegen y conservan durante su vida útil.
h) utensilios: a los elementos de uso manual y corriente en la industria alimentaria y establecimientos de alimentos así como los enseres de cocina y la vajilla, cubiertos y cristalería de uso doméstico;
Artículo 123.- Los utensilios, recipientes, envases, embalajes, envoltorios y aparatos destinados a la elaboración, conservación, fraccionamiento y distribución de los alimentos, deberán estar construidos o revestidos con materiales resistentes al producto y no cederán sustancias tóxicas, contaminantes o modificadoras de los caracteres organolépticos o nutricionales de dichos productos.
Artículo 124.- El equipo y los utensilios empleados para materias no comestibles o desechos deberán identificarse, respecto a su utilización y no deberán emplearse para productos comestibles.
Artículo 125.- Los metales en contacto con los alimentos y sus materias primas no deberán contener más de uno por ciento de impurezas constituidas por plomo, antimonio, zinc, cobre, cromo, hierro, estaño considerados en conjunto, ni más de 0,01 por ciento de arsénico, ni otros contaminantes constituidos por metales o metaloides que puedan considerarse nocivos. Asimismo, los utensilios, recipientes, envases y aparatos fabricados con metales, no deberán ceder las sustancias antes señaladas en cantidades superiores a las indicadas.
Artículo 126.- Todos los utensilios, recipientes, envases, embalajes, envolturas, laminados, películas, barnices, partes de aparatos, cañerías y accesorios de material plástico que se hallen en contacto con alimentos y sus materias primas, no deben contener como monómeros residuales más de 0,25 % de estireno, 1 ppm de cloruro de vinilo y 11 ppm de acrilonitrilo. Asimismo todos los objetos de materias plásticas no deben ceder a los alimentos más de 0,05 ppm de cloruro de vinilo o de acrilonitrilo, y ninguna otra sustancia utilizada en la fabricación de materias plásticas que puedan ser nocivas para la salud.
Artículo 127.- El aire de los envases se podrá reemplazar por un gas inerte tal como nitrógeno, bióxido de carbono u otros permitidos por la autoridad sanitaria.
Artículo 128.- Se permite el empleo de envases de retorno siempre que sea posible efectuar una correcta higienización de los mismos antes de usarlos nuevamente. La limpieza de dichos envases debe ser completa, debiendo éstos desecharse cuando, debido a su uso o por cualquier otra causa, se hallen alterados.
En el caso de los alimentos que se comercializanDTO 47, SALUD
Art. 1º Nº 1
D.O. 15.05.2008 en envases retornables, la información sanitaria y nutricional que vaya escrita, impresa, estarcida, marcada en relieve o hueco grabada, cuando el rótulo o etiqueta forme parte del envase, se hará exigible a partir de la fecha de fabricación del envase sólo cuando esta fecha sea posterior a la fecha de entrada en vigencia del decreto modificatorio correspondiente.
Art. 1º Nº 1
D.O. 15.05.2008 en envases retornables, la información sanitaria y nutricional que vaya escrita, impresa, estarcida, marcada en relieve o hueco grabada, cuando el rótulo o etiqueta forme parte del envase, se hará exigible a partir de la fecha de fabricación del envase sólo cuando esta fecha sea posterior a la fecha de entrada en vigencia del decreto modificatorio correspondiente.
En los envases retornables se deberá registrar de manera indeleble la fecha de fabricación del envase. El mes de fabricación se indicará, según corresponda mediantes letras de la A a la L y el año mediante los dos últimos dígitos.
NOTA:
El Art. 2º del DTO 47, Salud, publicado el 15.05.2008, dispuso que la modificación que introduce al presente artículo rige a contar del 06 de mayo de 2008.
El Art. 2º del DTO 47, Salud, publicado el 15.05.2008, dispuso que la modificación que introduce al presente artículo rige a contar del 06 de mayo de 2008.
Artículo 129.- Se prohíbe utilizar para contener sustancias alimenticias y sus correspondientes materias primas, recipientes que en su origen o en alguna oportunidad hayan estado en contacto con productos no alimenticios o incompatibles con los mismos. Asimismo, se prohíbe envasar productos industriales en recipientes de productos alimenticios.
TITULO III
De los aditivos alimentarios
Párrafo I
Disposiciones generales
Artículo 130.- Se considera aditivo alimentarioDTO 475, SALUD
Art. Unico, N° 29
D.O 13.01.2000 cualquier sustancia que no se consume normalmente como alimento por sí misma ni se usa como ingrediente típico del alimento, tenga o no valor nutritivo, cuya adición intencional al alimento para un fin tecnológico (inclusive organoléptico) en la fabricación, elaboración, tratamiento, envasado, empaquetado, transporte o almacenamiento provoque o pueda esperarse razonablemente que provoque (directa o indirectamente), el que ella misma o sus subproductos lleguen a ser un complemento del alimento o afecten a sus características.
Art. Unico, N° 29
D.O 13.01.2000 cualquier sustancia que no se consume normalmente como alimento por sí misma ni se usa como ingrediente típico del alimento, tenga o no valor nutritivo, cuya adición intencional al alimento para un fin tecnológico (inclusive organoléptico) en la fabricación, elaboración, tratamiento, envasado, empaquetado, transporte o almacenamiento provoque o pueda esperarse razonablemente que provoque (directa o indirectamente), el que ella misma o sus subproductos lleguen a ser un complemento del alimento o afecten a sus características.
Artículo 131.- Se considera coadyuvante todaDTO 475, SALUD
Art. Unico, N° 30
D.O. 13.01.2000 sustancia o materia, excluidos aparatos y utensilios, que no se consume como ingrediente alimenticio por sí misma y que se emplea intencionalmente en la elaboración de materias primas, alimentos o sus ingredientes, para lograr alguna finalidad tecnológica durante el tratamiento o la elaboración pudiendo dar lugar a la presencia no intencionada, pero inevitable, de residuos o derivados inocuos en el producto final.
Art. Unico, N° 30
D.O. 13.01.2000 sustancia o materia, excluidos aparatos y utensilios, que no se consume como ingrediente alimenticio por sí misma y que se emplea intencionalmente en la elaboración de materias primas, alimentos o sus ingredientes, para lograr alguna finalidad tecnológica durante el tratamiento o la elaboración pudiendo dar lugar a la presencia no intencionada, pero inevitable, de residuos o derivados inocuos en el producto final.
Artículo 132.- Para los efectos del presente reglamento se consideran aditivos alimentarios permitidos, aquellos cuyo carácter inocuo ha sido evaluado toxicológicamente, considerando especialmente los efectos carcinogénicos, mutagénicos y teratogénicos, en diferentes especies de animales como asimismo en estudios bioquímicos y metabólicos.
Se prohíbe la adición a alimentos de sustancias con principios terapéuticamente activos o sustancias calificadas como productos farmacéuticos.
Artículo 133.- Sólo se permite la incorporación de un aditivo a un alimento si:
a) cumple con un fin tecnológico, tanto en la producción, elaboración, preparación, acondicionamiento, envasado, transporte o almacenamiento de un alimento;
b) contribuye a mantener la calidad nutritiva del alimento, previniendo la destrucción de componentes valiosos del mismo;
c) permite mejorar sus características organolépticas.
Artículo 134.- Se prohíbe el uso de un aditivo, en caso que:
a) disminuya sensiblemente el valor nutritivo del alimento al substituir un ingrediente importante o al posibilitar pérdidas de componentes nutritivos valiosos, salvo cuando se trate de alimentos para regímenes especiales;
b) permita disimular una calidad defectuosa o la aplicación de técnicas de elaboración o manipulación no permitidas;
c) induzca a engaño al consumidor sobre la cantidad o naturaleza del alimento, o al contralor, por contribuir a falsear los resultados del análisis.
Artículo 135.- Todos los aditivos deberán cumplir las normas de identidad, de pureza y de evaluación de su toxicidad de acuerdo a las indicaciones del Codex Alimentarius de FAO/OMS. Debe ser factible su evaluación cualitativa y cuantitativa y su metodología analítica debe ser suministrada por el fabricante, importador o distribuidor.
Decreto 106, SALUD
Art. 1 Nº 1
D.O. 23.04.2009 Artículo 136.- Los aditivos deberán declararse obligatoriamente en la rotulación, en orden decreciente de proporciones, y en cualquiera de estas formas: a) con su nombre específico según el Codex Alimentarius; b) con el sinónimo correspondiente consignado en el presente reglamento, o c) con el nombre genérico de la familia a la cual pertenecen expresado en este Párrafo de los aditivos alimentarios, en singular o plural, según sea el caso. Se exceptúa de esta obligación a los saborizantes/aromatizantes, los que pueden declararse en forma genérica sin detallar sus componentes, según la clasificación que les corresponda de acuerdo con el Artículo 155 de este reglamento.
Art. 1 Nº 1
D.O. 23.04.2009 Artículo 136.- Los aditivos deberán declararse obligatoriamente en la rotulación, en orden decreciente de proporciones, y en cualquiera de estas formas: a) con su nombre específico según el Codex Alimentarius; b) con el sinónimo correspondiente consignado en el presente reglamento, o c) con el nombre genérico de la familia a la cual pertenecen expresado en este Párrafo de los aditivos alimentarios, en singular o plural, según sea el caso. Se exceptúa de esta obligación a los saborizantes/aromatizantes, los que pueden declararse en forma genérica sin detallar sus componentes, según la clasificación que les corresponda de acuerdo con el Artículo 155 de este reglamento.
Aquellos aditivos que requieran ser colocados bajo rotulación destacada, deben hacerlo con su nombre específico, letras en negrilla y de un tamaño mayor al resto de la lista de ingredientes y aditivos.
Artículo 137.- Los aditivos sólo pueden ser agregados dentro de los límites establecidos en el Párrafo II de este Título y de los límites específicosDTO 68, SALUD
Art. primero Nº 8
D.O. 23.01.2006 que para cada alimento se establecen expresamente en este reglamento o de acuerdo a las Buenas Prácticas de Fabricación, (B.P.F.), que en dicho párrafo se señalan.
Art. primero Nº 8
D.O. 23.01.2006 que para cada alimento se establecen expresamente en este reglamento o de acuerdo a las Buenas Prácticas de Fabricación, (B.P.F.), que en dicho párrafo se señalan.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 138.- En los casos en que se incorporen en un alimento dos o más aditivos con una misma función, a los cuales se les haya asignado concentraciones máximas, la suma de las concentraciones empleadas, no podrá ser superior a la concentración máxima autorizada para aquel aditivo al cual se le ha fijado la concentración másDTO 475, SALUD
Art. Unico, N° 32
D.O. 13.01.2000 alta, respetando las máximas individuales de cada uno de los aditivos empleados.
Art. Unico, N° 32
D.O. 13.01.2000 alta, respetando las máximas individuales de cada uno de los aditivos empleados.
Artículo 139.- Si un aditivo alimentario cumple más de una función tecnológica y aparece clasificado sólo en una de ellas, se entiende como autorizado para las otras funciones dentro de los límites indicados en el artículo correspondiente.
Párrafo II
Del uso de los Aditivos
Artículo 140.- Se permite usar como reguladores deDTO 475, SALUD
Art. Unico, N° 33
D.O. 13.01.2000 acidez, sólo aquellos que se indican en este artículo, de acuerdo con las Buenas Prácticas de Fabricación:
Art. Unico, N° 33
D.O. 13.01.2000 acidez, sólo aquellos que se indican en este artículo, de acuerdo con las Buenas Prácticas de Fabricación:
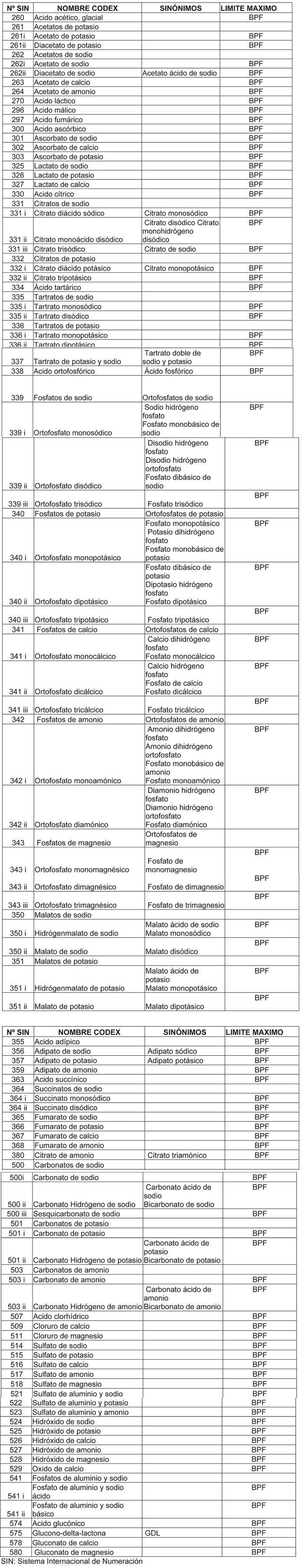
Artículo 141.- Se permite usar como sustancias antiaglomerantes y antihumectantes sólo aquellas que se indican en este artículo y en concentraciones no mayores, Decreto 106, SALUD
Art. 1 Nº 3
D.O. 23.04.2009en producto terminado listo para el consumo, que las que se señalan en forma específica para cada aditivo:
Art. 1 Nº 3
D.O. 23.04.2009en producto terminado listo para el consumo, que las que se señalan en forma específica para cada aditivo:
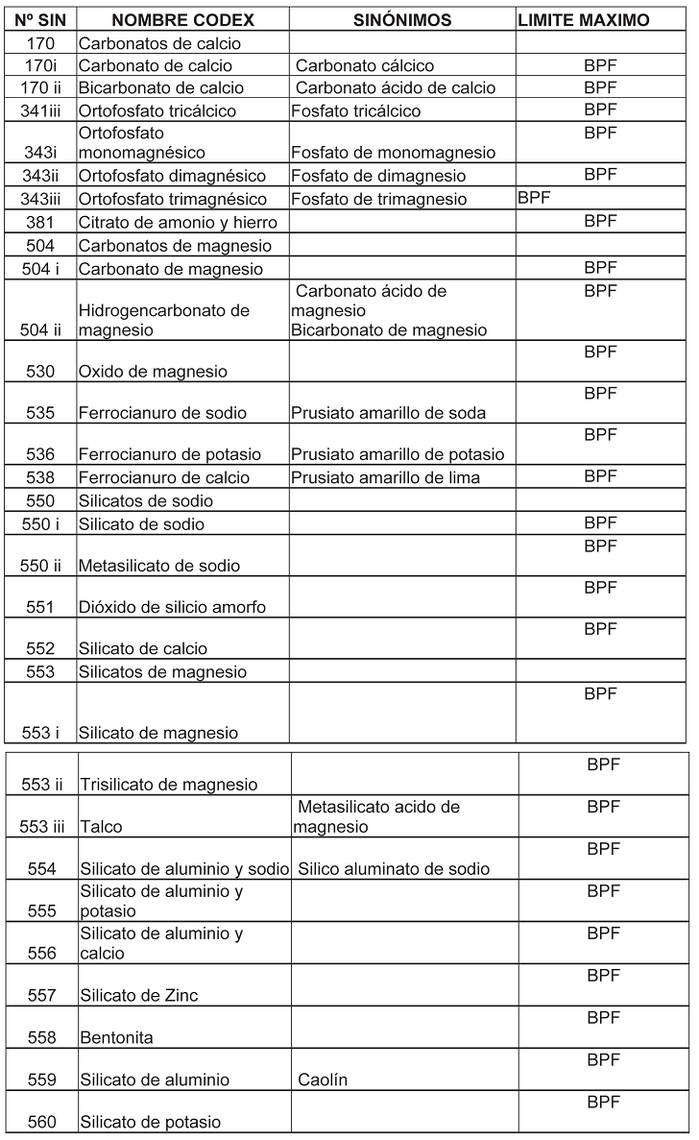
Artículo 142.- Se permite usar como sustancias antiespumantes y espumantes sólo aquellas que se indican en este artículo y en concentraciones no mayores, en producto terminado listo para el consumo, que las que se señalan en forma específica para cada aditivo:
a) antiespumanDecreto 106, SALUD
Art. 1 Nº 4
D.O. 23.04.2009tes
Art. 1 Nº 4
D.O. 23.04.2009tes

b) espumantesDecreto 106, SALUD
Art. 1 Nº 4
D.O. 23.04.2009
Art. 1 Nº 4
D.O. 23.04.2009
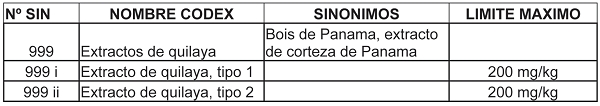
Artículo 143.- Se permite usar como susDecreto 71, SALUD
Art. 1º Nº 1
D.O. 23.08.2010tancias antioxidantes sólo aquellas que se indican en este artículo y en concentraciones no mayores a las que se señalan en forma específica para cada aditivo. Los límites de los antioxidantes señalados en la letra a) del presente artículo están expresados en base a materia grasa pura y en la letra b) se listan los antioxidantes para otros productos.
Art. 1º Nº 1
D.O. 23.08.2010tancias antioxidantes sólo aquellas que se indican en este artículo y en concentraciones no mayores a las que se señalan en forma específica para cada aditivo. Los límites de los antioxidantes señalados en la letra a) del presente artículo están expresados en base a materia grasa pura y en la letra b) se listan los antioxidantes para otros productos.
a) Antioxidantes para matDecreto 106, SALUD
Art. 1 Nº 5
D.O. 23.04.2009erias grasas
Art. 1 Nº 5
D.O. 23.04.2009erias grasas
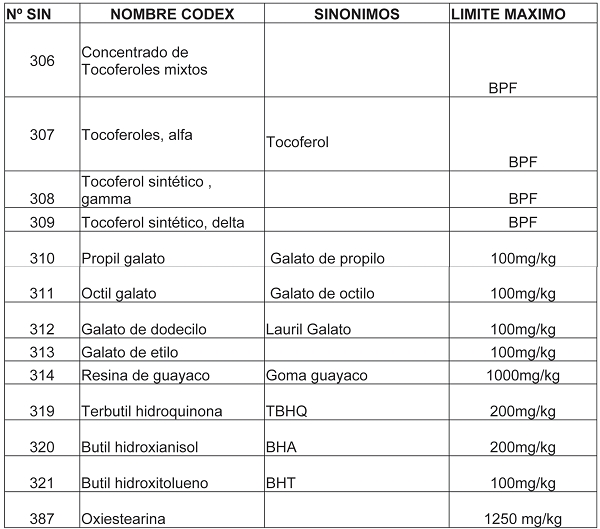
b) Antioxidantes para otros productos
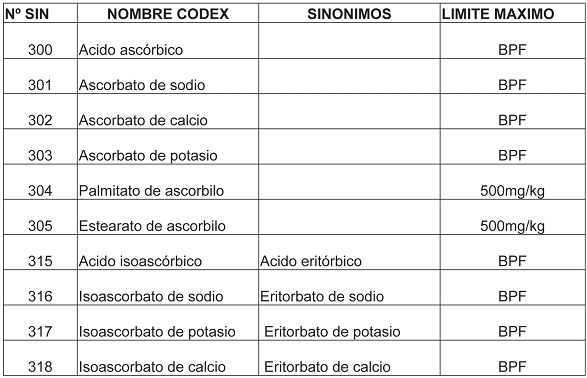
NOTA
El Nº 2 del Art. 1º del Decreto 71, Salud, publicado el 23.08.2010, con vigencia a contar de 24 meses después de su publicación, modificó el cuadro de la letra a) en el sentido de agregar los siguientes aditivos, Nºs. 304 y 305:
N° NOMBRE LIMITE
SIN CODEX SINONIMOS MAXIMO
304 Palmitato Vitamina C
de ascorbilo palmitato 500 mg/kg
305 Estearato Vitamina C
de ascorbilo estearato 500 mg/kg
El Nº 2 del Art. 1º del Decreto 71, Salud, publicado el 23.08.2010, con vigencia a contar de 24 meses después de su publicación, modificó el cuadro de la letra a) en el sentido de agregar los siguientes aditivos, Nºs. 304 y 305:
N° NOMBRE LIMITE
SIN CODEX SINONIMOS MAXIMO
304 Palmitato Vitamina C
de ascorbilo palmitato 500 mg/kg
305 Estearato Vitamina C
de ascorbilo estearato 500 mg/kg
Artículo 144.- Se permite usar como sustancias secuestrantes y sinergistas de antioxidantes sólo aquellas que se indican en este artículo y en concentraciones no mayores, a las que se señalan en forma especifica para cada aditivo:
a) Sinergistas de antioxidaDecreto 106, SALUD
Art. 1 Nº 6
D.O. 23.04.2009ntes
Art. 1 Nº 6
D.O. 23.04.2009ntes
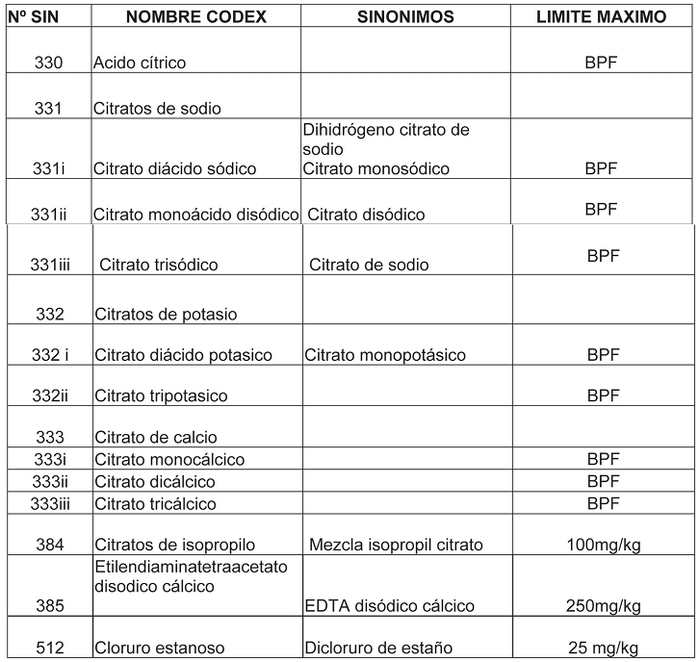
b) Secuestrantes

Artículo 145.- Se permite usar como sustanciasDTO 475, SALUD
Art. Unico, N° 34
D.O. 13.01.2000 colorantes sólo las que se señalan en el presente artículo.
Art. Unico, N° 34
D.O. 13.01.2000 colorantes sólo las que se señalan en el presente artículo.
Para los efectos de rotulación se deberá emplear el nombre, sDecreto 106, SALUD
Art. 1 Nº 7
D.O. 23.04.2009egún el Codex Alimentarius, señalado en la siguiente lista:
Art. 1 Nº 7
D.O. 23.04.2009egún el Codex Alimentarius, señalado en la siguiente lista:
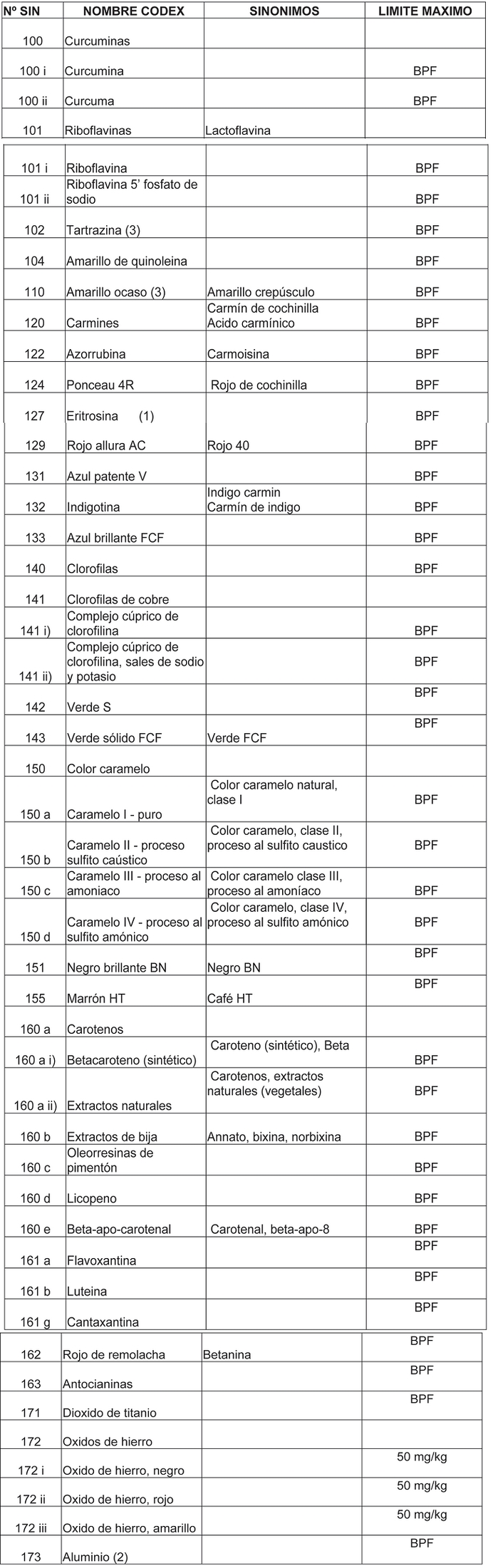
(1) Sólo en conservas de cerezas, macedonia de frutas y marrasquino
(2) Sólo para decoraciones
(3) Rotular en forma destacada de acuerdo al Art. 136
Artículo 146.- Sólo se permite usar los edulcoDecreto 71, SALUD
Art. 1º Nº 3
D.O. 23.08.2010rantes no nutritivos en uno o más de los siguientes alimentos:
Art. 1º Nº 3
D.O. 23.08.2010rantes no nutritivos en uno o más de los siguientes alimentos:
a) Alimentos para regímenes de control de peso.
b) Alimentos libres, bajos o reducidos en azúcar o azúcares (mono y disacáridos).
c) Alimentos libres, bajos o reducidos en calorías.
d) Alimentos libres, bajos o reducidos en grasas.
Los descriptores anteriormente señalados en las letras b), c) y d) se rigen por lo dispuesto en el artículo 120 del presente reglamento.
Los edulcorantes no nutritivos que se pueden utilizar en uno o más de los alimentos antes descritos, son los que se indican a continuación:
En la rotulación de los alimentos que contienen estos producDTO 115, SALUD
Art. primero Nº 12
D.O. 25.11.2003tos deberá indicarse en forma destacada su agregado como aditivo y la cantidad de edulcorante por porción de consumo habitual servida y por cada 100 g o 100 ml del producto listo para el consumo, señalando, además, para cada edulcorante utilizado los valores de ingesta diaria admisible (I.D.A.), en mg/kg de peso corporal, según recomendaciones de FAO/OMS.
Art. primero Nº 12
D.O. 25.11.2003tos deberá indicarse en forma destacada su agregado como aditivo y la cantidad de edulcorante por porción de consumo habitual servida y por cada 100 g o 100 ml del producto listo para el consumo, señalando, además, para cada edulcorante utilizado los valores de ingesta diaria admisible (I.D.A.), en mg/kg de peso corporal, según recomendaciones de FAO/OMS.
Los edulcorantes de mesa, cualquiera sea su forma de presentación, deberán cumplir con la rotulación general y nutricional que establece este reglamento, indicando, además, la concentración por porción de consumo habitual y por cada 100 g o 100 ml y la I.D.A. correspondiente.
Adicionalmente, en caso de empleo de Aspartamo, se deberá indicar en forma destacada en la rotulación: "Fenilcetonúricos; contiene fenilalanina".
Decreto 106, SALUD
Art. 1 Nº 9
D.O. 23.04.2009Ninguna forma de bebidas o refrescos, tanto líquidos como en polvo para preparación, podrán contener más de 250 mg/litro de ácido ciclámico o de sus sales.
Art. 1 Nº 9
D.O. 23.04.2009Ninguna forma de bebidas o refrescos, tanto líquidos como en polvo para preparación, podrán contener más de 250 mg/litro de ácido ciclámico o de sus sales.
NOTA 6
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
Artículo 147.- Se permite usar como sustancias emulsionantes sólo aquellas que se indican en este artículo y en concentraciones no mayores, en producto terminado listo para el consumo, que las que se señalan en forma específica para cada aditivo Decreto 106, SALUD
Art. 1 Nº 10
D.O. 23.04.2009:
Art. 1 Nº 10
D.O. 23.04.2009:
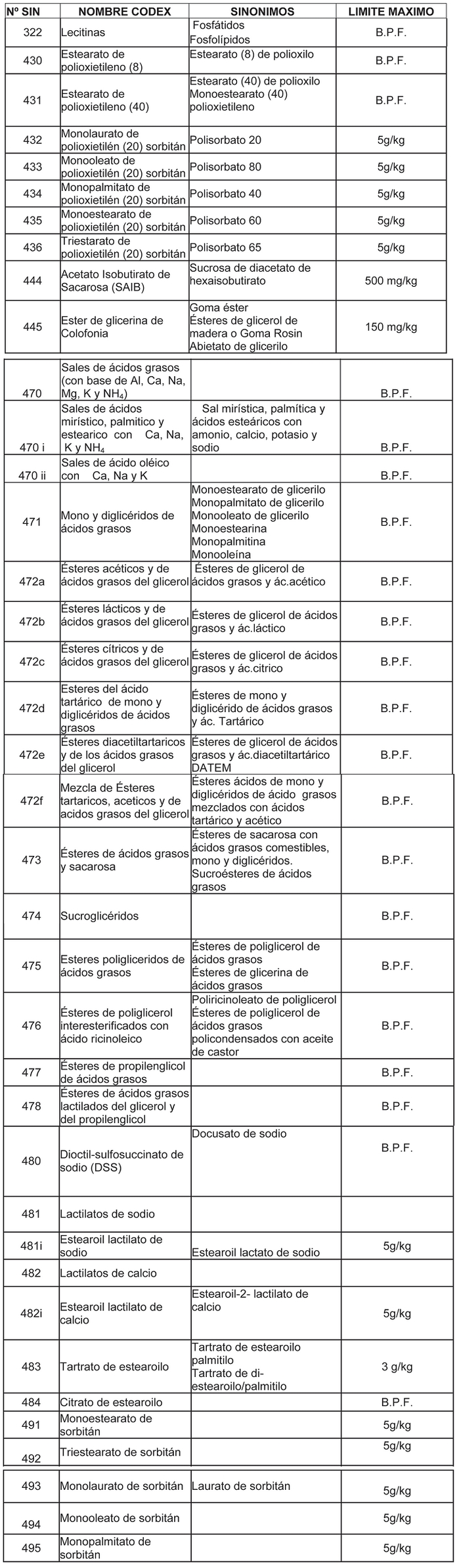
Los emulsionantes en base a las sales de fósforoDTO 475, SALUD
Art. Unico, N° 36
D.O. 13.01.2000 señaladas precedentemente se podrán rotular como fosfato, polifosfatos o mezcla de ambos, según sea el caso.
Art. Unico, N° 36
D.O. 13.01.2000 señaladas precedentemente se podrán rotular como fosfato, polifosfatos o mezcla de ambos, según sea el caso.
NOTA
El Nº 1 del Articulo 1º del Decreto 11, Salud, publicado el 06.08.2013, modificó la presente norma en el sentido de agregar entre los números SIN 436 Y 444 el SIN Nº 442 la sustancia emulsionante Sales de amonio del ácido fosfatídico, de la manera indicada en la citada norma
El Nº 1 del Articulo 1º del Decreto 11, Salud, publicado el 06.08.2013, modificó la presente norma en el sentido de agregar entre los números SIN 436 Y 444 el SIN Nº 442 la sustancia emulsionante Sales de amonio del ácido fosfatídico, de la manera indicada en la citada norma
Decreto 106, SALUD
Art. 1 Nº 11
D.O. 23.04.2009 Artículo 148.- Sólo podrán usarse como sales emulsionantes aquellas que se indican en este artículo y sus concentraciones no podrán ser mayores, en producto terminado listo para el consumo, que las que se señalan en forma específica para cada aditivo en la siguiente tabla:
Art. 1 Nº 11
D.O. 23.04.2009 Artículo 148.- Sólo podrán usarse como sales emulsionantes aquellas que se indican en este artículo y sus concentraciones no podrán ser mayores, en producto terminado listo para el consumo, que las que se señalan en forma específica para cada aditivo en la siguiente tabla:
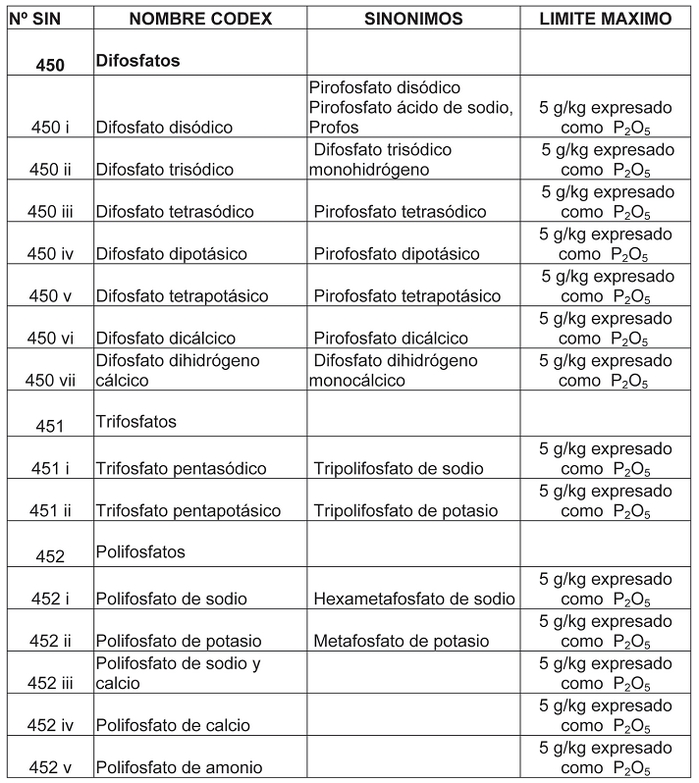
Los emulsionantes fabricados en base a las sales de fósforo señaladas precedentemente se podrán rotular como fosfatos, polifosfatos o mezcla de ambos, según sea el caso.
El límite máximo de fósforo expresado como P2O5, corresponde sólo al agregado como
aditivo, sin considerar el propio de las materias primas utilizadas en la elaboración del alimento.
Para su cálculo se debe restar del fósforo total, el aportado por el alimento.
Decreto 106, SALUD
Art. 1 Nº 12
D.O. 23.04.2009 Artículo 149.- Sólo podrán usarse como aditivos enturbiantes los que se indican en la presente tabla, en concentraciones no mayores a las señaladas:
Art. 1 Nº 12
D.O. 23.04.2009 Artículo 149.- Sólo podrán usarse como aditivos enturbiantes los que se indican en la presente tabla, en concentraciones no mayores a las señaladas:

Decreto 106, SALUD
Art. 1 Nº 13
D.O. 23.04.2009 Artículo 150.- Sólo se podrán usar como sustancias espesantes o estabilizadores, aquellas que se indican en este artículo, de acuerdo con Buenas Prácticas de Fabricación:
Art. 1 Nº 13
D.O. 23.04.2009 Artículo 150.- Sólo se podrán usar como sustancias espesantes o estabilizadores, aquellas que se indican en este artículo, de acuerdo con Buenas Prácticas de Fabricación:
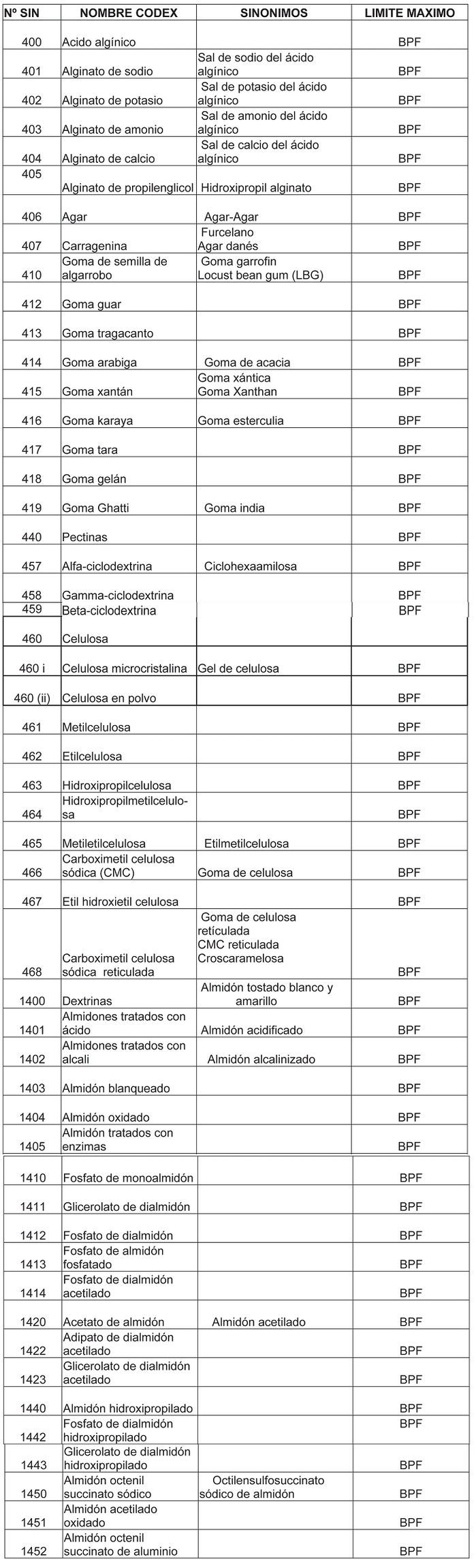
Los almidones indicados en este artículo se podrán rotular en forma genérica como almidones modificados.
NOTA
El numeral 10 del Decreto 68, Salud, publicado el 23.01.2006, modifico los listados de la presente norma, de la manera que la citada norma indica.
El numeral 10 del Decreto 68, Salud, publicado el 23.01.2006, modifico los listados de la presente norma, de la manera que la citada norma indica.
Decreto 106, SALUD
Art. 1 Nº 14
D.O. 23.04.2009 Artículo 151.- Sólo podrán usarse como sustancias estabilizadoras de humedad, agentes de relleno y/o edulcorantes aquellas que se indican en este artículo, de acuerdo con las Buenas Prácticas de Fabricación:
Art. 1 Nº 14
D.O. 23.04.2009 Artículo 151.- Sólo podrán usarse como sustancias estabilizadoras de humedad, agentes de relleno y/o edulcorantes aquellas que se indican en este artículo, de acuerdo con las Buenas Prácticas de Fabricación:
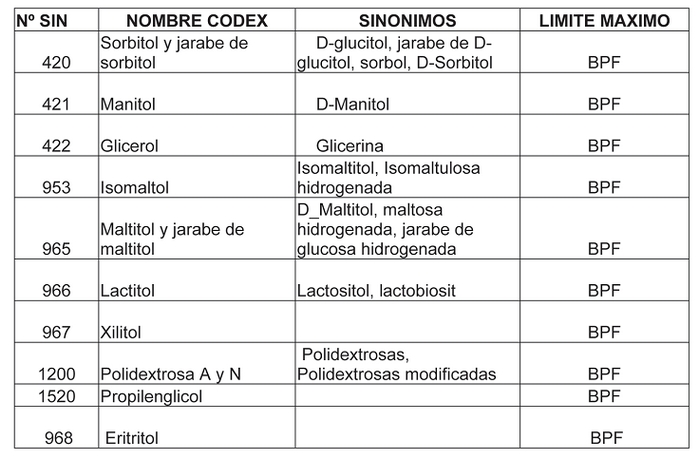
Decreto 106, SALUD
Art. 1 Nº 15
D.O. 23.04.2009 Artículo 152.- Sólo podrán usarse como aditivos impermeabilizantes o sustancias de recubrimiento aquellas que se indican en este artículo y en concentración no mayor que la señalada en forma específica:
Art. 1 Nº 15
D.O. 23.04.2009 Artículo 152.- Sólo podrán usarse como aditivos impermeabilizantes o sustancias de recubrimiento aquellas que se indican en este artículo y en concentración no mayor que la señalada en forma específica:
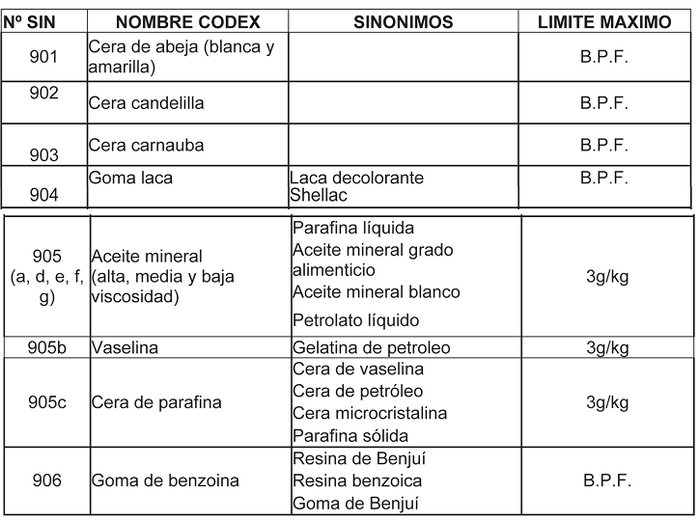
Artículo 153.- Se permite usar como sustancias leudantes, blanqueadoras y mejoradoras de la panificación, sólo aquellas que se indican en este artículo y en concentraciones no mayores que las que se señalan en forma específica para cada aditivo:
a) leudantesDecreto 106, SALUD
Art. 1 Nº 16
D.O. 23.04.2009
Art. 1 Nº 16
D.O. 23.04.2009
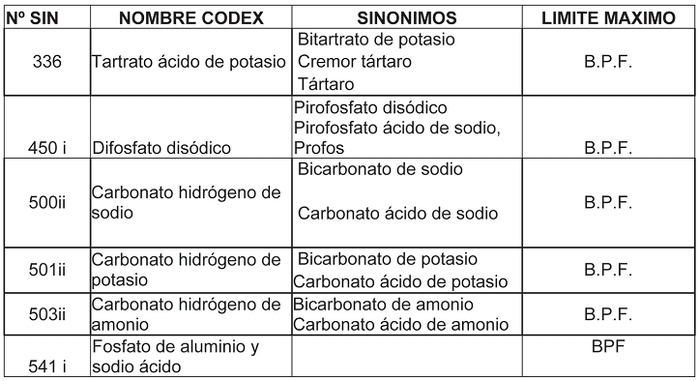
b) Decreto 106, SALUD
Art. 1 Nº 17
D.O. 23.04.2009Blanqueadores o mejoradores de panificación
Art. 1 Nº 17
D.O. 23.04.2009Blanqueadores o mejoradores de panificación
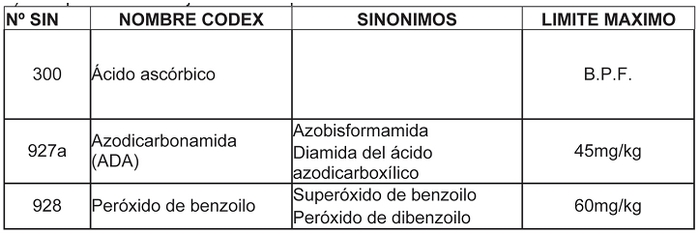
Artículo 154.- Se permite utilizar como preservantes químicos sólo los que se indican en este artículo y en concentraciones no mayores, en productos terminando, que las que se señalan en forma específica para cada aditivo:
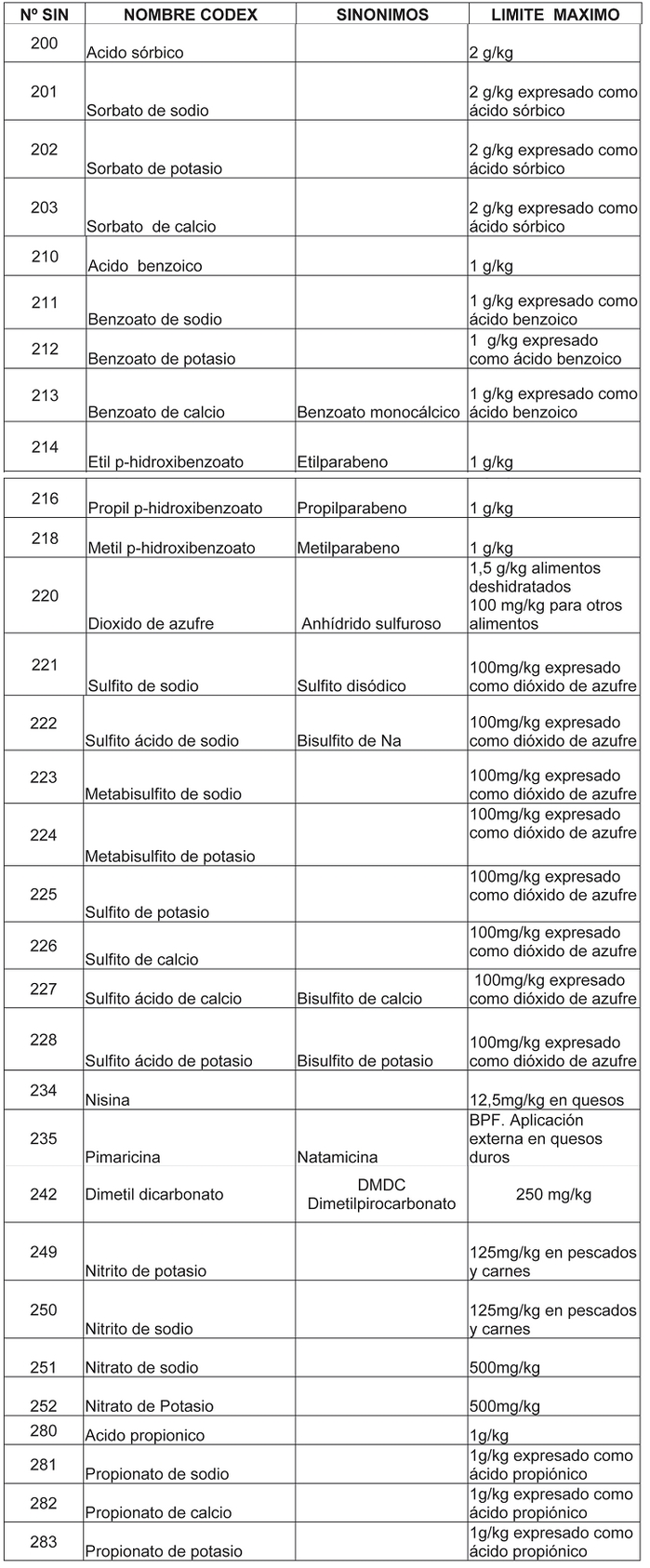
NOTA
El Nº 4 del Art. 1º del Decreto 71, Salud, publicado el 23.08.2010, con vigencia a contar de 24 meses después de su publicación, modificó el Nº 234 del cuadro contenido en el presente artículo, el que queda de la siguiente forma:
N° SIN NOMBRE CODEX SINONIMOS LIMITE MAXIMO
234 Nísina 12,5 mg/kg en quesos
10 mg/kg en crema
natural o nata
cuajada
El Nº 4 del Art. 1º del Decreto 71, Salud, publicado el 23.08.2010, con vigencia a contar de 24 meses después de su publicación, modificó el Nº 234 del cuadro contenido en el presente artículo, el que queda de la siguiente forma:
N° SIN NOMBRE CODEX SINONIMOS LIMITE MAXIMO
234 Nísina 12,5 mg/kg en quesos
10 mg/kg en crema
natural o nata
cuajada
NOTA 1
El Nº 2 del Articulo 1º del Decreto 11, Salud, publicado el 06.08.2013, modificó la presente norma en el sentido de agregar entre los números SIN 242 Y 249 el SIN Nº 243 preservante quimico Etil - lauroil arginato, de la manera indicada en la citada norma.
El Nº 2 del Articulo 1º del Decreto 11, Salud, publicado el 06.08.2013, modificó la presente norma en el sentido de agregar entre los números SIN 242 Y 249 el SIN Nº 243 preservante quimico Etil - lauroil arginato, de la manera indicada en la citada norma.
Artículo 155.- Se permite usar como saborizantes/aroma- tizantes aquellas sustancias aromáticas o mezclas de ellas obtenidas por procesos físicos o químicos de aislamiento o síntesis de tipo natural, idéntico a natural y artificial aceptados por FAO/OMS, Unión Europea, Food and Drug Administration y F.E.M.A.(Flavor and Extractive Manufacturing Assoc.).
Se entenderá por:
saborizante/aromatizante natural: al producto puro de estructura química definida o al preparado saborizante de estructura química no definida, concentrado o no, que tiene características saporíferas y son obtenidos por un proceso físico, microbiológico o enzimático a partir de productos de origen vegetal o animal.
saborizante/aromatizante idéntico a natural: es aquel producto obtenido por procesos físicos, microbiológicos, enzimáticos, de síntesis química o de aislamiento por procesos químicos, cuya formulación incluye componentes idénticos a los existentes en la naturaleza.
saborizante/aromatizante artificial: es aquel producto que en su formulación incluye, en una proporción cualquiera, componentes que no se encuentran naturalmente en productos animales o vegetales y son obtenidos por síntesis química.
Decreto 106, SALUD
Art. 1 Nº 19
D.O. 23.04.2009 Artículo 156.- Podrán usarse disolventes portadores o diluyentes de sustancias saborizantes/aromatizantes y de antioxidantes, siempre que cumplan con las normas establecidas por el Codex Alimentarius FAO/OMS y su concentración esté de acuerdo con las buenas prácticas de fabricación.
Art. 1 Nº 19
D.O. 23.04.2009 Artículo 156.- Podrán usarse disolventes portadores o diluyentes de sustancias saborizantes/aromatizantes y de antioxidantes, siempre que cumplan con las normas establecidas por el Codex Alimentarius FAO/OMS y su concentración esté de acuerdo con las buenas prácticas de fabricación.
Artículo 157.- Se permite usar como acentuantes del sabor sólo los que se indican en este artículo y en concentraciones no mayores, en producto terminado listo para el consumo, que las que se señalan en forma específica para cada aditivoDecreto 106, SALUD
Art. 1 Nº 20
D.O. 23.04.2009:
Art. 1 Nº 20
D.O. 23.04.2009:
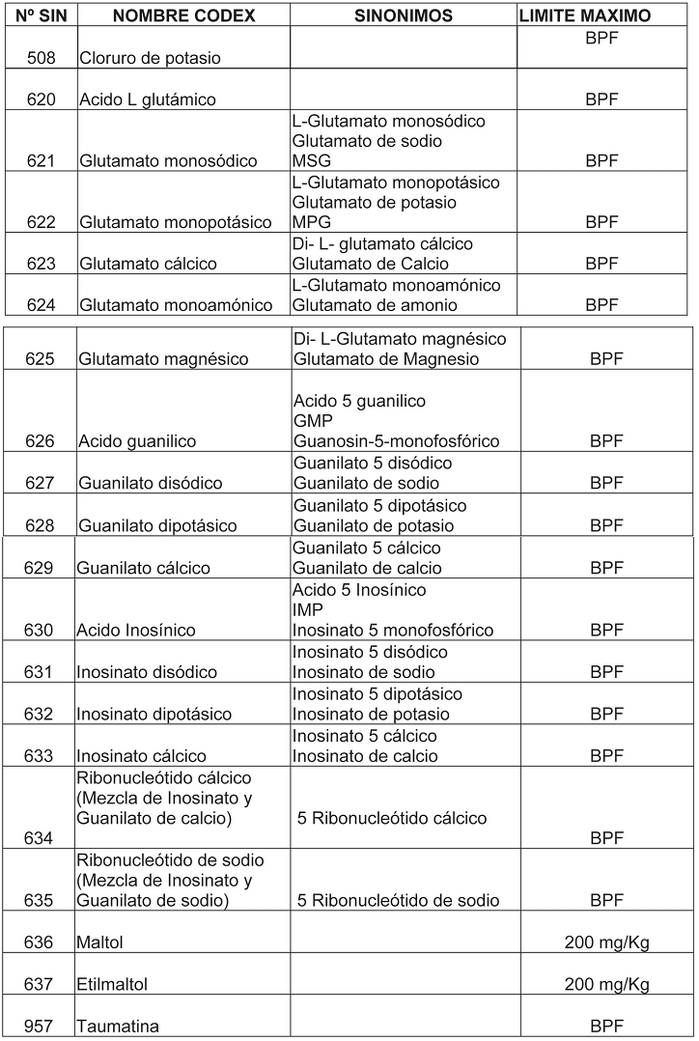
Artículo 158.- Se permite el uso de preparaciones enzimáticas y coadyuvantes de elaboración siempre que cumplan con las normas establecidas por el Codex Alimentarius FAO/OMS y su concentración estará de acuerdo con las buenas prácticas de fabricación.DTO 475, SALUD
Art. Unico, N° 1
D.O. 13.01.2000
Art. Unico, N° 1
D.O. 13.01.2000
Artículo 159.- En el caso que antecedentes sanitarios y técnicos hagan conveniente introducir modificaciones a las listas establecidas en los artículos precedentes de este Título, el Ministerio de Salud propondrá el correspondiente decreto supremo modificatorio al Presidente de la República.
Párrafo I
De los metales pesados
Artículo 160.- Los elementos que se indican a continuación no podrán sobrepasar, en los alimentos señalados, los límites máximos siguientes:
Límite máximoDecreto 7, SALUD
Art. 1 N° 1
D.O. 13.07.2018
Art. 1 N° 1
D.O. 13.07.2018
mg/kg de producto
final
AESENICO
Aceites y grasas 0,1
comestibles
Nota:
No incluye la
mantequilla
Grasas y mezclas 0,1
de grasas para untar
Nota:
No incluye la
mantequilla
Sal 0,5
comestible
Nota:
Ver Párrafo II del
Título XXIII
Aguas minerales y aguas 0,01
envasadas para bebida Nota:
expresado en mg/l
Arroz pulido 0,2
Notas:
Límite para arsénico
Inorgánico
Solo será necesario determinar
Arsénico inorgánico, si la
medición de Arsénico Total
superara este límite.
CADMIODTO 475, SALUD
Art. Unico, N° 41
D.O 13.01.2000
Art. Unico, N° 41
D.O 13.01.2000
Sal comestible 0,5
Agua mineral de mesa 0,01
COBRE
Caseína ácida comestible y caseinatos
comestibles 5,0
Aceites y grasas comestibles 0,1 no virgen
0,4 virgen
Margarina 0,1
Mayonesa 2,0
Azúcar blanca 1,0
Azúcar en polvo, dextrosa (anhidra,
monohidrato, en polvo), lactosa, fructosa 2,0
Jarabe de glucosa 5,0
Jugos de frutas y hortalizas 5,0 (1)
Jugos concentrados de fruta 5,0 (1) en el
producto
reconsti-
tuido
Néctares de fruta 5,0 (1)
Mantecas de cacao 0,4
Chocolates, dulce de manteca de cacao 15,0
Chocolate no edulcorado 30,0
Chocolate compuesto y relleno 20,0
Cacao en polvo y mezclas secas de
cacao y azúcar; torta de prensado
de cacao 50,0
Cacao sin cáscara ni germen;
cacao en pasta 30,0
Emulsiones lácteas para untar,
pobres en grasa 0,1
Suero dulce en polvo y suero
ácido en polvo, de calidad alimentaria 5,0
Caseína de cuajo comestible 2,0
Grasa de mantequilla 0,05
Sal comestible 2,0DTO 475, SALUD
Art. Unico, Nº 41
D.O. 13.01.2000
Art. Unico, Nº 41
D.O. 13.01.2000
Agua mineral de mesa 1,0
Otros productos 10,0
ESTAÑO
Frutas y hortalizas en conserva 250
Aceitunas de mesa 250
Conservas de pescados y mariscos 250
Jugos de frutas y hortalizas,
excepto manzana, uva y grosella negra 200
Jugos de manzana, uva y grosella
negra 150
Jugos concentrados de frutas,
excepto manzana, uva y grosella
negra 250 en el producto
reconstituido.
Jugos concentrados de manzana,
uva y grosella negra 150 en el producto
reconstituido
Néctares de fruta:
damasco, durazno, pera, guayaba
y cítricos 250
grosella negra y frutas pequeñas 150
Carne enlatada, jamón curado cocido,
espaldilla de cerdo curada cocida, carne
picada curada cocida,
en recipientes estañados 200
en otros recipientes 50
HIERRO
Caseína ácida comestible 0,0
Caseinatos comestibles 20,0 en productos
por deshidra-
tados
pulverización
50,0 en
productos
deshidratados
por
cilindros
secadores
Aceites y grasas comestibles 5,0 virgen
1,5 no virgen
Jugos de frutas y hortalizas 15,0 (1)
Jugos concentrados de fruta 15,0 (1) en el
producto
reconsti
tuido
Néctares de fruta 15,0 (1)
Mantecas de cacao 2,0
Grasa de mantequilla 0,2
Emulsiones lácteas para untar,
pobres en grasa 1,5
Suero dulce en polvo y suero ácido
en polvo, de calidad alimentaria 20,0 en productos
deshidratados
por
pulveriza-
ción.
50,0 en productos
deshidrata-
dos por
cilindros
secadores
Caseína de cuajo comestible 5,Decreto 7, SALUD
Art. 1 N° 2
D.O. 13.07.20180
Art. 1 N° 2
D.O. 13.07.20180
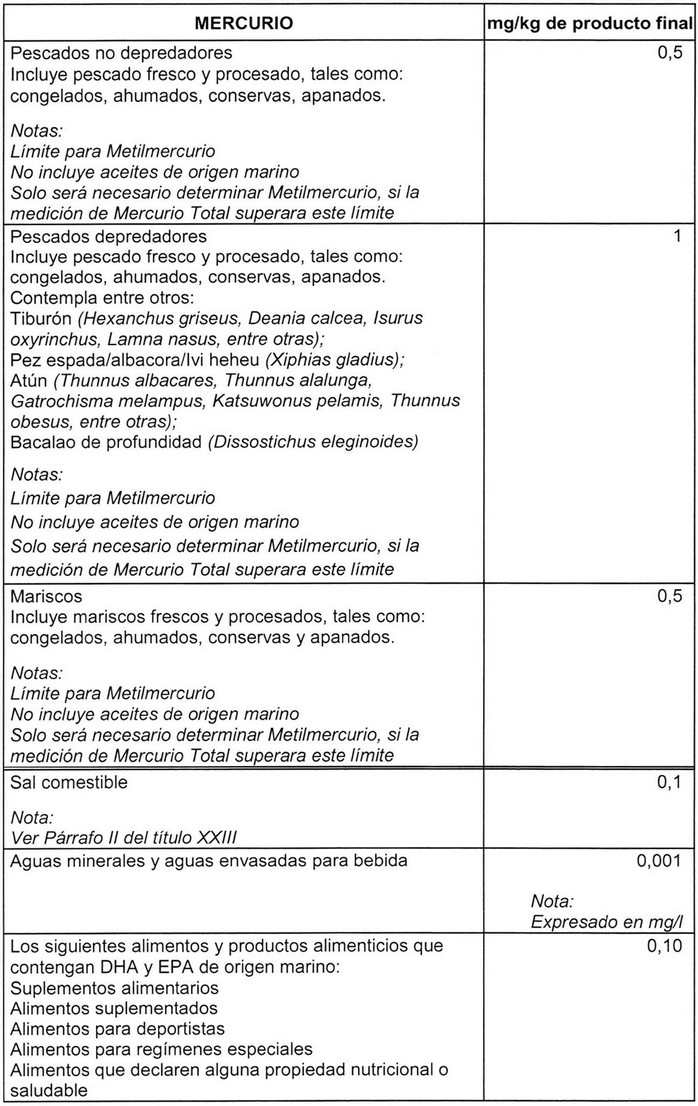 .
.PLOMO
Caseína ácida comestible y
caseinatos comestibles 2,0
Conservas de frutas y hortalizas,
excepto concentrado de tomate 1,0
Concentrado de tomate 1,5
Aceitunas de mesa 1,0
Mantecas de cacao 0,5
Chocolate, chocolate compuesto y relleno 1,0
Chocolate no edulcorado 2,0
Aceites y grasas comestibles 0,1
Mayonesa 0,3
Azúcar blanca 1,0
Azúcar en polvo dextrosa (anhidra,
monohidrato, deshidratada),
jarabe de glucosa, lactosa 2,0
Fructosa 0,5
Caldos y sopas 1,0 en producto
seco
0,5 en producto
enlatado
Cacao en polvo y mezclas secas
de cacao y azúcar; cacao sin
cáscara ni germen; cacao en pasta;
torta de prensado de cacao,
polvillo de cacao (finos de cacao) 2,0
Dulce de manteca de cacao 1,0
Jugos de frutas y hortalizas,
excepto limón 0,3
Jugo de limón 1,0
Jugos concentrados de fruta 0,3 en el
producto
reconsti-
tuido
Néctares de fruta, excepto damasco,
durazno, pera y guayaba 0,2
Néctares de damasco, durazno, pera
y guayaba 0,3
Emulsiones lácteas para untar,
pobres en grasa 0,1
Suero dulce en polvo y suero
ácido en polvo, de calidad alimentaria 2,0
Caseína de cuajo comestible 2,0
Carne enlatada, jamón curado cocido, 0,5
espaldilla de cerdo curada cocida, carne
picada curada cocida
Cereales, legumbres y leguminosas 0,5
Conservas de pescados y mariscos, 2,0
pescados y mariscos frescos, enfriados
y congelados
Sal comestible 2,0DTO 475, SALUD
Art. Unico, Nº 41
D.O. 13.01.2000
Art. Unico, Nº 41
D.O. 13.01.2000
Agua mineral de mesa 0,05
Otros productos 2,0
SELENIO
En productos líquidos 0,05
En productos sólidos 0,30
Agua mineral de mesa 0,01DTO 475, SALUD
Art. Unico, Nº 41
D.O. 13.01.2000
Art. Unico, Nº 41
D.O. 13.01.2000
ZINC
Jugos de frutas y hortalizas 5,0 (1)
Jugos concentrados de fruta 5,0 (1) en el
producto
reconsti-
tuido
Néctares de fruta 5,0 (1)
Agua mineral de mesa 5,0DTO 475, SALUD
Art. Unico, Nº 41
D.O. 13.01.2000
Art. Unico, Nº 41
D.O. 13.01.2000
Otros productos 100,0
(1) Total Zn, Fe y Cu: máximo 20 mg/kg
*Arsénico inorgánico
DTO 475, SALUD
Art. Unico, Nº 41
D.O. 13.01.2000
Art. Unico, Nº 41
D.O. 13.01.2000
Artículo 161.- En el caso de que antecedentes sanitarios y técnicos hagan conveniente introducir modificaciones a las listas establecidas en el artículo precedente, el Ministerio de Salud propondrá el correspondiente decreto supremo modificatorio al Presidente de la República.
Decreto 64, SALUD
Art. 1
D.O. 11.12.2009 Artículo 162.- El Ministerio de Salud mediante la dictación de la correspondiente norma técnica determinará las tolerancias de residuos de plaguicidas permitidos en los alimentos.
Art. 1
D.O. 11.12.2009 Artículo 162.- El Ministerio de Salud mediante la dictación de la correspondiente norma técnica determinará las tolerancias de residuos de plaguicidas permitidos en los alimentos.
DTO 475, SALUD
Art. Unico, Nº 42
D.O. 13.01.2000
Art. Unico, Nº 42
D.O. 13.01.2000
Artículo 163.- Para los fines de este Reglamento se entenderá por:
Becquerel (Bq): unidad de actividad, equivale a una desintegración por segundo de cualquier radionucleido.
Sievert (Sv): unidad de dosis equivalente. Es la dosis absorbida ponderada que equivale a la energía entregada por la radiación por gramo de sustancia irradiada.
Nivel de referencia de dosis (NRD): dosis equivalente anual.
Corresponde a 1mSv/año.
Factor de conversión de dosis (FCD): factor que relaciona la dosis equivalente por unidad de actividad ingerida. Se expresa en Sv/Bq.
Tasa de consumo de alimento (TCA): masa promedio de alimento que se consume anualmente per cápita en el país. Se expresa en kg/año.
Nivel de intervención derivado (NID): concentración de un radionucleido en un alimento dado. Se calcula dividiendo el nivel de referencia de dosis por el factor de conversión de dosis y por la tasa de consumo de alimentos. Se expresa en Bq/kg.
Artículo 164.- El control de los niveles de intervención derivados (NID) deberá efectuarse en aquellos alimentos contaminados por radionucleidos liberados en un accidente nuclear o radiológico y no, a los que se encuentran naturalmente presentes formando parte del fondo radiológico ambiental.
Artículo 165.- Los radionucleidos de interés se clasifican en tres grupos de acuerdo a su radioactividad, cuyos valores de conversión de dosis (FCD) son los siguientes:
FCD FCD
leches y otrosDTO 214, SALUD
Art. primero II Nº3
D.O. 04.02.2006
Art. primero II Nº3
D.O. 04.02.2006
fórmulas alimentos
lácteos
I.- ( a ) Americio (241Am) 10-5 10-6
Plutonio (239Pu)
Otros actínidos
II.- ( ß ) Estroncio (90Sr) 10-7 10-7
Estroncio (89Sr)
Otros emisores beta
III.-( Y ) Yodo (131I) 10-8 10-8DTO 475, SALUD
Art. Unico, Nº 44
D.O. 13.01.2000
Art. Unico, Nº 44
D.O. 13.01.2000
Cesio (134Cs)
Cesio (137Cs)
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Artículo 166.- La contaminación por radionucleidos no sobrepasará los niveles de intervención derivados (NID) por grupos de alimentos que se indican:
Grupo I( ) Grupo II( ß) Grupo III( )
(Bq/kg) (Bq/kg) (Bq/kg)
Grupos de
alimentos
Cereales 6 60 600
Raíces y
tubérculos 20 200 2000
Vegetales 15 150 1500
Frutas 15 150 1500
Carne 30 300 3000
Pescado 35 350 3500
Productos lácteos 10 100 1000
Leches 10 Bq/L 100 Bq/L 1000 Bq/LDTO 214, SALUD
Art. primero II Nº5
D.O. 04.02.2006
Art. primero II Nº5
D.O. 04.02.2006
Fórmulas para
lactantes 1 Bq/L 10 Bq/L 100 Bq/L
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Artículo 167.- Para efectos de cálculo de la contaminación de las leches y fórmulas para lactantes el 131I se considera como perteneciente al grupo II. Los valores de NID tanto para las leches fluidas, leches enDTO 214, SALUD
Art. primero II Nº6
D.O. 04.02.2006 polvo como para las fórmulas para lactantes se expresan en Bq/L del producto listo para el consumo.
Art. primero II Nº6
D.O. 04.02.2006 polvo como para las fórmulas para lactantes se expresan en Bq/L del producto listo para el consumo.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que las modificaciones introducidas al presente artículo rigen a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que las modificaciones introducidas al presente artículo rigen a contar de 180 días desde su publicación.
Artículo 168.- Los niveles de intervención derivados señalados en el artículo 166 se han calculado sobre la base de un alimento contaminado con sólo un radionucleido. Si más de una categoría de alimento está contaminada y/o si hay varios radionucleidos presentes, la autoridad competente establecerá nuevos NID, de acuerdo a la metodología recomendada internacionalmente.
Decreto 22, SALUD
Art. 1 Nº1
D.O. 05.10.2013 Artículo 169.- Las micotoxinas que se indican a continuación no podrán sobrepasar los siguientes límites:
Art. 1 Nº1
D.O. 05.10.2013 Artículo 169.- Las micotoxinas que se indican a continuación no podrán sobrepasar los siguientes límites:
.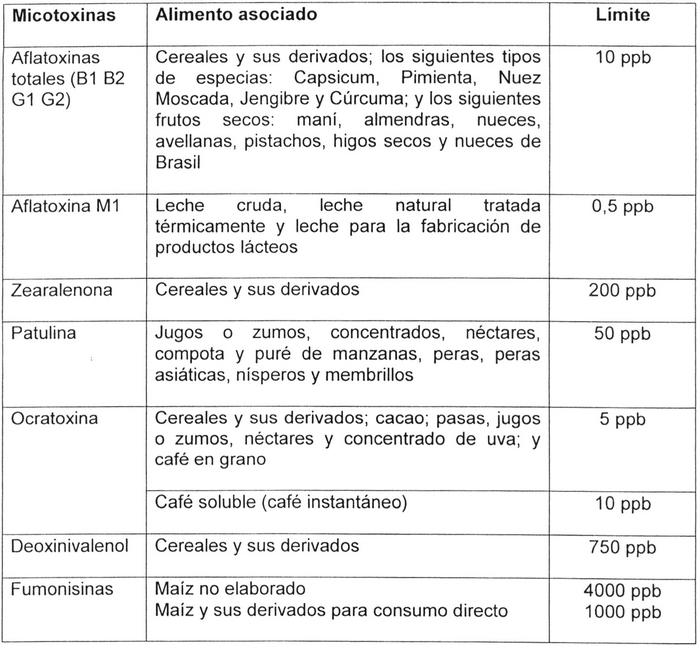 .
.
 .
.NOTA
El artículo 2º del Decreto 22, Salud, publicado el 05.10.2013, indica que el presente decreto entrará en vigencia en el plazo de doce meses, contado desde su publicación, con excepción de lo establecido para aflatoxinas totales, aflatoxinas M1 y Zearalenona que entrarán en vigencia desde su publicación.
El artículo 2º del Decreto 22, Salud, publicado el 05.10.2013, indica que el presente decreto entrará en vigencia en el plazo de doce meses, contado desde su publicación, con excepción de lo establecido para aflatoxinas totales, aflatoxinas M1 y Zearalenona que entrarán en vigencia desde su publicación.
Decreto 64, SALUD
Art. 1 Nº 6
D.O. 11.12.2009 Artículo 170.- Los contenidos máximos de Dioxinas y Bifenilos Policlorados Coplanares (PCBs) en los alimentos que a continuación se indican son los siguientes:
Art. 1 Nº 6
D.O. 11.12.2009 Artículo 170.- Los contenidos máximos de Dioxinas y Bifenilos Policlorados Coplanares (PCBs) en los alimentos que a continuación se indican son los siguientes:
Contenido Máximo de
Alimento Dioxinas y PCBs Unidad
coplanares
Carne de cerdo y 2,0 (pg EQT/OMS/g
productos derivados de grasa)
Carne de ave y 3,5 (pg EQT/OMS/g
productos derivados de grasa)
Carne de bovino y ovino 6,0 (pg EQT/OMS/g
y productos derivados de grasa)
Pescados y productos 2,0 (pg EQT/OMS/g de
derivados peso fresco)
Huevos y productos 3,0 (pg EQT/OMS/g de
derivados grasa)
Leche y productos 6,0 (pg EQT/OMS/g de
derivados grasa)
Para los efectos de este reglamento se entiende por:
- Dioxinas: Familia de compuestos clorados relacionados entre sí desde el punto de vista estructural y químico, constituida por Dibenzo-para-dioxinas policloradas (PCDD) y Dibenzofuranos policlorados (PCDF).
- Bifenilos Policlorados Coplanares: Algunos PCBs que poseen propiedades tóxicas similares a las dioxinas.
- Equivalencia Tóxica (EQT): valor relativo calculado multiplicando la concentración de un compuesto análogo a las dioxinas por el factor de equivalencia tóxica (FET).
- EQT/OMS: Equivalencia Tóxica de la Organización Mundial de Salud para Dioxinas y PCBs coplanares, basada en factores de equivalencia tóxica (FET).
- Factor de Equivalencia Tóxica (FET): estimaciones de la toxicidad de compuestos análogos a las dioxinas en relación con la toxicidad de 2,3,7,8-Tetraclorodibenzo-p-dioxina (TCDD), a la que se asigna un FET de 1.
Tabla de Factores de Equivalencia Tóxica
Compuesto (congénere) Abreviatura FET
Dibenzodioxinas Policloradas
2,3,7,8-Tetraclorodibenzodioxina TCDD 1
1,2,3,7,8-Pentaclorodibenzodioxina 1,2,3,7,8-PeCDD 1
1,2,3,4,7,8-Hexaclorodibenzodioxina 1,2,3,4,7,8-HxCDD0 . 1
1,2,3,6,7,8-Hexaclorodibenzodioxina 1,2,3,6,7,8-HxCD D0. 1
1,2,3,6,7,9-Hexaclorodibenzodioxina 1,2,3,6,7,9-HxCDD 0.1
1,2,3,4,6,7,8
Heptaclorodibenzodioxina 1,2,3,4,6,7,8-HxCDD0.01
Octaclorodibenzodioxin OCDD 0.0001
Dibenzofuranos Policlorados
2,3,7,8-Tetraclorodibenzofurano 2,3,7,8-TCDF 0.1
1,2,3,7,8-Pentaclorodibenzofurano 1,2,3,7,8-PeCDF 0.05
2,3,4,7,8-Pentaclorodibenzofurano 2,3,4,7,8-PeCDF 0.5
1,2,3,4,7,8-Hexaclorodibenzofurano 1,2,3,4,7,8-HxCDF 0.1
1,2,3,6,7,8-Hexaclorodibenzofurano 1,2,3,6,7,8-HxCDF 0.1
1,2,3,7,8,9-Hexaclorodibenzofurano 1,2,3,7,8,9-HxCDF 0.1
2,3,4,6,7,8-Hexaclorodibenzofurano 2,3,4,6,7,8-HxCDF 0.1
1,2,3,4,6,7,8-Heptaclorodibenzofurano
1,2,3,4,6,7,8-HpCDF 0.01
1,2,3,4,7,8,9-Heptaclorodibenzofurano
1,2,3,4,7,8,9-HpCDF 0.01
Octaclorodibenzofurano OCDF 0.0001
Bifenilos policlorados "no-orto"
3,3',4',4'-Tetraclorobifenilo 3,3',4,4'-TCB 0.0001
3,4,4',5,-Tetraclorobifenilo 3,4,4',5-TCB 0.0001
3,3',4,4',5-Pentaclorobifenilo 3,3',4,4',5-PeCB 0.1
3,3',4,4',5,5'-Hexaclorobifenilo 3,3',4,4',5,5'-HxCB 0.01
Bifenilos policlorados "mono-orto"
2,3,3',4,4'-Pentaclorobifenilo 2,3,3',4,4'-PeCB 0.0001
2,3,4,4',5-Pentaclorobifenilo 2,3,4,4',5-PeCB 0.0005
2,3',4,4',5-Pentaclorobifenilo 2,3',4,4',5-PeCB 0.0001
2,3',4,4',5'-Pentaclorobifenilo 2,3',4,4',5'-PeCB 0.0001
2,3,3',4,4',5-Hexaclorobifenilo 2,3,3',4,4',5-HxCB 0.0005
2,3,3',4,4',5'-Hexaclorobifenilo 2,3,3',4,4',5'-HxCB0.0005
2,3',4,4',5,5'-Hexaclorobifenilo
2,3',4,4',5,5'-HxCB0. 00001
2,3,3',4,4',5,5'-Heptaclorobifenilo
2,3,3',4,4',5,5'-HpCB 0.00001
ArDecreto 80,
SALUD
Art. 1° Nº 1)
D.O. 25.09.2023tículo 170 bis.- El contenido de Tetrahidrocannabinol (THC) en la semilla de cáñamo utilizada para la alimentación humana y los alimentos en base a cáñamo no deberá ser superior a:
SALUD
Art. 1° Nº 1)
D.O. 25.09.2023tículo 170 bis.- El contenido de Tetrahidrocannabinol (THC) en la semilla de cáñamo utilizada para la alimentación humana y los alimentos en base a cáñamo no deberá ser superior a:
a) Aceite de cáñamo 10,0 mg/Kg
b) Semilla de cáñamo entera 5,0 mg/Kg
c) Semilla de cáñamo sin cáscara 2,5 mg/Kg
d) Harina o proteína de cáñamo 3,5 mg/Kg
TITULO V
De los criterios microbiológicos
Párrafo I
Definiciones
Artículo 171.- Para los fines del presente reglamento se entenderá por:
a) criterio microbiológico: el valor o la gama de valores microbiológicos, establecidos mediante el empleo de procedimientos definidos, para determinar la aceptación o rechazo del alimento muestreado;
b) parámetro microbiológico: los análisis microbiológicos específicos practicados a cada alimento, tales como, microorganismos indicadores, microorganismos patógenos, toxinas, etc.;
c) indicador microbiológico: a los microorganismos no patógenos pero frecuentemente asociados a éstos, utilizados para reflejar el riesgo de la presencia de agentes productores de enfermedades;
d) severidad del muestreo: el rigor que se aplicará al muestreo. Depende del grado de riesgo para la salud y condiciones de uso posterior del alimento. Determina los planes de muestreo con respecto al número de unidades de muestras a ser examinadas (n), a la cantidad máxima de unidades defectuosas que puede contener la muestra (c) y al tipo de plan, 2 o 3 clases;
e) plan de muestreo: el procedimiento en que se estipula el tamaño de la muestra (n), y el criterio de aceptación o rechazo (c), de forma que pueda tomarse una decisión respecto a si se debe aceptar o rechazar el alimento inspeccionado, basándose en los resultados del análisis;DTO 475, SALUD
Art. Unico, Nº 45
D.O.13.01.2000
Art. Unico, Nº 45
D.O.13.01.2000
f) plan de 2 clases: un plan de muestreo, por atributos, donde la calidad de un producto de acuerdo con los criterios microbiológicos puede dividirse en dos grados de calidad, "aceptable" y "rechazable", basado en comprobar la presencia o ausencia de microorganismos, o si la tasa microbiológica es superior o inferior a un nivel crítico establecido (c). Un plan de 2 clases queda descrito por n y c;
g) plan de 3 clases: un plan de muestreo, por atributos, donde la calidad de un producto, de acuerdo con los criterios microbiológicos puede dividirse en tres grados de calidad, "aceptable", "medianamente aceptable" y "rechazable". La clase aceptable tiene como límites 0 y m; la clase medianamente aceptable tiene como límites m y M, y la rechazable aquellos valores superiores a M. Un plan de tres clases queda descrito por n, m, M y c;
h) n = número de unidades de muestras a ser examinadas;
i) m = valor del parámetro microbiológico para el cual o por debajo del cual el alimento no representa un riesgo para la salud;
j) c = número máximo de unidades de muestra que puedeDTO 475, SALUD
Art. Unico, Nº 45
D.O. 13.01.2000 contener un número de microorganismos comprendidos entre ''m'' y ''M'' para que el alimento sea aceptable;
Art. Unico, Nº 45
D.O. 13.01.2000 contener un número de microorganismos comprendidos entre ''m'' y ''M'' para que el alimento sea aceptable;
k) M = valor del parámetro microbiológico por encima del cual el alimento representa un riesgo para la salud.
l) categoría de riesgo: la relación entre el grado deDTO 475, SALUD
Art. Unico, Nº 45
D.O.13.01.2000 peligrosidad que representa el alimento para la salud en relación con las condiciones posteriores de manipulación.
Art. Unico, Nº 45
D.O.13.01.2000 peligrosidad que representa el alimento para la salud en relación con las condiciones posteriores de manipulación.
Párrafo II
Disposiciones generales
Artículo 172.- Para los fines del presente reglamento, se definen los criterios microbiológicos tomando como base la clasificación, los parámetros de control y planes de muestreo de la ICMSF ( International Commission on Microbiological Specification for Foods ), adaptados a la realidad nacional. De este modo:
a) se establecen los parámetros microbiológicos que se controlarán en los distintos grupos de alimentos: microorganismos indicadores, microorganismos patógenos, toxinas, etc.;
b) se clasifican los alimentos, según:
- los factores de riesgo que éstos presentan y que
dependen de: sus características, tales como,
composición, pH, acidez, actividad de agua, etc.;
- grupo consumidor a quien va dirigido: adultos,
niños, lactantes, personas sensibles y otros grupos
de alto riesgo;
- la forma de preparación y consumo: consumo directo,
reconstituido, rehidratado, cocinado, etc.;
- la forma de mantención y conservación;
c) se configuran 15 categorías para los alimentos, de acuerdo a la clase de peligro determinado por variables propias y por aquellas relacionadas a las condiciones de manipulación y consumo. Estas categorías se presentan en la siguiente tabla:
Categorías de riesgoDTO 475, SALUD
Art. Unico, Nº 46
D.O. 13.01.2000
Art. Unico, Nº 46
D.O. 13.01.2000
Clase de peligro Condiciones normales en las que se
supone será manipulado y consumido
el alimento tras el muestreo
Grado de Sin cambio Aumenta la
peligrosidad de peligrosidad
reducido peligrosidad
Sin peligro Categoría 1 Categoría 2 Categoría 3
directo para 3 clases 3 clases 3 clases
la salud. n=5 c=3 n=5 c=2 n=5 c=1
(contaminación
general,
vida útil y
alteración)
Peligro para Categoría 4 Categoría 5 Categoría 6
la salud bajo, 3 clases 3 clases 3 clases
indirecto n=5 c=3 n=5 c=2 n=5 c=1
Moderado, Categoría 7 Categoría 8 Categoría 9
directo, 3 clases 3 clases 3 clases
difusión n=5 c=2 n=5 c=1 n=5 c=1
limitada
Moderado, Categoría 10 Categoría 11 Categoría 12
directo, 2 clases 2 clases 2 clases
difusión n=5 c=0 n=10 c=0 n=20 c=0
potencialmente
extensa
Grave, directo Categoría 13 Categoría 14 Categoría 15
2 clases 2 clases 2 clases
n=15 c=0 n=30 c=0 n=60 c=0
- en las categoría 1, 2 y 3 se usan parámetros que tienen por objetivo definir la vida útil y alteración del producto como recuento de microorganismos aeróbios mesófilos ( RAM), mohos y levaduras, lactobacillus, etc.;
- en las categorías 4, 5 y 6 se usan como parámetros, microorganismos indicadores tales como coliformes totales, enterobacteriaceas, etc.;
- en las categorías 7, 8 y 9 se usan como parámetros microorganismos que siendo considerados patógenos, en bajos niveles pueden aceptarse, tales como, S. aureus, B. cereus.
- a partir de la categoría 10 se considera peligrosa para la salud la presencia y/o concentración de ciertos microorganismos como Salmonella, C.DTO 475, SALUD
Art. Unico, N° 1
D.O. 13.01.2000 botulinum, entre otros patógenos;
Art. Unico, N° 1
D.O. 13.01.2000 botulinum, entre otros patógenos;
d) se establecen planes de muestreo, que puedan ser de 2 tipos: plan de 2 clases y plan de 3 clases;
e) se establecen límites microbiológicos de acuerdo a las recomendaciones internacionales (ICMSF);
f) se definen 18 grupos de alimentos según su origen y/o tecnología aplicada en su elaboración. Estos son:
- grupo N° 1 Leches y productos lácteoDTO 214, SALUD
Art. primero II Nº7
D.O. 04.02.2006s
Art. primero II Nº7
D.O. 04.02.2006s
- grupo N° 2 Helados y mezclas para helados
- grupo N° 3 Productos grasos
- grupo N° 4 Caldos, sopas, cremas y mezclas
deshidratadas
- grupo N° 5 Productos elaborados a partir de
cereales
- grupo N° 6 Azúcares y miel
- grupo N° 7 Productos de confitería
- grupo N° 8 Productos de panadería y pastelería
- grupo N° 9 Alimentos de uso infantil
- grupo N° 10 Carnes y productos cárneos
- grupo N° 11 Pescados y productos de la pesca
- grupo N° 12 Huevos y ovoproductos
- grupo N° 13 Salsas, aderezos, especias y condimentos
- grupo N° 14 Frutas y verduras
- grupo N° 15 Comidas y platos preparados
- grupo N° 16 Bebidas
- grupo N° 17 Estimulantes y fruitivos
- grupo N° 18 Conservas.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Párrafo III
Especificaciones microbiológicas por grupo de alimentos
Artículo 173.- Si en un alimento se detecta laDTO 475, SALUD
Art. Unico, Nº 47
D.O.13.01.2000 presencia de microorganismos patógenos no contemplados en la lista indicada a continuación, la autoridad sanitaria podrá considerarlo alimento contaminado, conforme a la evaluación de los riesgos que de su presencia se deriven.
Art. Unico, Nº 47
D.O.13.01.2000 presencia de microorganismos patógenos no contemplados en la lista indicada a continuación, la autoridad sanitaria podrá considerarlo alimento contaminado, conforme a la evaluación de los riesgos que de su presencia se deriven.
Para los microorganismos incluidos en esta lista los alimentos deberán cumplir con los requisitos microbiológicos que en ella se indican:
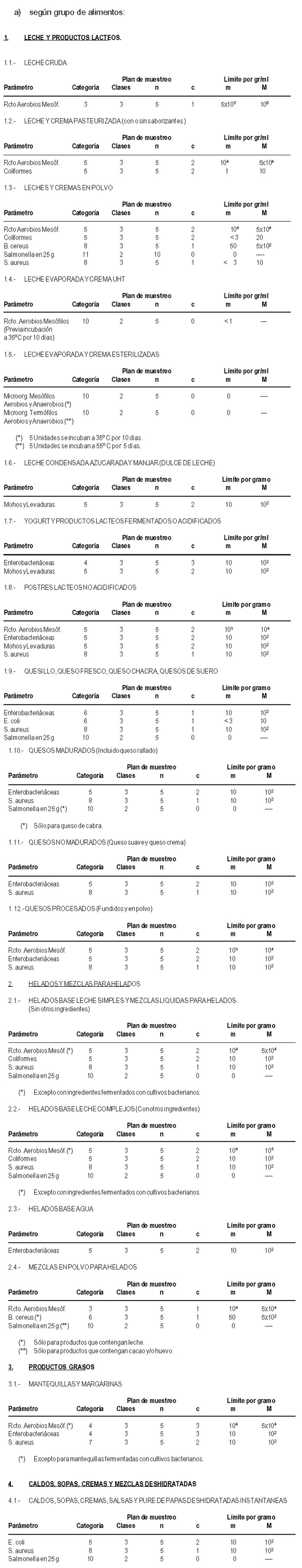 .
. .
. .
.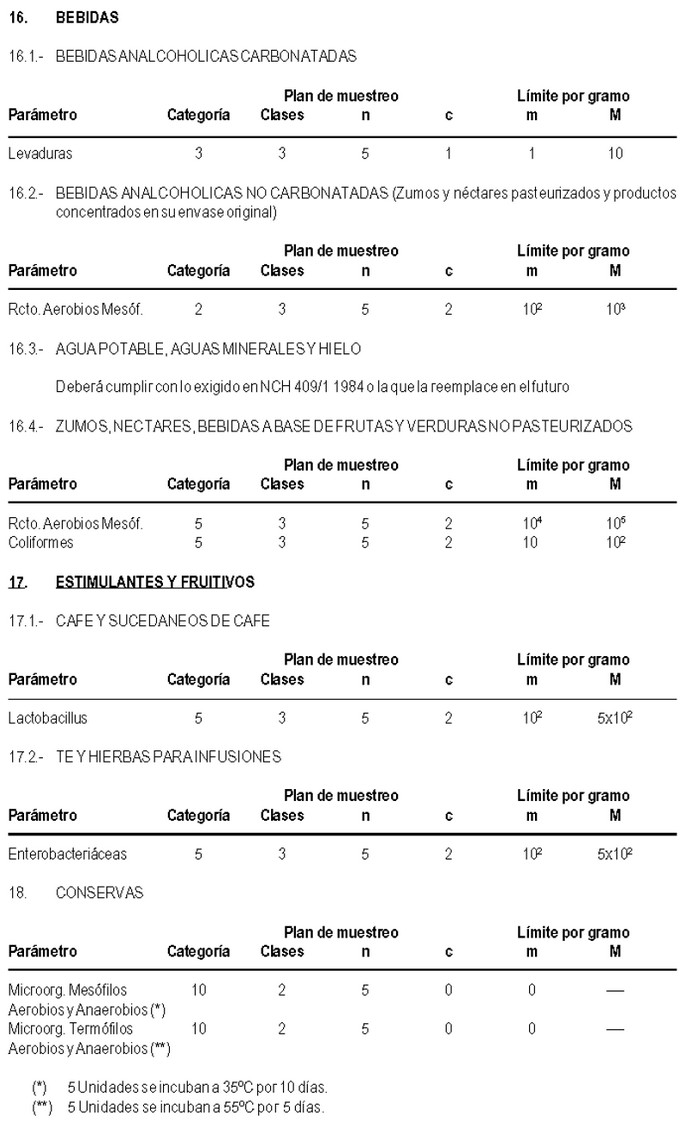 .
. b) en caso de enfermedades transmitidas por alimentos, especialmente en la investigación de la etiología de toxi-infecciones se deben obtener todos los restos de alimentos sospechosos. Los análisis microbiológicos a realizar estarán de acuerdo a los antecedentes clínicos y epidemiológicos del brote;
c) en los casos en que no se pueda obtener el número establecido de unidades de muestras que se define en este artículo 173 se aplicará el siguiente criterio de calificación:
si n es igual o menor que 4 unidades de muestra, el valor de los indicadores, recuento de aerobios mesófilos (RAM), enterobacteriaceas, coliformes, etc., no deberá sobrepasar el valor de M en ninguna de las unidades de muestra y deberá cumplir con los valores de c establecidos en este artículo. Para los microorganismos que representen riesgo para la salud el valor no deberá exceder m.
NOTA :
El numeral 47 del Decreto 475, Salud, publicado el 13.01.2000, modifica el cuadro inserto en el presente artículo de la siguiente forma: En primer lugar, dispone modificar en la letra a) los puntos 1.3; 1.6; 1.7; 1.8; 1.9; 1.10; 1.11; 10.3; 13.2; 14.3 y 16.3. Asimismo, modifica los siguientes puntos 1.4; 1.12; 2.1; 2.4; 3.1; 4.3; 4.4; 5.1; 5.2; 6.2; 8.2. Además, en el número 9, incorpora los siguientes puntos 9.3. y 9.4. nuevos, a continuación del punto 9.2. Finalmente, modifica los siguientes puntos: 10.1; 10.2; 10.4; 10.6; 11.3; 12.1; 12.2; 13.1; 13.3; 14.1; 15.1; 17.1 y 17.2 de la manera que la citada norma indica.
El numeral 47 del Decreto 475, Salud, publicado el 13.01.2000, modifica el cuadro inserto en el presente artículo de la siguiente forma: En primer lugar, dispone modificar en la letra a) los puntos 1.3; 1.6; 1.7; 1.8; 1.9; 1.10; 1.11; 10.3; 13.2; 14.3 y 16.3. Asimismo, modifica los siguientes puntos 1.4; 1.12; 2.1; 2.4; 3.1; 4.3; 4.4; 5.1; 5.2; 6.2; 8.2. Además, en el número 9, incorpora los siguientes puntos 9.3. y 9.4. nuevos, a continuación del punto 9.2. Finalmente, modifica los siguientes puntos: 10.1; 10.2; 10.4; 10.6; 11.3; 12.1; 12.2; 13.1; 13.3; 14.1; 15.1; 17.1 y 17.2 de la manera que la citada norma indica.
NOTA 1
El numeral 11 del Decreto 68, Salud, publicado el 23.01.2006, modifica el cuadro inserto en el presente artículo, en el sentido de reemplazar en los puntos 6.1. y 7.2. la palabra "Azúcar" por "Azúcares". Asimismo, el numeral 11, letra a) sustituye el punto 1.9; la letra b) sustituye el punto 8.2; la letra c) sustituye el punto 9, reemplaza el punto 9.1, 9.2, 9.3, 9.4 e incorpora el punto nuevo 9.5; la letra d) sustituye el punto 10.3; la letra e) sustituye el punto 10.4; la letra f) sustituye el punto 13.3; la letra g) sustituye el punto 14, reemplaza el 14.1, 14.2, 14.3, 14.4, 14.5 e incorpora los puntos nuevos 14.6, 14.7, 14.8 y 14.9; la letra h) sustituye el punto 15.1; la letra i) sustituye el punto 15.2; la letra j) agrega el nuevo punto 15.3; la letra k) modifica el punto 16; la letra l) modifica el punto 16.3; la letra m) sustituye el punto 16.4, de la manera que la citada norma indica.
El numeral 11 del Decreto 68, Salud, publicado el 23.01.2006, modifica el cuadro inserto en el presente artículo, en el sentido de reemplazar en los puntos 6.1. y 7.2. la palabra "Azúcar" por "Azúcares". Asimismo, el numeral 11, letra a) sustituye el punto 1.9; la letra b) sustituye el punto 8.2; la letra c) sustituye el punto 9, reemplaza el punto 9.1, 9.2, 9.3, 9.4 e incorpora el punto nuevo 9.5; la letra d) sustituye el punto 10.3; la letra e) sustituye el punto 10.4; la letra f) sustituye el punto 13.3; la letra g) sustituye el punto 14, reemplaza el 14.1, 14.2, 14.3, 14.4, 14.5 e incorpora los puntos nuevos 14.6, 14.7, 14.8 y 14.9; la letra h) sustituye el punto 15.1; la letra i) sustituye el punto 15.2; la letra j) agrega el nuevo punto 15.3; la letra k) modifica el punto 16; la letra l) modifica el punto 16.3; la letra m) sustituye el punto 16.4, de la manera que la citada norma indica.
NOTA 2
El numeral 8 del número II del artículo primero del Decreto 214, Salud, publicado el 04.02.2006, modifica el cuadro inserto en el presente artículo de la manera siguiente: En el punto 1 sustituye la palabra "Leche" por "Leches"; en el punto 1.1 reemplaza la expresión "Leche Cruda" por "Leches Crudas"; en el punto 1.5 sustituye la expresión "Leche Evaporada" por "Leches Evaporadas"; en el punto 1.6 reemplaza la expresión "Leche Condensada Azucarada" por "Leches Condensadas Azucaradas"; en los puntos 1.2., 1.4., 2.1., y 2.2. sustituye la palabra "Leche" por "Leches" y en el primer asterisco (*) de los puntos 2.4, 4.3., y 4.4. reemplaza la palabra "leche" por "leches".
El numeral 8 del número II del artículo primero del Decreto 214, Salud, publicado el 04.02.2006, modifica el cuadro inserto en el presente artículo de la manera siguiente: En el punto 1 sustituye la palabra "Leche" por "Leches"; en el punto 1.1 reemplaza la expresión "Leche Cruda" por "Leches Crudas"; en el punto 1.5 sustituye la expresión "Leche Evaporada" por "Leches Evaporadas"; en el punto 1.6 reemplaza la expresión "Leche Condensada Azucarada" por "Leches Condensadas Azucaradas"; en los puntos 1.2., 1.4., 2.1., y 2.2. sustituye la palabra "Leche" por "Leches" y en el primer asterisco (*) de los puntos 2.4, 4.3., y 4.4. reemplaza la palabra "leche" por "leches".
NOTA 3
El numeral 21 del artículo 1 del Decreto 106, Salud, publicado el 23.04.2009 modifica el cuadro inserto en el presente artículo, en el sentido de eliminar el parámetro correspondiente a las enterobacteriaceas contenido en el punto 5.1 Harinas y Almidones.
El numeral 21 del artículo 1 del Decreto 106, Salud, publicado el 23.04.2009 modifica el cuadro inserto en el presente artículo, en el sentido de eliminar el parámetro correspondiente a las enterobacteriaceas contenido en el punto 5.1 Harinas y Almidones.
NOTA 4
Los numerales 1 y 2 del artículo 1 del Decreto 21, Salud, publicado el 05.10.2013, modifican el cuadro inserto en el presente artículo, en el sentido de reemplazar los puntos 14.2 y 14.3, respectivamente, por aquellos que la citada norma indica.
Los numerales 1 y 2 del artículo 1 del Decreto 21, Salud, publicado el 05.10.2013, modifican el cuadro inserto en el presente artículo, en el sentido de reemplazar los puntos 14.2 y 14.3, respectivamente, por aquellos que la citada norma indica.
NOTA 5
El numeral 2 del Artículo 1 del Decreto 15, Salud, publicado el 02.08.2017, modifica el cuadro inserto en el presente artículo, en el sentido de reemplazar el punto 14.2 e incorporar el 14.2.1 nuevo, de la manera que el citada norma indica. Asimismo, el numeral 3, reemplaza la Nota (*) contemplada al pie del punto 15.2 del referido cuadro, por la siguiente: "(*) Excepto con ingredientes fermentados o madurados con cultivos bacterianos y/o vegetales crudos de las tablas 14.1 y 14.2 del presente artículo."
El numeral 2 del Artículo 1 del Decreto 15, Salud, publicado el 02.08.2017, modifica el cuadro inserto en el presente artículo, en el sentido de reemplazar el punto 14.2 e incorporar el 14.2.1 nuevo, de la manera que el citada norma indica. Asimismo, el numeral 3, reemplaza la Nota (*) contemplada al pie del punto 15.2 del referido cuadro, por la siguiente: "(*) Excepto con ingredientes fermentados o madurados con cultivos bacterianos y/o vegetales crudos de las tablas 14.1 y 14.2 del presente artículo."
NOTA 6
El numeral 2 del artículo 1 del Decreto 31, Salud, publicado el 28.10.2017, modifica el cuadro inserto en el presente artículo en el sentido de sustituir el punto 9.1 de la manera que la citada norma indica.
El numeral 2 del artículo 1 del Decreto 31, Salud, publicado el 28.10.2017, modifica el cuadro inserto en el presente artículo en el sentido de sustituir el punto 9.1 de la manera que la citada norma indica.
Decreto 63, SALUD
Art. 1 Nº 3
D.O. 11.12.2009 Artículo 174.- En los alimentos Listos Para el Consumo (LPC) se considera que no favorecen el desarrollo de Listeria monocytogenes cuando cumplen alguno de los siguientes parámetros:
Art. 1 Nº 3
D.O. 11.12.2009 Artículo 174.- En los alimentos Listos Para el Consumo (LPC) se considera que no favorecen el desarrollo de Listeria monocytogenes cuando cumplen alguno de los siguientes parámetros:
1. pH menor o igual a 4,4;
2. actividad de agua (aw) menor o igual a 0,92;
3. combinación de pH y aw, con pH menor o igual de 5,0 y con aw, menor o igual a 0,94;
4. congelación, siempre que esta condición se mantenga durante todo el período, hasta antes de ser consumido;
5. vida útil en refrigeración por un lapso de menos de 5 días.
Los alimentos LPC que no cumplan los parámetros anteriores se considera que favorecen el desarrollo de Listeria monocytogenes.
Criterios microbiológicos para Listeria monocytogenes
Excepcionalmente, para alimentos que favorecen el desarrollo de Listeria monocytogenes, se aplicará el criterio de aquellos alimentos que no favorecen su desarrollo, cuando el fabricante o el productor, sea capaz de garantizar y demostrar, a través de la aplicación de tecnologías, que el producto no superará el límite de 100ufc/g durante su vida útil. Esta situación deberá ser demostrada, en su caso, ante la autoridad sanitaria.
TITULO VI
De la irradiación de alimentos
Párrafo I
Disposiciones generales
Artículo 175.- Las presentes disposiciones seDTO 475, SALUD
Art. Unico, Nº 48
D.O. 13.01.2000 aplican a todas las instalaciones de irradiación de alimentos y a todos los alimentos irradiados. No se aplican a los alimentos expuestos a las dosis emitidas por los instrumentos de medición utilizados con fines de inspección. Sólo se podrá tratar con energía ionizante los tipos de alimentos que determine el Ministerio de Salud, cuando obedezca a necesidades de carácter técnico o de higiene alimentaria. Se aplicará básicamente para la inhibición de bulbos y tubérculos, desinfección, desparasitación, retardo de la maduración y reducción y/o eliminación de carga microbiana, saprófita o patógena. Mediante resolución del Ministerio de Salud, se establecerá la finalidad del proceso y la dosis media que podrá recibir el respectivo alimento de acuerdo a la finalidad autorizada. Esta tecnología no podrá ser usada como sustituto de buenas prácticas de producción y/o fabricación de los alimentos. La preservación de alimentos por medio de radiación ionizante deberá atenerse a las disposiciones de este reglamento relativas a la seguridad microbiológica. Los materiales de empaque deben ser apropiadosDTO 475, SALUD
Art. Unico, Nº 48
D.O. 13.01.2000 para la irradiación y adecuados para impedir la reinfestación, la recontaminación o el deterioro del producto durante su almacenamiento y transporte.
Art. Unico, Nº 48
D.O. 13.01.2000 aplican a todas las instalaciones de irradiación de alimentos y a todos los alimentos irradiados. No se aplican a los alimentos expuestos a las dosis emitidas por los instrumentos de medición utilizados con fines de inspección. Sólo se podrá tratar con energía ionizante los tipos de alimentos que determine el Ministerio de Salud, cuando obedezca a necesidades de carácter técnico o de higiene alimentaria. Se aplicará básicamente para la inhibición de bulbos y tubérculos, desinfección, desparasitación, retardo de la maduración y reducción y/o eliminación de carga microbiana, saprófita o patógena. Mediante resolución del Ministerio de Salud, se establecerá la finalidad del proceso y la dosis media que podrá recibir el respectivo alimento de acuerdo a la finalidad autorizada. Esta tecnología no podrá ser usada como sustituto de buenas prácticas de producción y/o fabricación de los alimentos. La preservación de alimentos por medio de radiación ionizante deberá atenerse a las disposiciones de este reglamento relativas a la seguridad microbiológica. Los materiales de empaque deben ser apropiadosDTO 475, SALUD
Art. Unico, Nº 48
D.O. 13.01.2000 para la irradiación y adecuados para impedir la reinfestación, la recontaminación o el deterioro del producto durante su almacenamiento y transporte.
Artículo 176.- Los controles de calidad habituales, en todas las etapas desde la producción al consumo, son de responsabilidad del que solicita la preservación de estos productos por energía ionizante. La ejecución y control del proceso de irradiación será de responsabilidad de la planta que aplique esta tecnología.
Párrafo II
Definiciones
Artículo 177.- Para los fines de este reglamento, se entenderá por:
Energía ionizante: aquellas formas de radiación ionizante que se señalan a continuación;
- Rayos gamma de los radionucleidos Co-60 o Cs-137
- Rayos X generados por máquinas que trabajen a energías de 5
Mev o inferiores
- Electrones generados por máquinas que trabajen a energías
de 10 Mev o inferiores.
Gray (Gy): Unidad de dosis absorbida equivalente a 1 Joule
por kilogramo
Rad : Unidad de dosis absorbida equivalente a 100 erg
por gramo
1 Gray = 100 rad
Dosis absorbida: la cantidad de energía expresadaDTO 475, SALUD
Art. Unico, Nº 49
D.O. 13.01.200 en Joules, absorbida por un kilo de producto sometido a tratamiento con radiación.
Art. Unico, Nº 49
D.O. 13.01.200 en Joules, absorbida por un kilo de producto sometido a tratamiento con radiación.
Dosis absorbida media global de 10 kGy: la dosis promedio de radiación absorbida por el alimento, con la condición de que por lo menos el 97.5% de la fracción de masa del producto alimenticio reciba una dosis absorbida menor de 15 kGy.
Lote o tanda de alimento irradiado: una cantidad de alimento irradiado en las mismas condiciones y durante la misma operación.
Alimento irradiado: cualquier alimento que haya sido sometido a tratamiento con radiación ionizante.
Instalación de irradiación de alimentos: son los establecimientos autorizados por los organismos competentes, para irradiar alimentos.
Dosimetría: la medición de la energía radiante absorbida.
Trazabilidad: la propiedad del resultado de una medición o de un patrón tal que pueda relacionarse con referencias establecidas, generalmente con patrones nacionales o internacionales, por medio de una cadena ininterrumpida de comparaciones, teniendo todas las incertidumbres determinadas.
Párrafo III
De las instalaciones y control del proceso
Artículo 178.- El tratamiento de los alimentos por energía ionizante se llevará a cabo sólo en las instalaciones que hayan obtenido la autorización correspondiente de los organismos competentes. Las instalaciones deben disponer de un sistema deDTO 475, SALUD
Art. Unico, Nº 50
D.O. 13.01.2000 control de calidad documentado que facilite la realización de auditorías. Los productos que ingresen al proceso de irradiación deben mantenerse físicamente separados de los productos tratados. Cuando proceda podrá fijarse un indicador visual de irradiación por cambio de color a fin de facilitar el control. La irradiación de alimentos, incluido un procedimiento dosimétrico adecuado, debe efectuarse en conformidad con los Códigos de Buenas Prácticas de Irradiación del Grupo Consultivo Internacional de Irradiación de Alimentos (GCIIA), establecido bajo el auspicio de la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO), el Organismo Internacional de Energía Atómica (OIEA) y la Organización Mundial de la Salud (OMS). La dosimetría debe ser trazable a patrones nacionales e internacionales.
Art. Unico, Nº 50
D.O. 13.01.2000 control de calidad documentado que facilite la realización de auditorías. Los productos que ingresen al proceso de irradiación deben mantenerse físicamente separados de los productos tratados. Cuando proceda podrá fijarse un indicador visual de irradiación por cambio de color a fin de facilitar el control. La irradiación de alimentos, incluido un procedimiento dosimétrico adecuado, debe efectuarse en conformidad con los Códigos de Buenas Prácticas de Irradiación del Grupo Consultivo Internacional de Irradiación de Alimentos (GCIIA), establecido bajo el auspicio de la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO), el Organismo Internacional de Energía Atómica (OIEA) y la Organización Mundial de la Salud (OMS). La dosimetría debe ser trazable a patrones nacionales e internacionales.
Artículo 179.- El control de las instalaciones se ejercerá de conformidad a la legislación vigente.
Los estudios dosimétricos se deberán efectuar antes de la irradiación de cualquier producto alimenticio para comprobar que el proceso se ajusta a las especificaciones de dosis absorbida, establecidas para ese tipo de alimento por el Ministerio de Salud. Además deberán hacerse mediciones dosimétricas:
a) al entrar en servicio una planta;
b) cada vez que se utilice un nuevo proceso de irradiación;
c) siempre que se modifique la intensidad o el tipo de la fuente o la geometría fuente-producto.
Artículo 180.- En la irradiación de alimentos seDTO 475, SALUD
Art. Unico, Nº 51
D.O. 13.01.2000 deberá llevar a cabo la dosimetría en la siguiente forma:
Art. Unico, Nº 51
D.O. 13.01.2000 deberá llevar a cabo la dosimetría en la siguiente forma:
a) medición exacta y precisa de la dosis absorbida por el alimento;
b) determinación de la distribución de la dosis e interpretación de la información;
c) mantenimiento de dosímetros para calibrar la respuesta de los instrumentos de medición y/o vigilancia radiológica usados habitualmente en la instalación;
d) observancia de los criterios de selección de dosímetros prescritos en el programa de control de calidad, con el fin de asegurar una dosimetría y/o vigilancia radiológica precisa, apropiada y eficiente;
e) mantenimiento de documentación completa de la dosimetría y empleo de listas de comprobación de todas las fases de los procedimientos de dosimetría.
Artículo 181.- En toda instalación o planta enDTO 475, SALUD
Art. Unico, Nº 51
D.O.13.01.2000 que se aplique energía ionizante a los alimentos se deberá llevar un registro de cada lote o tanda, el que deberá contener, a lo menos, la siguiente información:
Art. Unico, Nº 51
D.O.13.01.2000 que se aplique energía ionizante a los alimentos se deberá llevar un registro de cada lote o tanda, el que deberá contener, a lo menos, la siguiente información:
a) identificación del propietario del alimento a irradiar o de su representante legal;
b) el tipo y la cantidad de alimentos en el lote o tanda irradiados, incluyendo información acerca de si es natural o ha sido previamente sometido a otros procedimientos de preservación, sean físicos o químicos;
c) el número de serie del lote o tanda de alimentos irradiados;
d) la fecha de irradiación;
e) tipo de empaque utilizado durante el tratamiento de irradiación, cuando proceda;
f) controles y mediciones efectuadas durante el tratamiento. Dosis mínima y máxima absorbidas, certificados de dosimetría;
g) fuente utilizada para el tratamiento;
h) descripción del almacenamiento en la planta;
i) fecha de vencimiento del producto, posterior a su tratamiento con fines de preservación;
j) resultados y observaciones de las inspecciones establecidas en el artículo siguiente, cuando corresponda.
En las plantas de irradiación se deberá mantener dicho registro, por un período mínimo de dos años a disposición de la autoridad sanitaria.
Artículo 182.- Las instalaciones destinadas a la preservación de alimentos por energía ionizante, serán inspeccionadas periódicamente y a lo menos una vez al año, por personal especializado de la institución encargada del control, conforme a su reglamento. El resultado u observaciones técnicas, fecha y nombre del inspector, serán estipuladas en el registro de la instalación que establece el artículo anterior y una copia será enviada a la autoridad que concedió la licencia.
Los propietarios responsables de las instalaciones destinadas a preservar alimentos por energía ionizante, no podrán negar el acceso inmediato a los inspectores debidamente autorizados por la institución encargada del control, para que realicen sus funciones, ni el acceso al registro que establece el artículo 181 bajo ningún pretexto.
Párrafo IV
De los alimentos preservados por energía ionizante
Artículo 183.- Además de lo dispuesto para el etiquetado general, todo alimento que haya sido tratado con radiación o energía ionizante debe llevar en el rótulo o etiqueta, muy cerca del nombre del alimento, una indicación de dicho tratamiento empleando algunas de las siguientes frases: "Tratado con energía ionizante", "Procesado con energía ionizante", o "Preservado con energía ionizante". Además puede llevar el logo o símbolo, reconocido internacionalmente para estos efectos. Los alimentos no empacados, destinados al consumoDTO 475, SALUD
Art. Unico, Nº 52
D.O. 13.01.2000 directo, deberán presentar la misma información señalada en el inciso anterior en lugar visible y sobre los alimentos de que se trate.
Art. Unico, Nº 52
D.O. 13.01.2000 directo, deberán presentar la misma información señalada en el inciso anterior en lugar visible y sobre los alimentos de que se trate.
Artículo 184.- Cuando más del 5% de un productoDTO 475, SALUD
Art. Unico, Nº 53
D.O. 13.01.2000 corresponda a materias irradiadas, la etiqueta deberá contener una declaración que indique el tratamiento.
Art. Unico, Nº 53
D.O. 13.01.2000 corresponda a materias irradiadas, la etiqueta deberá contener una declaración que indique el tratamiento.
Se prohíbe repetir la irradiación de los alimentos. No se considerará repetición de la irradiación de un alimento, cualquiera de los siguientes casos:
a) cuando se aplique para combatir la reinfestación por insectos en alimentos de bajo contenido de humedad;
b) cuando los ingredientes fueron irradiados con otro fin tecnológico;
c) cuando el alimento contiene menos de 5% de ingredientes irradiados;
d) cuando el proceso de irradiación se haga en etapas sucesivas, con un fin tecnológico concreto, y la suma de las dosis parciales no supere la dosis completa de radiación ionizante requerida para lograr el efecto deseado.
En todos los casos, la dosis absorbida media global acumulada no debe ser superior a 10 kGy.
Artículo 185.- Todo alimento importado preservado por energía ionizante deberá acreditar que la instalación donde fue realizado el tratamiento está inscrita en el Registro Internacional de Plantas para Irradiar Alimentos y cualquier otro antecedente que compruebe que la tecnología empleada en el país de origen es compatible con las normas del presente reglamento.
TITULO VII
De la congelacion de los alimentos
Decreto 23, SALUD
Art. 1 N° 1
D.O. 30.08.2016 Artículo 186.- Alimentos congelados son aquellos, naturales o elaborados, que han sido sometidos, mediante un equipo apropiado, a un proceso térmico hasta que el producto alcance una temperatura de -18°C en el centro térmico. En la rotulación de los productos alimenticios congelados envasados que se expendan al público en tal condición, se deberá indicar en forma clara y legible la expresión "PRODUCTO CONGELADO", salvo los helados comestibles definidos en el artículo 243.
Art. 1 N° 1
D.O. 30.08.2016 Artículo 186.- Alimentos congelados son aquellos, naturales o elaborados, que han sido sometidos, mediante un equipo apropiado, a un proceso térmico hasta que el producto alcance una temperatura de -18°C en el centro térmico. En la rotulación de los productos alimenticios congelados envasados que se expendan al público en tal condición, se deberá indicar en forma clara y legible la expresión "PRODUCTO CONGELADO", salvo los helados comestibles definidos en el artículo 243.
Artículo 187.- Para reducir al mínimo la actividad microbiológica, los alimentos precocidos destinados a la congelación rápida, deberán enfriarse lo más rápidamente posible en aparatos adecuados y someterse de inmediato al proceso de congelación. Cuando ello no sea posible el alimento deberá conservarse a una temperatura superior a los 60ºC medido en el punto más frío del producto hasta que pueda efectuarse el enfriamiento y la subsiguiente congelación rápida.
Artículo 188.- Deberán adoptarse las medidasDTO 475, SALUD
Art. Unico, Nº 54
D.O. 13.01.2000 necesarias para evitar el aumento de la temperatura después del proceso de congelación rápida en la manipulación y durante el transporte a las cámaras frigoríficas. En el caso de reenvasar un producto congelado este procedimiento deberá realizarse en una sala especialmente destinada a este fin, la que deberá disponer de un dispositivo que permita mantener una temperatura no superior a 8°C y de un sistema de registro permanente de ésta.
Art. Unico, Nº 54
D.O. 13.01.2000 necesarias para evitar el aumento de la temperatura después del proceso de congelación rápida en la manipulación y durante el transporte a las cámaras frigoríficas. En el caso de reenvasar un producto congelado este procedimiento deberá realizarse en una sala especialmente destinada a este fin, la que deberá disponer de un dispositivo que permita mantener una temperatura no superior a 8°C y de un sistema de registro permanente de ésta.
Artículo 189.- El almacenamiento de estos productos deberá realizarse en cámaras frigoríficas cuya temperatura se mantenga en -18ºC o inferior y con un mínimo de fluctuación. Estas cámaras deberán disponer de dispositivos que registren continuamente la temperatura.
Artículo 190.- El transporte interurbano deDTO 475, SALUD
Art. Unico, Nº 55
D.O. 13.01.2000 alimentos congelados deberá efectuarse con equipos capaces de mantener la temperatura del producto a -18ºC o más baja. Los vehículos deberán estar provistos de termómetros que permitan su lectura desde el exterior y de dispositivos que registren las temperaturas durante el transporte. Podrá tolerarse un aumento de la temperatura del producto durante el transporte hasta -15ºC pero esta situación deberá reducirse rápidamente sea durante el transporte o inmediatamente después de la entrega.
Art. Unico, Nº 55
D.O. 13.01.2000 alimentos congelados deberá efectuarse con equipos capaces de mantener la temperatura del producto a -18ºC o más baja. Los vehículos deberán estar provistos de termómetros que permitan su lectura desde el exterior y de dispositivos que registren las temperaturas durante el transporte. Podrá tolerarse un aumento de la temperatura del producto durante el transporte hasta -15ºC pero esta situación deberá reducirse rápidamente sea durante el transporte o inmediatamente después de la entrega.
Artículo 191.- El transporte local de los alimentos congelados destinados a la distribución a los minoristas deberá efectuarse de tal manera que todo aumento de temperatura del producto superior a -18ºC se mantenga por el mínimo de tiempo y en ningún caso supere losDTO 475, SALUD
Art. Unico, Nº 56
D.O. 13.01.2000 -12ºC.
Art. Unico, Nº 56
D.O. 13.01.2000 -12ºC.
Decreto 23, SALUD
Art. 1 N° 2
D.O. 30.08.2016 Artículo 192.- Cuando los alimentos congelados se ofrezcan a la venta en esta condición deberán mantenerse en vitrinas congeladoras o conservadoras destinadas a ese fin, las que deberán ser capaces de mantener la temperatura del producto a -18°C y estar provistas de termómetros. Se podrá tolerar, por periodos breves, un aumento de la temperatura del producto sin que sobrepase los -12°C.
Art. 1 N° 2
D.O. 30.08.2016 Artículo 192.- Cuando los alimentos congelados se ofrezcan a la venta en esta condición deberán mantenerse en vitrinas congeladoras o conservadoras destinadas a ese fin, las que deberán ser capaces de mantener la temperatura del producto a -18°C y estar provistas de termómetros. Se podrá tolerar, por periodos breves, un aumento de la temperatura del producto sin que sobrepase los -12°C.
Se podrán descongelar para su venta al consumidor final siempre que el proceso de descongelación se realice en establecimientos autorizados para elaborar alimentos, a temperaturas adecuadas al producto y en condiciones de higiene que garanticen la inocuidad del mismo, las que deberán mantenerse hasta la venta. Respecto de estos productos descongelados, se deberá observar estricto cumplimiento de la totalidad de las obligaciones establecidas en el presente reglamento para los alimentos frescos o refrigerados, según corresponda a sus nuevas condiciones de almacenamiento.
Se deberá indicar en la rotulación del envase del producto descongelado o mediante un cartel junto a los alimentos descongelados que se expendan a granel, la fecha de elaboración original o lote de producción, la fecha de descongelación y la fecha de vencimiento, de acuerdo a la condición actual de producto descongelado. Además, en el mismo rótulo o cartel, según corresponda, se deberá indicar en forma clara y legible la expresión "PRODUCTO DESCONGELADO. NO VOLVER A CONGELAR". Asimismo, deberán ser informadas en el envase las nuevas condiciones de almacenamiento del producto descongelado. Las informaciones anteriores deberán ser aplicadas al rótulo por el establecimiento descongelador, para lo cual, en el caso de ser necesaria la sobreimpresión del etiquetado, no se requerirá la autorización de la Autoridad Sanitaria, contemplada en el artículo 109 del presente reglamento. Se eximen de la obligación de informar la condición de descongelado y la prohibición de volver a congelar exclusivamente los productos de panadería, masas horneadas o fritas, que no tengan relleno o estén rellenas con algunos de los productos señalados en los Títulos XVIII y XIX que se expendan a granel para su consumo inmediato.
Artículo 193.- Las vitrinas congeladoras o conservadoras se instalarán de manera que la parte en que se expone el producto no esté sometida a un calor irradiante anormal (luz solar directa o proximidad de elementos de calefacción). Estas vitrinas deberán mantenerse cerradas y conectadas al suministro de electricidad durante la noche y durante los días en que no haya atención de público. Deberán programarse ciclos de descongelación de tal forma que éstos se produzcan fuera de las horas normales de venta, para poder acomodar los productos en otras vitrinas congeladoras, sin que queden expuestos a temperaturas superiores a las recomendadas por el fabricante.
Artículo 194.- Las vitrinas congeladoras o conservadoras no deberán cargarse por sobre la línea de carga. Los productos no deberán retirarse de ellas y volverse a colocar, salvo en caso de absoluta necesidad.
Artículo 195.- Los productos congelados sin envasar deberán almacenarse y exponerse en compartimientos separados de los que se utilicen para los alimentos congelados envasados con el objeto de evitar riesgos de contaminación y deshidratación.
Artículo 196.- Los establecimientos de expendio de productos precocidos congelados a granel, deberán contar con un manipulador encargado de fraccionar y envasar el producto.
TITULO VIII
De las leches y productos lácteosDTO 214, SALUD
Art. primero II Nº9
Art. primero II Nº9
Párrafo ID.O. 04.02.2006
Disposiciones generales
Artículo 197.- Se regirán por las disposiciones del presente reglamento la higienización, el transporte, la industrialización, la distribución y el expendio de lasDTO 214, SALUD
Art. primero II Nº10
D.O. 04.02.2006 leches y de los productos lácteos.
Art. primero II Nº10
D.O. 04.02.2006 leches y de los productos lácteos.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que las modificaciones introducidas al presente artículo rigen a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que las modificaciones introducidas al presente artículo rigen a contar de 180 días desde su publicación.
Artículo 198.- Leche Decreto 71, SALUD
Art. 1 N° 2
D.O. 06.03.2019es la secreción mamaria normal exenta de calostro, de animales lecheros, obtenida mediante uno o más ordeños, sin ningún tipo de adición o extracción, destinada al consumo en forma de leche líquida o a su elaboración ulterior.
Art. 1 N° 2
D.O. 06.03.2019es la secreción mamaria normal exenta de calostro, de animales lecheros, obtenida mediante uno o más ordeños, sin ningún tipo de adición o extracción, destinada al consumo en forma de leche líquida o a su elaboración ulterior.
Para efectos de etiquetado, leche sin otra denominación, es el producto de la vaca. Las leches provenientes de otros animales se denominarán según la especie de la que proceden, como también los productos que de ella se deriven
Artículo 199.- Pasteurización es el procedimiento por el que se somete uniformemente la totalidad de lasDTO 214, SALUD
Art. primero II Nº12
D.O. 04.02.2006 leches u otros productos lácteos a una temperatura conveniente durante el tiempo necesario, para destruir la mayor parte de la flora banal y la totalidad de los gérmenes patógenos, seguido de un enfriamiento rápido de las leches o los productos lácteos así tratados.
Art. primero II Nº12
D.O. 04.02.2006 leches u otros productos lácteos a una temperatura conveniente durante el tiempo necesario, para destruir la mayor parte de la flora banal y la totalidad de los gérmenes patógenos, seguido de un enfriamiento rápido de las leches o los productos lácteos así tratados.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Artículo 200.- La Decreto 71, SALUD
Art. 1 N° 3
D.O. 06.03.2019pasteurización de la leche o la aplicación de otros tratamientos microbicidas para su higienización será obligatoria en todo el país, como asimismo la de los productos derivados de ella y mencionados en este Título destinados al consumo humano, con la excepción señalada en el artículo 207.
Art. 1 N° 3
D.O. 06.03.2019pasteurización de la leche o la aplicación de otros tratamientos microbicidas para su higienización será obligatoria en todo el país, como asimismo la de los productos derivados de ella y mencionados en este Título destinados al consumo humano, con la excepción señalada en el artículo 207.
Artículo 201.- Tratamiento a ultra alta temperaturaDTO 475, SALUD
Art. Unico, Nº 58
D.O. 13.01.2000
DTO 214, SALUD
Art. primero II Nº12
D.O. 04.02.2006 (UHT) es el procedimiento al que se somete uniformemente la totalidad de las leches u otros productos lácteos a una temperatura entre 130 y 145ºC durante 2 a 4 segundos u otra combinación tiempo-temperatura de tratamiento equivalente.
Art. Unico, Nº 58
D.O. 13.01.2000
DTO 214, SALUD
Art. primero II Nº12
D.O. 04.02.2006 (UHT) es el procedimiento al que se somete uniformemente la totalidad de las leches u otros productos lácteos a una temperatura entre 130 y 145ºC durante 2 a 4 segundos u otra combinación tiempo-temperatura de tratamiento equivalente.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Artículo 202.- Esterilización es el procedimiento por el que se somete uniformemente la totalidad de lasDTO 214, SALUD
Art. primero II Nº12
D.O. 04.02.2006 leches u otros productos lácteos a un proceso térmico en autoclave o equipo similar, por el tiempo necesario para asegurar la ausencia de gérmenes viables y esporas que germinen en condiciones normales de almacenamiento.
Art. primero II Nº12
D.O. 04.02.2006 leches u otros productos lácteos a un proceso térmico en autoclave o equipo similar, por el tiempo necesario para asegurar la ausencia de gérmenes viables y esporas que germinen en condiciones normales de almacenamiento.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Artículo 203.- Las características de las leches,DTO 214, SALUD
Art. primero II Nº13
D.O. 04.02.2006 serán las siguientes:
Art. primero II Nº13
D.O. 04.02.2006 serán las siguientes:
a) caracteres organolépticos normales;
b) exenta de materias extrañas;
c) exenta de sangre y pus;
d) exenta de antisépticos, antibióticos y neutralizantes;
Los residuos de plaguicidas y otras sustancias nocivas para la salud no deberán exceder los límites establecidos por el Ministerio de Salud;
e) sus requisitos microbiológicos y su contenido de materia grasa, serán los que determina este reglamento en cada caso;
Además, en el caso específico de la leche de vaca, las siguientes características:
f) peso específico: 1.028 a 1.034 a 20°C;
g) Índice Decreto 71, SALUD
Art. 1 N° 4
D.O. 06.03.2019crioscópico: -0,53 a -0,57 "Horvet" o -0,512 a -0,550 °C".
Art. 1 N° 4
D.O. 06.03.2019crioscópico: -0,53 a -0,57 "Horvet" o -0,512 a -0,550 °C".
h) pH: 6,6 a 6,8;
i) acidez: 12 a 21 ml de hidróxido de sodio 0,1 N/100 ml de leche;
j) sólidos no grasos: 82,5 gramos por litro, como mínimo.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Párrafo II
De los requisitos de la leche
Artículo 204.- La leche se clasificará en:
a) leche natural es aquella que solamente ha sidoDTO 475, SALUD
Art. Unico, Nº 59
D.O. 13.01.2000
Art. Unico, Nº 59
D.O. 13.01.2000
sometida a enfriamiento y estandarización de su
contenido de materia grasa antes del proceso de
pasteurización o tratamiento a ultra alta temperatura
(UHT) o esterilización;
b) leche reconstituida es el producto obtenido porDTO 165, SALUD
Art. Unico
D.O. 26.05.2000
Art. Unico
D.O. 26.05.2000
adición de agua potable a la leche concentrada y a
la leche en polvo, en proporción tal, que cumpla
los requisitos establecidos en el artículo 203 y
su contenido de materia grasa corresponda a alguno
de los tipos de leche señalados en el artículo 205.DTO 475, SALUD
Art. Unico, Nº 59
D.O. 13.01.2000
Art. Unico, Nº 59
D.O. 13.01.2000
Deberá ser pasteurizada , sometida a tratamiento
UHT o esterilizada;
c) leche recombinada es el producto obtenido de la
mezcla de leche descremada, grasa de leche y agua
potable en proporción tal que cumpla los requisitos
del artículo 203 y su contenido de materia grasa
corresponda a alguno de los tipos de leche señalados
en el artículo 205. Deberá ser pasteurizada, sometidaDTO 475, SALUD
Art. Unico, Nº 59
D.O. 13.01.2000
Art. Unico, Nº 59
D.O. 13.01.2000
a tratamiento UHT o esterilizada.
Párrafo II
De los requisitos de la leche
Artículo 205.- De acuerdo a su contenido de materiaDTO 214, SALUD
Art. primero II Nº14
D.O. 04.02.2006 grasa láctea la leche se clasificará en:
Art. primero II Nº14
D.O. 04.02.2006 grasa láctea la leche se clasificará en:
EliminadDTO 475, SALUD
Art. Unico, Nº 60
D.O. 13.01.2000a
Art. Unico, Nº 60
D.O. 13.01.2000a
Leche entera es aquella con un contenido superior
a 30 g de materia grasa por litro.
Leche parcialmente descremada es aquella con un
contenido máximo de 30 g de materia grasa y un mínimo
superior a 5 g por litro.
Leche descremada es aquella con un contenido máximo
de hasta 5 gramos por litro de materia grasa.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Párrafo III
De la pasteurización de la leche
Artículo 206.- La leche cruda enviada a la planta por el productor será sometida a lo menos a las siguientes pruebas de control:
Pruebas de aceptación o rechazo:
a) eberán corresponder a las características estipuladas en el artículo 203;
b) alcohol Decreto 71, SALUD
Art. 1 N° 5
D.O. 06.03.2019entre 68% v/v y 75% v/v".
Art. 1 N° 5
D.O. 06.03.2019entre 68% v/v y 75% v/v".
En el caso de que la leche sea aceptada por laDTO 475, SALUD
Art. Unico, Nº 61
D.O. 13.01.2000 planta y deba ser sometida a clasificación, podrán efectuarse las siguientes pruebas:
Art. Unico, Nº 61
D.O. 13.01.2000 planta y deba ser sometida a clasificación, podrán efectuarse las siguientes pruebas:
a) reductasa (azul de metileno) o recuento de microorganismos totales en leches no refrigeradas;
b) recuento de microorganismos aerobios mesófilos y psicrófilos en leches refrigeradas;
c) detección de inhibidores;
d) células somáticas.
Párrafo III
De la pasteurización de la leche
Artículo 207.- Las Decreto 71, SALUD
Art. 1 N° 6
D.O. 06.03.2019leches crudas deberán ser sometidas a tratamientos microbicidas, tales como: pasteurización, temperatura ultra alta, centrifugación, esterilización u otros, inmediatamente después de su recepción en la planta o conservarse por tiempos y temperaturas que impidan la multiplicación bacteriana de modo de dar cumplimiento a lo dispuesto en los artículos 61 y 62 del presente reglamento. Para lo anterior, las plantas que reciban leche deberán mantener registros sobre las validaciones realizadas que demuestren que tales relaciones de tiempo-temperatura impiden la multiplicación bacteriana y de las verificaciones del cumplimiento de esos tiempos y temperaturas conforme a lo dispuesto en el artículo 69 de este reglamento.
Art. 1 N° 6
D.O. 06.03.2019leches crudas deberán ser sometidas a tratamientos microbicidas, tales como: pasteurización, temperatura ultra alta, centrifugación, esterilización u otros, inmediatamente después de su recepción en la planta o conservarse por tiempos y temperaturas que impidan la multiplicación bacteriana de modo de dar cumplimiento a lo dispuesto en los artículos 61 y 62 del presente reglamento. Para lo anterior, las plantas que reciban leche deberán mantener registros sobre las validaciones realizadas que demuestren que tales relaciones de tiempo-temperatura impiden la multiplicación bacteriana y de las verificaciones del cumplimiento de esos tiempos y temperaturas conforme a lo dispuesto en el artículo 69 de este reglamento.
Se entiende por tratamientos microbicidas las medidas de control que reducen sustancialmente o eliminan el número de microorganismos presentes en los alimentos.
Los tratamientos microbicidas señalados anteriormente no serán exigibles cuando los productores expendan leche directamente al público en las condiciones señaladas en el artículo 94 del presente reglamento".
Artículo 208.- Para el almacenamiento de lasDTO 214, SALUD
Art. primero II Nº12
D.O. 04.02.2006 leches, las plantas dispondrán de estanques cerrados fijos que aseguren la conservación de la temperatura, premunidos de termómetros o sensores de temperatura para el control correspondiente. Todo estanque, utensilio u otro elemento, deberá ser de material inoxidable y no contaminante y de fácil aseo y desinfección.
Art. primero II Nº12
D.O. 04.02.2006 leches, las plantas dispondrán de estanques cerrados fijos que aseguren la conservación de la temperatura, premunidos de termómetros o sensores de temperatura para el control correspondiente. Todo estanque, utensilio u otro elemento, deberá ser de material inoxidable y no contaminante y de fácil aseo y desinfección.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Artículo 209.- Los equipos de pasteurización tendrán dispositivos que verifiquen el correcto tratamiento de las leches, entre otros, un termómetroDTO 214, SALUD
Art. primero II Nº12
D.O. 04.02.2006 que indique directamente la temperatura de pasteurización y un termógrafo para registrar la temperatura y el tiempo de tratamiento.
Art. primero II Nº12
D.O. 04.02.2006 que indique directamente la temperatura de pasteurización y un termógrafo para registrar la temperatura y el tiempo de tratamiento.
Los gráficos de cada tratamiento deberán guardarse durante seis meses, para su control por la autoridad sanitaria.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Artículo 210.- Se prohíbe la repasteurización de la leche o leches devueltas o sobrantes alteradas.DTO 214, SALUD
Art. primero II Nº16
D.O. 04.02.2006 Estas leches no podrán ser destinadas a la elaboración de alimentos de consumo humano.
Art. primero II Nº16
D.O. 04.02.2006 Estas leches no podrán ser destinadas a la elaboración de alimentos de consumo humano.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Párrafo IV
Del envase, conservación y expendio de la leche pasteurizada
Artículo 211.- Inmediatamente después de pasteurizada las leches, deberán ser enfriadas a unaDTO 214, SALUD
Art. primero II Nº17
D.O. 04.02.2006 temperatura no superior a 4°C, envasadas y conservadas a esta misma temperatura hasta el momento de su distribución, excepto las tratadas por el proceso UHT.
Art. primero II Nº17
D.O. 04.02.2006 temperatura no superior a 4°C, envasadas y conservadas a esta misma temperatura hasta el momento de su distribución, excepto las tratadas por el proceso UHT.
Las leches pasteurizadas deberá dar la prueba de fosfatasa negativa.
Toda Decreto 48, SALUD
Art. 1°, N° 1
D.O. 05.07.2022la leche líquida, después de haber sido sometida a los procesos térmicos señalados, que sea usada como materia prima o para consumo directo, deberá ser fortificada con vitamina D3 (colecalciferol) de la siguiente manera:
Art. 1°, N° 1
D.O. 05.07.2022la leche líquida, después de haber sido sometida a los procesos térmicos señalados, que sea usada como materia prima o para consumo directo, deberá ser fortificada con vitamina D3 (colecalciferol) de la siguiente manera:
- Leche líquida/fluida: Una dosis única de 1 µg/100ml, la que podrá excederse hasta en un 40%, llegando a 1,4 µg/100ml.
La verificación de la fortificación de la leche líquida se realizará en la leche fluida usada como materia prima en otros alimentos, o bien, utilizada para el consumo directo. En consecuencia, se excluirá la verificación de fortificación a aquellos productos elaborados a partir de la leche líquida o de sus subproductos.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Artículo 212.- Las plantas deberán vender lasDTO 214, SALUD
Art. primero II Nº18
D.O. 04.02.2006 leches pasteurizadas en envases herméticamente cerrados y sellados para evitar su contaminación. Estos envases deberán cumplir con los requisitos establecidos en el
Art. primero II Nº18
D.O. 04.02.2006 leches pasteurizadas en envases herméticamente cerrados y sellados para evitar su contaminación. Estos envases deberán cumplir con los requisitos establecidos en el
presente reglamento.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Párrafo V
De los productos lácteos
Artículo 213.- Leche saborizada es el producto obtenido a partir de la leche entera, parcialmente descremada o descremada pasteurizada , sometidaDTO 475, SALUD
Art. Unico, Nº 62
D.O. 13.01.2000 a tratamiento UHT o esterilizada, a la que se ha adicionado saborizantes, aromatizantes, edulcorantes y estabilizantes autorizados en el presente reglamento con el objeto de obtener un producto con caracteres organolépticos diferentes.
Art. Unico, Nº 62
D.O. 13.01.2000 a tratamiento UHT o esterilizada, a la que se ha adicionado saborizantes, aromatizantes, edulcorantes y estabilizantes autorizados en el presente reglamento con el objeto de obtener un producto con caracteres organolépticos diferentes.
ARTÍCULO 214. Leches concentradasDecreto 82,
SALUD
Art. 1° N° 1
D.O. 26.01.2023 son aquellas que han sido privadas parcialmente de su contenido de agua, se clasifican en:
SALUD
Art. 1° N° 1
D.O. 26.01.2023 son aquellas que han sido privadas parcialmente de su contenido de agua, se clasifican en:
a) Leche evaporada es el producto líquido obtenido por eliminación parcial del agua de la leche.
b) Leche condensada es el producto proveniente de la leche obtenido por evaporación parcial del agua, de consistencia espesa que usualmente es de sabor dulce, pudiendo tener adición de azúcares, edulcorantes, polioles, fibras u otros ingredientes permitidos.
La acidez de las leches concentradas no excederá de 50 ml de hidróxido de sodio 0,1 N/100 g y la prueba de fosfatasa deberá ser negativa.
Artículo 215.- Sólo se podrá utilizar en la elaboración de leches concentradas los siguientesDTO 214, SALUD
Art. primero II Nº19
D.O. 04.02.2006 aditivos: fosfato disódico, fosfato tricálcico, citrato de sodio, cloruro de calcio y carbonato de sodio, en dosis máxima del producto final de 2 g/kg, solos o en combinación, y expresados como sustancias anhidras; saborizantes y colorantes autorizados. En la leche evaporada se podrá utilizar, además, carragenina en una dosis máxima de 150 mg/kg.
Art. primero II Nº19
D.O. 04.02.2006 aditivos: fosfato disódico, fosfato tricálcico, citrato de sodio, cloruro de calcio y carbonato de sodio, en dosis máxima del producto final de 2 g/kg, solos o en combinación, y expresados como sustancias anhidras; saborizantes y colorantes autorizados. En la leche evaporada se podrá utilizar, además, carragenina en una dosis máxima de 150 mg/kg.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Artículo 216.- La Decreto 38, SALUD
Art. 1 N° 3
D.O. 02.02.2021leche en polvo y la crema o nata de leche en polvo son los productos obtenidos por la eliminación parcial del agua que contiene la leche; contendrán un máximo de 5% de humedad, sin considerar el agua de cristalización de la lactosa, y el contenido mínimo de proteínas de la leche en el extracto seco magro no deberá ser menor a 34% m/m incluyendo el agua de cristalización de la lactosa.
Art. 1 N° 3
D.O. 02.02.2021leche en polvo y la crema o nata de leche en polvo son los productos obtenidos por la eliminación parcial del agua que contiene la leche; contendrán un máximo de 5% de humedad, sin considerar el agua de cristalización de la lactosa, y el contenido mínimo de proteínas de la leche en el extracto seco magro no deberá ser menor a 34% m/m incluyendo el agua de cristalización de la lactosa.
Leche entera en polvo es aquella que contiene un mínimo de 26% m/m de materia grasa de la leche.
Leche en polvo parcialmente descremada o semidescremada es aquella que contiene más del 1,5% y menos del 26% m/m de materia grasa de la leche.
Leche en polvo descremada es aquella que contiene un máximo de 1,5% m/m de materia grasa de la leche.
La crema o nata en polvo deberá contener, como mínimo, un 42% m/m de materia grasa de la leche.
El contenido de grasa y/o proteínas podrá ajustarse, únicamente, para cumplir con los requisitos de composición estipulados en este artículo, mediante incorporación y/o extracción de los constituyentes de la leche, de manera que no se modifique la proporción entre la proteína del suero y la caseína de la leche utilizada como materia prima.
Podrá agregársele fluoruro bajo los límites que señale la norma técnica que, para estos efectos, dicte el Ministerio de Salud.
Toda Decreto 48, SALUD
Art. 1°, N° 2
D.O. 05.07.2022la leche en polvo, que sea usada como materia prima o para consumo directo, deberá ser fortificada con vitamina D3 (colecalciferol) de la siguiente manera:
Art. 1°, N° 2
D.O. 05.07.2022la leche en polvo, que sea usada como materia prima o para consumo directo, deberá ser fortificada con vitamina D3 (colecalciferol) de la siguiente manera:
- Leche en polvo: Una dosis única de 10 µg/100g, la que podrá excederse hasta en un 40%, llegando a 14 µg/100g.
La leche en polvo que provenga de otros países podrá venir fortificada desde el origen, o ser fortificada en Chile, previo a su comercialización.
La verificación de la fortificación de la leche en polvo se realizará en las plantas que elaboran o reenvasan dicho producto, sea ésta para ser usada como materia prima para otros alimentos, o bien, para el consumo directo. En consecuencia, se excluirá la verificación de fortificación a aquellos productos elaborados a partir de la leche en polvo o de sus subproductos.
ARTÍCULO 219. Manjar o dulce de lecheDecreto 82,
SALUD
Art. 1° N° 2
D.O. 26.01.2023 es el producto obtenido a partir de leches cocidas adicionadas o no de azúcares, edulcorantes, polioles, fibras u otros ingredientes permitidos que, por efecto del calor, adquiere su color característico. El contenido de sólidos totales de leche será 25,5% como mínimo y no contendrá más de 35% de agua. Se le podrá adicionar sustancias amiláceas sólo al producto destinado a repostería. Esta condición deberá declararse en el envase, con una frase como "manjar de repostería" u otra similar.
SALUD
Art. 1° N° 2
D.O. 26.01.2023 es el producto obtenido a partir de leches cocidas adicionadas o no de azúcares, edulcorantes, polioles, fibras u otros ingredientes permitidos que, por efecto del calor, adquiere su color característico. El contenido de sólidos totales de leche será 25,5% como mínimo y no contendrá más de 35% de agua. Se le podrá adicionar sustancias amiláceas sólo al producto destinado a repostería. Esta condición deberá declararse en el envase, con una frase como "manjar de repostería" u otra similar.
Artículo 220.- Yogur es el producto lácteo coagulado obtenido por fermentación láctica mediante la acción de Lactobacillus bulgaricus y Streptococcus thermophilus, a partir de leches pasteurizadasDTO 214, SALUD
Art. primero II Nº23
D.O. 04.02.2006 enteras, parcialmente descremadas o descremadas, leches en polvo enteras, parcialmente descremadas o descremadas o una mezcla de estos productos.
Art. primero II Nº23
D.O. 04.02.2006 enteras, parcialmente descremadas o descremadas, leches en polvo enteras, parcialmente descremadas o descremadas o una mezcla de estos productos.
En su elaboración se podrá adicionar:
a) ingredientes aromatizantes naturales: frutasDTO 475, SALUD
Art. Unico, Nº 64
D.O. 13.01.2000 (fresca, en conserva, congelada, en polvo, puré, pulpa, jugo), cereales, miel, chocolate, cacao, nueces, café, especias y otros aromatizantes autorizados;
Art. Unico, Nº 64
D.O. 13.01.2000 (fresca, en conserva, congelada, en polvo, puré, pulpa, jugo), cereales, miel, chocolate, cacao, nueces, café, especias y otros aromatizantes autorizados;
b) azúcar y/o edulcorantes autorizados de acuerdo a lo señalado en el artículo 146 del presente reglamento;
c) aditivos alimentarios autorizados: aromatizantes, colorantes, estabilizantes y como preservante ácido sórbico y sus sales de sodio y potasio, cuya dosis máxima será de 500 mg/kg expresada como ácido sórbico.
d) cultivos de bacterias adecuadas productoras deDTO 475, SALUD
Art. Unico, Nº 64
D.O. 13.01.2000 ácido láctico.
Art. Unico, Nº 64
D.O. 13.01.2000 ácido láctico.
Los microorganismos lácticos presentes en el producto final deberán ser viables y en cantidad superior a 10 6 UFC/g DTO 475, SALUD
Art. Unico, Nº 64
D.O. 13.01.2000.
Art. Unico, Nº 64
D.O. 13.01.2000.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Artículo 221.- Crema de leche es el producto lácteo relativamente rico en grasa separada de las leches que adoptan la forma de emulsión tipoDTO 214, SALUD
Art. primero II Nº24
D.O. 04.02.2006 leches descremadas con grasa. Su contenido de materia grasa deberá rotularse en forma destacada.
Art. primero II Nº24
D.O. 04.02.2006 leches descremadas con grasa. Su contenido de materia grasa deberá rotularse en forma destacada.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Artículo 222.- Se podrá utilizar en la elaboración de crema de leche, los siguientes aditivos:
a) secuestrantes y emulsionantes autorizados en unaDTO 68, SALUD
Art. primero Nº 14
D.O. 23.01.2006 dosis máxima en el producto final de 2g/kg solos o 3 g/kg mezclados expresados como sustancias anhidras;
Art. primero Nº 14
D.O. 23.01.2006 dosis máxima en el producto final de 2g/kg solos o 3 g/kg mezclados expresados como sustancias anhidras;
b) espesantes autorizados en una dosis máxima en elDTO 475, SALUD
Art. Unico, Nº 66
D.O. 13.01.2000 producto final de 5 g/kg solos o mezclados; c) aromatizantes autorizados.
Art. Unico, Nº 66
D.O. 13.01.2000 producto final de 5 g/kg solos o mezclados; c) aromatizantes autorizados.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Decreto 65, SALUD
Art. 1 N° 1
D.O. 29.11.2013 Artículo 223.- La acidez de la crema de leche no excederá de 20 ml de NaOH 0,1 N/100 g.
Art. 1 N° 1
D.O. 29.11.2013 Artículo 223.- La acidez de la crema de leche no excederá de 20 ml de NaOH 0,1 N/100 g.
El expendio de las cremas de leche se hará, exclusivamente, en los envases originales.
En la crema de leche pasteurizada deberá indicarse claramente el código de lote y la fecha de vencimiento y, además, que se debe mantener a una temperatura inferior a 4ºC.
Se prohíbe el expendio de crema cruda.
Decreto 65, SALUD
Art. 1 N° 2
D.O. 29.11.2013 Artículo 224.- Se denominará "bebida láctea" a los productos elaborados con base en leche, con un mínimo de 30% de leche en el producto final, tal como se consume de acuerdo a la definición de leche líquida y en polvo establecida en los artículos 198 y 216, a sus características señaladas en el artículo 203 y a sus clasificaciones listadas en los artículos 204 y 205, todos del presente reglamento. Podrá tener agregados de otros ingredientes alimentarios, como nutrientes, factores alimentarios y aditivos permitidos. La bebida láctea se podrá presentar líquida lista para el consumo o en polvo para reconstituir con un líquido apropiado antes del consumo. En el rótulo se deberá etiquetar su denominación "bebida láctea", de acuerdo a la letra a) del artículo 107 del Reglamento Sanitario de los Alimentos, y el porcentaje de leche que contiene. Los límites de acidez adecuados para los productos no fermentados ni acidificados son entre 11 y 18 ml de NaOH 0,1 N/100 g. Los parámetros microbiológicos se regirán por el artículo 173 puntos 1.2, 1.3, 1.4 y 9.2 de este reglamento, según la presentación del producto tal como se comercializa.
Art. 1 N° 2
D.O. 29.11.2013 Artículo 224.- Se denominará "bebida láctea" a los productos elaborados con base en leche, con un mínimo de 30% de leche en el producto final, tal como se consume de acuerdo a la definición de leche líquida y en polvo establecida en los artículos 198 y 216, a sus características señaladas en el artículo 203 y a sus clasificaciones listadas en los artículos 204 y 205, todos del presente reglamento. Podrá tener agregados de otros ingredientes alimentarios, como nutrientes, factores alimentarios y aditivos permitidos. La bebida láctea se podrá presentar líquida lista para el consumo o en polvo para reconstituir con un líquido apropiado antes del consumo. En el rótulo se deberá etiquetar su denominación "bebida láctea", de acuerdo a la letra a) del artículo 107 del Reglamento Sanitario de los Alimentos, y el porcentaje de leche que contiene. Los límites de acidez adecuados para los productos no fermentados ni acidificados son entre 11 y 18 ml de NaOH 0,1 N/100 g. Los parámetros microbiológicos se regirán por el artículo 173 puntos 1.2, 1.3, 1.4 y 9.2 de este reglamento, según la presentación del producto tal como se comercializa.
Se denominará "leche con..." a los productos elaborados a partir de leche que cumple con la definición de "leche" señalada en los artículos 198 y 216 del Reglamento Sanitario de los Alimentos, estando presente en una proporción igual o mayor al 75% de leche por porción en el producto final, tal como se consume, al que se le podrán adicionar otros ingredientes alimentarios, tales como: concentrados de frutas, proteínas de soya, sólidos lácteos, aceites vegetales, nutrientes, factores alimentarios y aditivos permitidos. La "leche con..." se podrá presentar líquida lista para el consumo o en polvo para reconstituir con un líquido apropiado antes del consumo. En el rótulo se deberá etiquetar su denominación "leche con..." de acuerdo a la letra a) del artículo 107 del presente reglamento. Los parámetros microbiológicos se regirán por el artículo 173 puntos 1.2, 1.3, 1.4 y 9.2 del Reglamento Sanitario de los Alimentos, según la presentación del producto tal como se comercializa.
Párrafo VI
De las mantequillas
Artículo 225.- Mantequilla, Decreto 37, SALUD
Art. 1 N° 1
D.O. 18.01.2017sin otra denominación, es el producto lácteo derivado exclusivamente de la crema pasteurizada de leches.
Art. 1 N° 1
D.O. 18.01.2017sin otra denominación, es el producto lácteo derivado exclusivamente de la crema pasteurizada de leches.
Los productos que usen la expresión de fantasía "mantequilla de.", sin tratarse de un producto lácteo, deberán rotular, además, el nombre del alimento de que se trate, en los términos exigidos por la letra a) del artículo 107 del presente reglamento, informando la verdadera naturaleza del producto en forma específica.
Artículo 226.- Mantequilla de suero es el producto lácteo derivado exclusivamente de la crema del suero de la leche.
Artículo 227.- La mantequilla deberá responder a las siguientes características:
a) caracteres organolépticos normales;
b) materia grasa de leche : mínimo 80%;
c) sólidos no grasos de leche : máximo 2%;
d) humedad : máximo 16%;
e) acidez de la materia grasa : máximo 18 ml de hidróxido de sodio 0.1 N/100 g;
f) índice de peróxidos de la materia grasa en la planta : máximo 0,3 meq 0 2/kg de grasa;
g) punto de fusión : 28 - 37ºC;
h) índice de refracción a 40ºC : 1,4546 - 1,4569;
i) grado de refracción a 40ºC: 40 - 45;
j) índice de yodo : 32 - 45;
k) índice de saponificación : 211 - 237;
l) su composición en ácidos grasos y triglicéridos serán los de la grasa láctea.
Artículo 228.- Mantequilla fermentada es aquella elaborada a partir de cremas fermentadas. Deberá cumplir con las características del artículo 227, exceptuando los parámetros de acidez.
Artículo 229.- Toda mantequilla deberá expenderse envasada, rotulada y mantenerse refrigerada.
Artículo 230.- Grasa de mantequilla (butter oil), grasa de mantequilla deshidratada y grasa de leche anhidra, son productos obtenidos exclusivamente a partir de mantequilla o crema debidamente pasteurizada y que resultan de eliminar prácticamente la totalidad del contenido de agua y del extracto seco magro.
Artículo 231.- La grasa de mantequilla deberá contener:
a) materia grasa : mínimo 99,3%;
b) humedad : máximo 0,5%;
c) índice de peróxidos : máximo 0,8 meq oxígeno/kg de grasa;
d) ácidos grasos libres : máximo 11,6 ml de hidróxido de sodio 0.1 N/100 g.
Artículo 232.- La grasa de mantequilla deshidratada y la grasa de leche anhidra deberá contener:
a) materia grasa : mínimo 99,8%;
b) humedad : máximo 0,1%;
c) índice de peróxidos : máximo 0,3 meq oxígeno/kg de grasa;
d) ácidos grasos libres : máximo 11,6 ml de hidróxido de sodio 0.1 N/100 g.
Artículo 233.- La grasa de mantequilla, grasa de mantequilla deshidratada y grasa de leche anhidra no destinadas al consumo directo ni para empleo en leche recombinada o productos lácteos recombinados, solo podrán contener como antioxidantes, los siguientes aditivos y en las cantidades señalas en el Título III de este reglamento:
Galatos de propilo, octilo y dodecilo Butil-hidroxianisol (B.H.A.) Butil-hidroxitolueno (B.H.T.)
Párrafo VII
De los quesos
Artículo 234.- Queso es el producto madurado o sin madurar, sólido o semisólido, obtenido coagulando leches, leches descremadas, leches parcialmenteDTO 214, SALUD
Art. primero II Nº25
D.O. 04.02.2006 descremadas, crema, crema de suero, suero de queso o suero de mantequilla debidamente pasteurizado o una combinación de estas materias, por la acción de cuajo u otros coagulantes apropiados (enzimas específicas o ácidos orgánicos permitidos), y separando parcialmente el suero que se produce como consecuencia de tal coagulación.
Art. primero II Nº25
D.O. 04.02.2006 descremadas, crema, crema de suero, suero de queso o suero de mantequilla debidamente pasteurizado o una combinación de estas materias, por la acción de cuajo u otros coagulantes apropiados (enzimas específicas o ácidos orgánicos permitidos), y separando parcialmente el suero que se produce como consecuencia de tal coagulación.
Queso Artesanal es el queso elaborado, enDTO 214, SALUD
Art. primero II Nº25
D.O. 04.02.2006 Plantas Queseras Familiares, con leches producidas exclusivamente en el mismo predio donde se fabrica este alimento y cuya producción diaria no exceda los 500 litros. La producción, elaboración, envase, almacenamiento, distribución y venta de estos productos deberá ceñirse a lo establecido en el presente reglamento y a las normas técnicas sobre directrices para la elaboración de quesos artesanales aprobadas por resolución del Ministerio de Salud, la que se publicará en el Diario Oficial.
Art. primero II Nº25
D.O. 04.02.2006 Plantas Queseras Familiares, con leches producidas exclusivamente en el mismo predio donde se fabrica este alimento y cuya producción diaria no exceda los 500 litros. La producción, elaboración, envase, almacenamiento, distribución y venta de estos productos deberá ceñirse a lo establecido en el presente reglamento y a las normas técnicas sobre directrices para la elaboración de quesos artesanales aprobadas por resolución del Ministerio de Salud, la que se publicará en el Diario Oficial.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que las modificaciones introducidas al presente artículo rigen a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que las modificaciones introducidas al presente artículo rigen a contar de 180 días desde su publicación.
Artículo 235.- En Decreto 71, SALUD
Art. 1 N° 7
D.O. 06.03.2019aquellas localidades donde no rija la exigencia de la Ley Nº4869 de pasteurización de la leche, todos los quesos deberán tener un período de maduración previo no menor a 30 días para su comercialización.
Art. 1 N° 7
D.O. 06.03.2019aquellas localidades donde no rija la exigencia de la Ley Nº4869 de pasteurización de la leche, todos los quesos deberán tener un período de maduración previo no menor a 30 días para su comercialización.
Artículo 236.- Para su elaboración a los quesos se le podrá adicionar:
a) cultivos de bacterias productoras de ácido láctico;
b) cultivos de hongos o bacterias específicas para quesos de características especiales;
c) cuajo u otras enzimas apropiadas para la coagulación;
d) cloruro de sodio;
e) agua;
f) cloruro de calcio;
g) nitrato de sodio o potasio: máximo 50 mg/kg de queso;DTO 475, SALUD
Art. Unico, Nº 67
D.O. 13.01.2000
Art. Unico, Nº 67
D.O. 13.01.2000
h) caroteno, carotenoides, rocú o anato y riboflavina, solos o mezclados;
i) sustancias aromatizantes o saborizantes naturales autorizadas;
j) ácido cítrico y/o láctico;DTO 115, SALUD
Art. primero Nº 15
D.O. 25.11.2003
Art. primero Nº 15
D.O. 25.11.2003
k) frutos, semillas y especias.
NOTA:
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
Artículo 237.- Queso fresco y quesillo son aquellos quesos de elaboración reciente que no han sufridoDTO 214, SALUD
Art. primero II Nº26
D.O. 04.02.2006 ninguna transformación ni fermentación, salvo la láctica y son preparados con leches pasteurizadas enteras, parcialmente descremadas o descremadas.
Art. primero II Nº26
D.O. 04.02.2006 ninguna transformación ni fermentación, salvo la láctica y son preparados con leches pasteurizadas enteras, parcialmente descremadas o descremadas.
Los quesos frescos y quesillos deberán serDTO 115, SALUD
Art. primero Nº 16
D.O. 25.11.2003 enfriados a una temperatura no superior a 5° C inmediatamente después de su elaboración y mantenerse a esta temperatura hasta su expendio. El producto final no podrá contener nitratos ni nitritos.
Art. primero Nº 16
D.O. 25.11.2003 enfriados a una temperatura no superior a 5° C inmediatamente después de su elaboración y mantenerse a esta temperatura hasta su expendio. El producto final no podrá contener nitratos ni nitritos.
Si en el proceso tecnológico propio de laDTO 115, SALUD
Art. primero Nº 16
D.O. 25.11.2003 elaboración de este tipo de quesos se requiere de la adición de gelatinas, se aceptará como máximo un 0,3% del producto final.
Art. primero Nº 16
D.O. 25.11.2003 elaboración de este tipo de quesos se requiere de la adición de gelatinas, se aceptará como máximo un 0,3% del producto final.
Se prohíbe el fraccionamiento de queso fresco y quesillo en los locales de expendio.
NOTA:
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
NOTA 1:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Artículo 238.- Queso maduro es el producto queDTO 475, SALUD
Art. Unico, Nº 68
D.O. 13.01.2000 requiere de un período de maduración a temperatura y en condiciones tales que se produzcan los cambios bioquímicos y físicos necesarios para obtener las características organolépticas que tipifican los quesos.
Art. Unico, Nº 68
D.O. 13.01.2000 requiere de un período de maduración a temperatura y en condiciones tales que se produzcan los cambios bioquímicos y físicos necesarios para obtener las características organolépticas que tipifican los quesos.
Artículo 239.- Queso fundido procesado untable oDTO 475, SALUD
Art. Unico, Nº 69
D.O. 13.01.2000 cortable es el producto obtenido por molienda, mezclado, fundición y emulsificación con la ayuda de calor y agentes emulsificantes de una o más variedades de queso aptos para el consumo, con o sin la adición de sólidos lácteos y otros productos alimenticios, tales como crema, mantequilla, grasa de mantequilla, cloruro de sodio y especias.
Art. Unico, Nº 69
D.O. 13.01.2000 cortable es el producto obtenido por molienda, mezclado, fundición y emulsificación con la ayuda de calor y agentes emulsificantes de una o más variedades de queso aptos para el consumo, con o sin la adición de sólidos lácteos y otros productos alimenticios, tales como crema, mantequilla, grasa de mantequilla, cloruro de sodio y especias.
A los quesos fundidos procesados untables oDTO 475, SALUD
Art. Unico, Nº 69
D.O. 13.01.2000 cortables se les podrá adicionar aditivos alimentarios autorizados en el presente reglamento.
Art. Unico, Nº 69
D.O. 13.01.2000 cortables se les podrá adicionar aditivos alimentarios autorizados en el presente reglamento.
La dosis máxima de los emulsionantes en el producto final será de 40 g/kg, solos o mezclados, pero sin que los compuestos de fósforo agregados excedan de 9 g/kg calculados como fósforo.
Artículo 240.- Los quesos podrán indicar además deDTO 475, SALUD
Art. Unico, Nº 70
D.O. 13.01.2000 los requisitos generales establecidos en este reglamento para la rotulación, el contenido mínimo de materia grasa en el extracto seco.
Art. Unico, Nº 70
D.O. 13.01.2000 los requisitos generales establecidos en este reglamento para la rotulación, el contenido mínimo de materia grasa en el extracto seco.
Artículo 241.- Cuando para la fabricación del producto se emplee leche que no sea la de vaca deberá indicarse la especie de donde procede la leche, así mismo cuando se empleen mezclas de leches.
Sólo se podrá rotular como queso los productos que cumplan con el artículo 234 de este reglamento.
Artículo 242.- Todo local de venta, que lamineDTO 475, SALUD
Art. Unico, Nº 71
D.O. 13.01.2000 quesos con antelación al expendio, deberá contar con una área adecuada para dicho propósito, la cual deberá cumplir con lo establecido en el Título I del presente reglamento.
Art. Unico, Nº 71
D.O. 13.01.2000 quesos con antelación al expendio, deberá contar con una área adecuada para dicho propósito, la cual deberá cumplir con lo establecido en el Título I del presente reglamento.
El producto laminado, deberá manipularse respetando todas las normas de higiene, procurando que su manipulación y exposición a condiciones ambientales desfavorables, sea mínima.
TITULO IX
De los helados y mezclas de helados
Artículo 243.- Helados comestibles son los productos obtenidos de una emulsión de grasa y proteínas, con la adición de otros ingredientes o, de una mezcla de agua, azúcares y otros ingredientes, que han sido tratados por congelación y mantenidos en este estado.
Artículo 244.- Los ingredientes de leches que seDTO 214, SALUD
Art. primero II Nº3
D.O. 04.02.2006 empleen en los helados y sus mezclas deberán haber sido pasteurizados o sometidos a un tratamiento térmico equivalente comprobado por la ausencia de fosfatasa.
Art. primero II Nº3
D.O. 04.02.2006 empleen en los helados y sus mezclas deberán haber sido pasteurizados o sometidos a un tratamiento térmico equivalente comprobado por la ausencia de fosfatasa.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
Artículo 245.- Mezclas para helados son productos en forma líquida o en polvo que se destinan a la preparación de helados.
Artículo 246.- No se exigirá una nueva pasteurización para los helados comestibles fabricados con ingredientes concentrados o en polvo mediante la adición exclusiva de agua potable, leches pasteurizadasDTO 214, SALUD
Art. primero II Nº27
D.O. 04.02.2006 y aromatizantes, que hayan sido congelados en el plazo de una hora después de la adición de tales sustancias.
Art. primero II Nº27
D.O. 04.02.2006 y aromatizantes, que hayan sido congelados en el plazo de una hora después de la adición de tales sustancias.
NOTA:
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
El Art. transitorio del DTO 214, Salud, publicado el 04.02.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días desde su publicación.
TITULO X
De las grasas y aceites comestibles
Párrafo I
Disposiciones generales
Artículo 247.- Aceites y grasas son los triglicéridos de ácidos grasos comercialmente puros, obtenidos de materias primas sanas y limpias, libres de productos nocivos derivados de su cultivo o manejo, o de los procesos de elaboración.
Artículo 248.- El contenido de humedad y materias volátiles, no deberá ser mayor a 0,2% en los aceites comestibles y no más de 0,5% en las mantecas o grasas. No deberán contener más de 0,25% de acidez libre, expresada como ácido oléico y no más de 50 ppm deDTO 115, SALUD
Art. primero Nº 17
D.O. 25.11.2003 jabón. A la fecha de elaboración, el límite máximo de peróxidos será de 2,5 meq de oxígeno peróxido/kg de grasa y 10 meq de oxígeno peróxido/kg de grasa en su período de vida útil y almacenados de acuerdo a lo indicado en la rotulación. No deberán presentar sus características organolépticas alteradas.
Art. primero Nº 17
D.O. 25.11.2003 jabón. A la fecha de elaboración, el límite máximo de peróxidos será de 2,5 meq de oxígeno peróxido/kg de grasa y 10 meq de oxígeno peróxido/kg de grasa en su período de vida útil y almacenados de acuerdo a lo indicado en la rotulación. No deberán presentar sus características organolépticas alteradas.
Se exceptúan Decreto 18, SALUD
Art. 1 Nº 1
D.O. 05.10.2013de esta disposición, respecto a la acidez libre, el aceite de oliva y la manteca de cacao, cuya acidez máxima será de 2,0% expresada en ácido oleico; el aceite de palta, cuya acidez máxima será de 1,0% expresada en ácido oleico, y la manteca de cerdo y grasa bovina, cuya acidez máxima será de 0,8% expresado en ácido oleico.
Art. 1 Nº 1
D.O. 05.10.2013de esta disposición, respecto a la acidez libre, el aceite de oliva y la manteca de cacao, cuya acidez máxima será de 2,0% expresada en ácido oleico; el aceite de palta, cuya acidez máxima será de 1,0% expresada en ácido oleico, y la manteca de cerdo y grasa bovina, cuya acidez máxima será de 0,8% expresado en ácido oleico.
Asimismo, se exceptúa de esta disDTO 475, SALUD
Art. Unico, Nº 72
D.O. 13.01.2000posición, respecto del índice de peróxido, el aceite de oliva extra virgen, cuyo límite máximo será de 20 meq. de oxígeno/k de aceite.
Art. Unico, Nº 72
D.O. 13.01.2000posición, respecto del índice de peróxido, el aceite de oliva extra virgen, cuyo límite máximo será de 20 meq. de oxígeno/k de aceite.
El contenido de ácidos grasos trans de origen industrial en los alimentos deberá ser igual o Decreto 106, SALUD
Art. 1 Nº 23
D.O. 23.04.2009inferior al 2% del contenido total de las grasas del producto.
Art. 1 Nº 23
D.O. 23.04.2009inferior al 2% del contenido total de las grasas del producto.
NOTA:
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
Artículo 249.- No se consideran aptos para el consumo los alimentos grasos que estén rancios, alterados química y/o microbiológicamente, que contengan materias extrañas, restos de tejidos vegetales o animales, aceites de origen mineral y aditivos noDTO 115, SALUD
Art. primero Nº 18
D.O. 25.11.2003 autorizados por el presente reglamento.
Art. primero Nº 18
D.O. 25.11.2003 autorizados por el presente reglamento.
Asimismo no se consideran aptos para el consumo humano los alimentos grasos que contengan solventes halogenados en concentración máxima individual superior a 0,1 mg/kg o concentración máxima total superior a 0,2 mg/kg.
En los aceite y grasas no se aceptará más de 2 ppb de benzopirenos ni más de 5 ppb de la suma de los 8 hidrocarburos aromáticos policíclicos volátiles. Los hidrocarburos aromáticos volátiles policíclicos relacionados son los siguientes:
Benzo (a) pireno Benzo (e) pireno Benzo (a) antraceno Benzo (b) fluoranteno Benzo (k) fluoranteno Dibenzo (a,h) antraceno Benzo (g, h, i) perileno Indeno (1,2,3 - o,d) pireno.
NOTA:
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
Decreto 71,
SALUD
Art. 1 Nº 5
D.O. 23.08.2010 Artículo 250.- La distribución y comercialización de los aceites, mantecas y grasas comestibles deberá realizarse en sus envases originales, prohibiéndose su fraccionamiento en el punto de venta.
SALUD
Art. 1 Nº 5
D.O. 23.08.2010 Artículo 250.- La distribución y comercialización de los aceites, mantecas y grasas comestibles deberá realizarse en sus envases originales, prohibiéndose su fraccionamiento en el punto de venta.
Para efectos de rotulación de los aceites, mantecas y grasas comestibles como alimentos o ingredientes alimenticios, será obligatoria la individualización del fruto, semilla o especie animal de que provienen tales productos y/o ingredientes. Se deberá declarar si los aceites, mantecas y grasas comestibles se sometieron a proceso de hidrogenación parcial y/o interesterificación y/o fraccionamiento, según sea el caso. En las mezclas de aceites, mantecas y grasas comestibles que se comercialicen como productos terminados, se deberá declarar esta condición en el listado de ingredientes como "mezcla de aceites vegetales" o "mezcla de aceites, mantecas o grasa animal" o "combinado de aceites, mantecas o grasas animales", según corresponda, listando primero el aceite, manteca o grasa que esté en mayor proporción. Se deberá incluir en el rótulo la tabla nutricional correspondiente, de acuerdo a lo establecido en el artículo 115 y último inciso del artículo 116, del presente reglamento.
Párrafo II
De los aceites y mantecas o grasas de origen vegetal
Artículo 251.- Aceites comestibles de origen vegetal son los obtenidos de los siguientes frutos o sus partes o de semillas oleaginosas: algodón, cártamo, girasol o maravilla, gérmen de maíz, maní o cacahuate, oliva, pepa de uva, raps o colza, sésamo o ajonjolí, soja o soya, avellana chilena, arroz, pepa de tomate, germen de trigo, linaza, mosqueta, palta y otrosDTO 73, SALUD
Art. 1º Nº 2
D.O. 03.08.2006 autorizados por el Ministerio de Salud, los que deberán ser de consistencia fluida a la temperatura de 15ºC.
Art. 1º Nº 2
D.O. 03.08.2006 autorizados por el Ministerio de Salud, los que deberán ser de consistencia fluida a la temperatura de 15ºC.
Artículo 252.- Los aceites no deberán contener un porcentaje de ácido erúcico mayor de 5%.
Artículo 253.- Mantecas o grasas comestibles de origen vegetal, son los alimentos grasos vegetales de consistencia sólida o semisólida a la temperatura de 15ºC, obtenidas de los siguientes frutos, sus partes o semillas: cacao, coco, coco del Paraguay, babassú, palma, palmiste y otros autorizados por el Ministerio de Salud.
Artículo 254.- Las constantes físicas y químicas de los aceites y mantecas de origen vegetal deberán corresponder a las indicadas en la tabla I. La composición de ácidos grasos determinados por cromatografía gas-líquido, señaladas en la tabla III, se considerarán como de referencia.
Párrafo III
De los aceites y mantecas o grasas comestibles de origen
animal
Artículo 255.- AceitesDecreto 29, SALUD
Art. 1 N° 1
D.O. 12.10.2016 comestibles de origen marino son los obtenidos de animales marinos y algas, con exclusión de anfibios y reptiles, de consistencia fluida a 15ºC, que no han sido sometidos a proceso de hidrogenación. Los aceites de algas deberán ser autorizados por el Ministerio de Salud.
Art. 1 N° 1
D.O. 12.10.2016 comestibles de origen marino son los obtenidos de animales marinos y algas, con exclusión de anfibios y reptiles, de consistencia fluida a 15ºC, que no han sido sometidos a proceso de hidrogenación. Los aceites de algas deberán ser autorizados por el Ministerio de Salud.
Artículo 256.- Mantecas o grasas comestibles de origen animal, son las extraídas de los tejidos adiposos de porcinos, ovinos, bovinos y aves, de consistencia sólida o semisólida. Los puntos de fusión máximos serán:
. Manteca o grasa de cerdo 40ºC
. Grasa de bovino 45ºC
. Grasa de ovino 48ºC
. Grasa de ave 30ºC
Artículo 257.- Las constantes físicas y químicas de los aceites, mantecas o grasas comestibles de origen animal deberán corresponder a las indicadas en la tabla II. La composición de ácidos grasos determinados por cromatografía de gas-líquido, señaladas en las tablas III y IV se considerarán como de referencia.
Párrafo IV
De otros alimentos grasos comestibles
Artículo 258.- Aceites Decreto 29, SALUD
Art. 1 N° 2
D.O. 12.10.2016marinos modificados comestibles son los productos grasos de consistencia fluida a la temperatura de 15°C, obtenidos de especies pelágicas y sometidos a procesos de hidrogenación y/o fraccionamiento.
Art. 1 N° 2
D.O. 12.10.2016marinos modificados comestibles son los productos grasos de consistencia fluida a la temperatura de 15°C, obtenidos de especies pelágicas y sometidos a procesos de hidrogenación y/o fraccionamiento.
Artículo 259.- Mantecas modificadas son los productos obtenidos de aceites vegetales o marinos que han sido sometidos a procesos de hidrogenación y eventualmente a transesterificación, interesterificación y fraccionamiento. Su punto de fusión máximo será de 45ºC. En materias primas se permitirán puntos de fusión mayores.
Artículo 260.- Manteca emulsionada, es la emulsión obtenida a partir de mantecas o grasas de origen animal marino y/o vegetal con agua. Deberá declararse el contenido de agua.
Artículo 261.- Aceite combinado es el producto obtenido de la mezcla de aceites de origen marino con aceites vegetales. El porcentaje máximo permitido de aceite de origen marino a agregar en la mezcla será de un 50%.
Artículo 262.- Margarina es el producto en forma de emulsión usualmente del tipo agua/aceite, obtenido de grasas y aceites comestibles. Las margarinas deberán cumplir on las siguientes características:
a) margarina de mesa es aquella cuya materia grasa presenta un punto de fusión máximo de 37ºC. Su contenido de agua será de 16% como máximo y su contenido de materia grasa será de 80% como mínimo;
Igualmente se consideran margarinas de mesaDTO 475, SALUD
Art. Unico, Nº 73
D.O. 13.01.2000
DTO 57, SALUD
Art. único Nº 9
D.O. 06.05.2005 aquellas que presenten un contenido de materia grasa menor de 80% y mayor de 16% de agua. Estas margarinas deberán indicar el contenido de agua.
Art. Unico, Nº 73
D.O. 13.01.2000
DTO 57, SALUD
Art. único Nº 9
D.O. 06.05.2005 aquellas que presenten un contenido de materia grasa menor de 80% y mayor de 16% de agua. Estas margarinas deberán indicar el contenido de agua.
b) margarina de repostería es aquella cuya materia grasa presenta un punto de fusión máximo de 45ºC.
Su contenido de agua y su uso se indicarán en la rotulación.
NOTA:
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
Artículo 263.- Las margarinas deberán cumplir con las siguientes características:
a) La acidez de la materia grasa, expresada en ácido oléico, no será superior al 0,25%;
b) Las margarinas de mesa deben contener por kg de producto terminado 30.000 U.I. de vitamina A y 70g de ácido linoleico.
Artículo 264.- Las margarinas deberán almacenarse refrigeradas o, en su defecto, mantenerlas en lugares exentos de humedad y protegidas de los rayos solares.




NOTA
Los Numerales 2, 3 y 4 del artículo 1º del Decreto 18, Salud, publicado el 05.10.2013, modifica la Tabla I Constantes físico-química de Aceites y Mantecas de Origen Vegetal y Tabla III Composición de Ácidos Grasos de Aceites y Mantecas de Origen Vegetal, de la manera indicada en la propia norma.
Los Numerales 2, 3 y 4 del artículo 1º del Decreto 18, Salud, publicado el 05.10.2013, modifica la Tabla I Constantes físico-química de Aceites y Mantecas de Origen Vegetal y Tabla III Composición de Ácidos Grasos de Aceites y Mantecas de Origen Vegetal, de la manera indicada en la propia norma.
Párrafo V
De los aceites y mantecas usados en fritura
Artículo 265.- Los aceites y mantecas utilizados en la producción industrial e institucional de alimentos fritos, deberán tener un contenido máximo de ácido linolénico de un 2%. Podrán estar adicionados deDTO 475, SALUD
Art. Unico, Nº 74
D.O. 13.01.2000 antioxidantes y sinergistas autorizados en el presente reglamento.
Art. Unico, Nº 74
D.O. 13.01.2000 antioxidantes y sinergistas autorizados en el presente reglamento.
Artículo 266.- No deberán utilizarse los aceites o mantecas cuando sobrepasen los siguientes límites:
a) acidez libre expresada como ácido oléico superiorDTO 475, SALUD
Art. Unico, Nº 75
D.O. 13.01.2000
Art. Unico, Nº 75
D.O. 13.01.2000
al 2,5%;
b) punto de humo inferior a 170°C;
c) 25% de compuestos polares como máximo.DTO 475, SALUD
Art. Unico, Nº 75
D.O. 13.01.2000
DTO 475, SALUD
Art. Unico, Nº 75
D.O. 13.01.2000
Art. Unico, Nº 75
D.O. 13.01.2000
DTO 475, SALUD
Art. Unico, Nº 75
D.O. 13.01.2000
Cuando los resultados de los análisis de la acidez libre de los aceites, expresadas como ácido oleico sobrepasen el 2,5%, el representante del establecimiento muestreado, deberá demostrar a las autoridades sanitarias que los compuestos polares del aceite en estudio no superan el 25%.
Artículo 267.- Se prohíbe el uso de los aceites y mantecas provenientes de los procesos de frituras, descartados o reprocesados, en otros alimentos de uso humano.
TITULO XI
De los alimentos cárneos
Párrafo I
De la carne de abasto
Artículo 268.- Con la denominación de carne se entiende la parte comestible de los músculos de los animales de abasto como bovinos, ovinos, porcinos, equinos, caprinos, camélidos, y de otras especies aptas para el consumo humano.
Las carnes de animales de caza en sus procedimientos de manejo, elaboración, envase, almacenamiento, Decreto 106, SALUD
Art. 1 Nº 24
D.O. 23.04.2009distribución y venta deberán ceñirse a lo establecido en el presente reglamento y a la norma técnica dictada para éstas, aprobada por decreto del Ministerio de Salud, la que se publicará en el Diario Oficial.
Art. 1 Nº 24
D.O. 23.04.2009distribución y venta deberán ceñirse a lo establecido en el presente reglamento y a la norma técnica dictada para éstas, aprobada por decreto del Ministerio de Salud, la que se publicará en el Diario Oficial.
Artículo 269.- La carne comprende todos los tejidos blandos que rodean el esqueleto, incluyendo su cobertura grasa, tendones, vasos, nervios, aponeurosis, huesos propios de cada corte cuando estén adheridos a la masa muscular correspondiente y todos los tejidos no separados durante la faena, excepto los músculos de sostén del aparato hioídeo y el esófago. Se entiende por subproducto comestible a lasDTO 475, SALUD
Art. Unico, Nº 76
D.O. 13.01.2000 partes y órganos tales como: corazón, hígado, riñones, timo, ubre, sangre, lengua, sesos o grasa, de las especies de abasto. Se exceptúan de esta categoría los pulmones y los establecidos en el artículo 274.DTO 214, SALUD
Art. primero I Nº10
D.O. 04.02.2006
Art. Unico, Nº 76
D.O. 13.01.2000 partes y órganos tales como: corazón, hígado, riñones, timo, ubre, sangre, lengua, sesos o grasa, de las especies de abasto. Se exceptúan de esta categoría los pulmones y los establecidos en el artículo 274.DTO 214, SALUD
Art. primero I Nº10
D.O. 04.02.2006
Artículo 270.- La carne recién faenada debe tenerDTO 475, SALUD
Art. Unico, Nº 77
D.O. 13.01.2000 apariencia marmórea, con superficie brillante, ligeramente húmeda y elástica al tacto. El olor y el color deben ser característicos de la especie. La grasa debe ser firme al tacto y no debe contener zonas o puntos hemorrágicos.
Art. Unico, Nº 77
D.O. 13.01.2000 apariencia marmórea, con superficie brillante, ligeramente húmeda y elástica al tacto. El olor y el color deben ser característicos de la especie. La grasa debe ser firme al tacto y no debe contener zonas o puntos hemorrágicos.
Decreto 83, SALUD
Art. 1 N° 4
D.O. 25.06.2010 Artículo 271.- Carne fresca es aquella que, aparte de haber sido refrigerada o enfriada en un rango de temperatura que va entre 0° a +7°C, según medición dispuesta en el artículo 22 del decreto Nº 94, de 2008, de los Ministerios de Agricultura y Salud, no ha recibido, a los efectos de su conservación, otro tratamiento que el envasado protector y que conserva sus características naturales.
Art. 1 N° 4
D.O. 25.06.2010 Artículo 271.- Carne fresca es aquella que, aparte de haber sido refrigerada o enfriada en un rango de temperatura que va entre 0° a +7°C, según medición dispuesta en el artículo 22 del decreto Nº 94, de 2008, de los Ministerios de Agricultura y Salud, no ha recibido, a los efectos de su conservación, otro tratamiento que el envasado protector y que conserva sus características naturales.
Decreto 83, SALUD
Art. 1 N° 5
D.O. 25.06.2010 Artículo 272.- Derogado.
Art. 1 N° 5
D.O. 25.06.2010 Artículo 272.- Derogado.
Artículo 273.- Carne congelada es aquella cuyaDTO 475, SALUD
Art. Unico, Nº 80
D.O. 13.01.2000 temperatura interna medida en el centro de la masa muscular es de -18°C como máximo. Sin embargo, para fines de transporte de las mismas, se considerarán igualmentDecreto 83, SALUD
Art. 1 N° 6
D.O. 25.06.2010e como carnes congeladas, aquellas definidas en los artículos 190 y 191 del presente reglamento.
Art. Unico, Nº 80
D.O. 13.01.2000 temperatura interna medida en el centro de la masa muscular es de -18°C como máximo. Sin embargo, para fines de transporte de las mismas, se considerarán igualmentDecreto 83, SALUD
Art. 1 N° 6
D.O. 25.06.2010e como carnes congeladas, aquellas definidas en los artículos 190 y 191 del presente reglamento.
Artículo 274.- Se prohíbe destinar los labios, ollares y las orejas de animales de abasto para el consumo directo así como formando parte de productos elaborados, incluida la carne molida, con la excepción del cerdo destinado a la elaboración de cecinas.
Artículo 275.- Carne Decreto 26, SALUD
Art. 1 N° 1
D.O. 03.10.2016molida es la carne triturada apta para el consumo humano. Se permitirá solamente su expendio:
Art. 1 N° 1
D.O. 03.10.2016molida es la carne triturada apta para el consumo humano. Se permitirá solamente su expendio:
a) A pedido y molida en presencia del comprador.
b) Envasada proveniente de establecimientos autorizados.
Las carnes molidas deberán declarar la especie animal de la que proceden y estar exentas de aditivos alimentarios, proteína vegetal y sustancias amiláceas.
Solo a la carne molida envasada en establecimientos industriales podrá adicionársele antioxidantes y preservantes autorizados.
El contenido de grasa total de la carne molida de vacuno podrá ser hasta 10%, pudiendo rotularse dicho contenido de grasa total junto con el nombre del producto. Para efectos de fiscalización de lo anterior, se aplicarán los límites de tolerancia señalados en el artículo 115 del presente reglamento.
Decreto 106, SALUD
Art. 1 Nº 25
D.O. 23.04.2009 Artículo 276.- Carne marinada de res es aquella carne proveniente de las reses de abasto, que mediante inyección u otro método adecuado, ha sido adicionada de salmuera, adobos y aditivos alimentarios permitidos. El proceso de marinado deberá ser realizado una vez finalizada la faena y en el momento en que la carne haya alcanzado una temperatura menor o igual a 7° C.
Art. 1 Nº 25
D.O. 23.04.2009 Artículo 276.- Carne marinada de res es aquella carne proveniente de las reses de abasto, que mediante inyección u otro método adecuado, ha sido adicionada de salmuera, adobos y aditivos alimentarios permitidos. El proceso de marinado deberá ser realizado una vez finalizada la faena y en el momento en que la carne haya alcanzado una temperatura menor o igual a 7° C.
Adicionalmente, el proceso de marinado deberá ser realizado de acuerdo a las buenas prácticas de manufactura (BPM), e informado en el rótulo con caracteres visibles, en la cara principal del envase, de tal modo que permita una clara identificación del proceso de marinado por parte del consumidor y que lo diferencie totalmente de su similar no sometido a dicho proceso.
Sin perjuicio de cumplir con los requisitos generales de rotulación, las carnes marinadas deberán informar además la proporción del peso que representa el marinado con respecto al peso total del producto, mediante la utilización de alguna de las siguientes frases: "Marinado al X %" o Contiene hasta un X% de marinado. "
En el caso de las carnes marinadas de reses que se vendan a granel, directamente al público, la información sobre el porcentaje de marinado se colocará en un cartel, junto al nombre del producto, de tal modo que permita una clara identificación del proceso de marinado por parte del consumidor y que lo diferencie totalmente de su similar no sometido a dicho proceso.
Decreto 106, SALUD
Art. 1 Nº 26
D.O. 23.04.2009 Artículo 277.- Sólo en establecimientos autorizados se permitirá la tenencia, almacenamiento, distribución y venta de carnes de bovinos, ovinos, caprinos, porcinos, equinos y otras especies aptas para el consumo humano.
Art. 1 Nº 26
D.O. 23.04.2009 Artículo 277.- Sólo en establecimientos autorizados se permitirá la tenencia, almacenamiento, distribución y venta de carnes de bovinos, ovinos, caprinos, porcinos, equinos y otras especies aptas para el consumo humano.
Su venta directa al público, mediante sistema de autoservicio, se realizará en envases individuales, los que deberán cumplir con las disposiciones sobre envase y rotulación de este reglamento.
Los establecimientos que expendan carnes de especies diferentes al bovino, deberán indicar claramente al consumidor la especie de que se trata.
Artículo 278.- Se prohíbe la tenencia y comercialización de carnes y subproductos comestibles cuando:
a) estén en estado de alteración organoléptica debido a causas
físicas, químicas o biológicas;
b) provengan de animales mortecinos o de fetos;
c) se consideren no aptas para el consumo por la autoridad
sanitaria.
d) no provenga de establecimientos autorizadosDTO 475, SALUD
Art. Unico, Nº 84
D.O. 13.01.2000
Art. Unico, Nº 84
D.O. 13.01.2000
para el faenamiento.
Artículo 279.- Se prohíbe la comercialización, aDTO 475, SALUD
Art. Unico, Nº 85
D.O. 13.01.2000 cualquier título de carnes, visceras y subproductos con residuos de hormonas no endógenas promotoras de crecimiento o sustancias de efecto hormonal que excedan los límites fijados por el Ministerio de Salud mediante la correspondiente norma técnica.
Art. Unico, Nº 85
D.O. 13.01.2000 cualquier título de carnes, visceras y subproductos con residuos de hormonas no endógenas promotoras de crecimiento o sustancias de efecto hormonal que excedan los límites fijados por el Ministerio de Salud mediante la correspondiente norma técnica.
Si durante la inspección post-mortem hubiera indicios de que la carne o las visceras pudieran exceder los límites de residuos fijados por el Ministerio de Salud, éstas se retendrán, se identificarán, se mantendrán en condiciones adecuadas y se someterán a todos los exámenes de laboratorio necesarios para comprobar su inocuidad. De resultar, como producto de estos exámenes, niveles de residuos por sobre los límites establecidos, el dictamen final será ''no apto para consumo humano''. Cuando no sea posible mantener la carne y las visceras en condiciones adecuadas, en espera de los resultados de laboratorio, la declaración de inaptitud se hará de inmediato.
En toda importación de carne y subproductos comestibles, la autoridad sanitaria podrá requerir que se acredite mediante certificado oficial de origen que los residuos de hormonas, promotores de crecimiento y sustancias de efecto hormonal de uso veterinario están bajo los límites establecidos.
Artículo 280.- Sin perjuicio de lo establecido enDTO 475, SALUD
Art. Unico, Nº 85
D.O. 13.01.2000 el artículo precedente, se prohíbe la comercialización, a cualquier título, de carnes y sus subproductos con residuos de plaguicidas, residuos de medicamentos de uso veterinario y de aditivos, usados en la alimentación animal, que estén por sobre los límites de tolerancia fijados. El Ministerio de Salud fijará mediante la dictación de la correspondiente norma técnica los límites máximos para residuos de medicamentos de uso veterinario en la carne y otros alimentos.
Art. Unico, Nº 85
D.O. 13.01.2000 el artículo precedente, se prohíbe la comercialización, a cualquier título, de carnes y sus subproductos con residuos de plaguicidas, residuos de medicamentos de uso veterinario y de aditivos, usados en la alimentación animal, que estén por sobre los límites de tolerancia fijados. El Ministerio de Salud fijará mediante la dictación de la correspondiente norma técnica los límites máximos para residuos de medicamentos de uso veterinario en la carne y otros alimentos.
En toda importación de carne y sus subproductos comestibles, la autoridad sanitaria podrá requerir que se acredite mediante certificado oficial de origen que los residuos de plaguicidas, medicamentos de uso veterinario y de aditivos usados en la alimentación animal están bajo los límites establecidos.
Párrafo II
De la carne de ave
Artículo 281.- Ave faenada es el producto de cualquiera de las especies de aves criadas en cautividad que hayan sido sacrificadas en mataderos de aves, a las que se les ha extraído la sangre, las plumas, las patas, la cabeza, el buche, la tráquea, el esófago, las vísceras, los pulmones y los órganos genitales.
Artículo 282.- Carne de ave es la parte muscular de las especies de aves a que se refiere el presente reglamento, constituida por todos los tejidos blandos que rodean la estructura del esqueleto. Incluye la piel, cobertura grasa, tendones, vasos, nervios, aponeurosis y todos aquellos tejidos que no se separan durante el faenamiento.
Artículo 283.- Ave trozada o partes de ave es cualquiera parte o partes comestibles de las aves faenadas, excluidas las menudencias y despojos.
Artículo 284.- Menudencia (menudillo o menudo ) es el conjunto de órganos constituidos por hígado sin vesícula biliar, estómago muscular (molleja) desprovisto de la mucosa y su contenido, corazón con o sin pericardio y el pescuezo desprovisto de tráquea y esófago.
Artículo 285.- Despojos corresponden a la cabeza y las patas de las aves faenadas. No se permitirá su inclusión en la cavidad abdominal de las aves faenadas.
Artículo 286.- Las aves faenadas, aves trozadas, así como las menudencias y despojos deben ser enfriadosDTO 68, SALUD
Art. primero Nº 17
D.O. 23.01.2006 a 2°C como máximo y para su expendio en el punto de venta, mantenidos a una temperatura de hasta 6ºC, medida en el interior de la masa muscular.
Art. primero Nº 17
D.O. 23.01.2006 a 2°C como máximo y para su expendio en el punto de venta, mantenidos a una temperatura de hasta 6ºC, medida en el interior de la masa muscular.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 287.- Las aves faenadas, aves trozadas, así como las menudencias y despojos que han sido sometidas a refrigeración se deben mantener a unaDTO 68, SALUD
Art. primero Nº 18
D.O. 23.01.2006 temperatura comprendida entre 4°C y -18°C.
Art. primero Nº 18
D.O. 23.01.2006 temperatura comprendida entre 4°C y -18°C.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 288.- Las aves faenadas, aves trozadas, así como las menudencias y despojos que han sido sometidos a congelación se deben mantener a una temperatura interna de -18ºC como máxima, medida en el centro de la masa muscular.
Artículo 289.- Las aves faenadas, sean éstas enfriadas, refrigeradas o congeladas, sólo se podrán comercializar y expender evisceradas.
Artículo 290.- Toda ave faenada, en el momento del empaque, deberá ser identificada con una etiqueta que indique :
a) individualización del matadero donde fueDTO 475, SALUD
Art. Unico, Nº 86
D.O. 13.01.2000
Art. Unico, Nº 86
D.O. 13.01.2000
sacrificada y de la resolución que lo autorizó;
b) fecha de vencimiento del producto.
Decreto 106, SALUD
Art. 1 Nº 27
D.O. 23.04.2009 Artículo 291.- Las aves enfriadas, refrigeradas o congeladas, enteras o trozadas de venta directa al público, mediante sistema de autoservicio, se comercializarán en envases individuales, los que deberán cumplir con las disposiciones sobre envases y rotulación de este reglamento.
Art. 1 Nº 27
D.O. 23.04.2009 Artículo 291.- Las aves enfriadas, refrigeradas o congeladas, enteras o trozadas de venta directa al público, mediante sistema de autoservicio, se comercializarán en envases individuales, los que deberán cumplir con las disposiciones sobre envases y rotulación de este reglamento.
Las aves faenadas refrigeradas o congeladas se podrán comercializar con sus menudencias, siempre que éstas estén incorporadas en la cavidad torácica, envasadas en bolsas de material plástico cerradas.
Decreto 106, SALUD
Art. 1 Nº 28
D.O. 23.04.2009 Artículo 292.- Carne marinada de ave, es aquella carne proveniente de las aves de corral, que mediante inyección u otro método adecuado, ha sido adicionada de salmuera, adobos y aditivos alimentarios permitidos. El proceso de marinado deberá ser realizado una vez finalizada la faena y en el momento en que la carcasa haya alcanzado una temperatura igual o menor a 6° C.
Art. 1 Nº 28
D.O. 23.04.2009 Artículo 292.- Carne marinada de ave, es aquella carne proveniente de las aves de corral, que mediante inyección u otro método adecuado, ha sido adicionada de salmuera, adobos y aditivos alimentarios permitidos. El proceso de marinado deberá ser realizado una vez finalizada la faena y en el momento en que la carcasa haya alcanzado una temperatura igual o menor a 6° C.
Adicionalmente, el proceso de marinado deberá ser realizado de acuerdo a las buenas prácticas de manufactura (BPM), e informado en el rótulo con caracteres visibles, en la cara principal del envase, de tal modo que permita una clara identificación del proceso de marinado por parte del consumidor y que lo diferencie totalmente de su similar no sometido a dicho proceso.
Sin perjuicio de cumplir con los requisitos generales de rotulación, las carnes marinadas deberán informar además, la proporción del peso que representa el marinado con respecto al peso total del producto, mediante la utilización de alguna de las siguientes frases: "Marinado al X %" o Contiene hasta un X % de marinado".
En el caso de las carnes marinadas de aves que se vendan a granel, directamente al público, dicha información se colocará en un cartel, junto al nombre del producto, de tal modo que permita una clara identificación del proceso de marinado por parte del consumidor y que lo diferencie totalmente de su similar no sometido a dicho proceso.
Decreto 106, SALUD
Art. 1 Nº 29
D.O. 23.04.2009 Artículo 293.- En las aves faenadas refrigeradas o congeladas no se permitirá porcentajes de agua residual mayores a los establecidos en este artículo. Se entiende por agua residual, el contenido de agua admitida en las carcasas, cuya absorción en el proceso de enfriado es técnicamente inevitable:
Art. 1 Nº 29
D.O. 23.04.2009 Artículo 293.- En las aves faenadas refrigeradas o congeladas no se permitirá porcentajes de agua residual mayores a los establecidos en este artículo. Se entiende por agua residual, el contenido de agua admitida en las carcasas, cuya absorción en el proceso de enfriado es técnicamente inevitable:
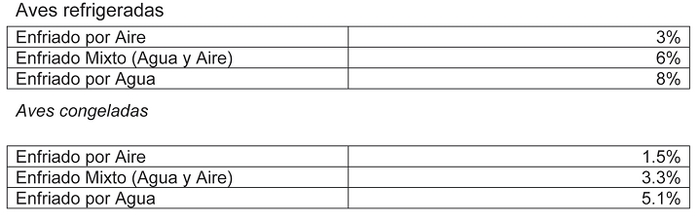
La medición del contenido de agua residual, será realizada por metodologías analíticas validadas por el Instituto de Salud Pública de Chile.
Artículo 294.- El sacrificio, tenencia, almacenamiento, distribución y venta de carne de aves, sólo se permitirá en establecimientos autorizados.
Se prohíbe la tenencia y comercialización de carnes de aves y subproductos comestibles cuando:
a) estén en estado de alteración organolépticas, sea por causas físicas, químicas o biológicas;
b) provengan de animales mortecinos;
c) contengan residuos de hormonas sintéticas o productos con actividad hormonal, residuos de productos veterinarios, antisépticos y aditivos, por sobre los niveles de tolerancias fijadas por el Ministerio de Salud mediante resolución fundada.
Párrafo III
De las cecinas
Artículo 295.- Cecinas, sin otra denominación, son aquellos productos elaborados a base de carne y grasa de vacuno o cerdo, adicionados o no de aditivos, condimentos, especias, agua o hielo.
Los productos elaborados que contengan carnes provenientes de otras especies, en cualquiera proporción, deberán declararlo en la rotulación.
Todo local de venta que fraccione cecinas conDTO 475, SALUD
Art. Unico, Nº 89
D.O. 13.01.2000 antelación al expendio, deberá contar con un lugar adecuado para dicho propósito el cual deberá cumplir con lo establecido en el Titulo I del presente reglamento.
Art. Unico, Nº 89
D.O. 13.01.2000 antelación al expendio, deberá contar con un lugar adecuado para dicho propósito el cual deberá cumplir con lo establecido en el Titulo I del presente reglamento.
El producto fraccionado deberá manipularse respetando las normas de higiene, procurando que su manipulación y exposición a condiciones ambientales desfavorables sea mínima. Queda prohibido su reenvasado y cualquierDTO 68, SALUD
Art. primero Nº 19
D.O. 23.01.2006 adulteración del envase original y su rotulación en el lugar de expendio.
Art. primero Nº 19
D.O. 23.01.2006 adulteración del envase original y su rotulación en el lugar de expendio.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 296.- Cecinas crudas frescas son aquellas que, como resultado de su elaboración, no sufren alteración significativa en los valores de aw y pHDTO 68, SALUD
Art. primero Nº 20
D.O. 23.01.2006 respecto a los de la carne fresca. Pueden o no ser sometidas a proceso de aireación, curación, secado y/o ahumado.
Art. primero Nº 20
D.O. 23.01.2006 respecto a los de la carne fresca. Pueden o no ser sometidas a proceso de aireación, curación, secado y/o ahumado.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 297.- Cecinas crudas maduradas son aquellos productos ahumados o no, sometidos a procesos de curación y maduración, de duración prolongada y que, como consecuencia de su elaboración, sufren una disminución de su pH y aw respecto a las de la carneDTO 68, SALUD
Art. primero Nº 20
D.O. 23.01.2006 fresca.
Art. primero Nº 20
D.O. 23.01.2006 fresca.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 298.- Cecinas crudas acidificadas son aquellos productos ahumados o no, que como consecuenciaDTO 68, SALUD
Art. primero Nº 20
D.O. 23.01.2006 de su elaboración sufren una disminución del valor de su pH respecto al de la carne fresca.
Art. primero Nº 20
D.O. 23.01.2006 de su elaboración sufren una disminución del valor de su pH respecto al de la carne fresca.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 299.- Cecinas cocidas son aquellosDTO 475, SALUD
Art. Unico, Nº 90
D.O. 13.01.2000
DTO 68, SALUD
Art. primero Nº 20
D.O. 23.01.2006 productos que, cualquiera sea su forma de elaboración, son sometidos a un tratamiento térmico, en que la temperatura medida en el centro del producto, no sea inferior a 68ºC.
Art. Unico, Nº 90
D.O. 13.01.2000
DTO 68, SALUD
Art. primero Nº 20
D.O. 23.01.2006 productos que, cualquiera sea su forma de elaboración, son sometidos a un tratamiento térmico, en que la temperatura medida en el centro del producto, no sea inferior a 68ºC.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 300.- Hamburguesa, sin otra denominación,DTO 68, SALUD
Art. primero Nº 21
D.O. 23.01.2006 es el producto elaborado con carne picada o molida, adicionada o no de grasa animal,, sal, aditivos permitidos y especias. Previo a la cocción, su contenido de grasa no podrá exceder de 24%.
Art. primero Nº 21
D.O. 23.01.2006 es el producto elaborado con carne picada o molida, adicionada o no de grasa animal,, sal, aditivos permitidos y especias. Previo a la cocción, su contenido de grasa no podrá exceder de 24%.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 301.- En la elaboración de cecinas y hamburguesas se permitirá usar como extensor de la carne proteínas no cárnicas autorizadas. En el caso de usar proteínas texturizadas su proporción máxima será de 10% en base seca.
INCISO SUPRIMIDODTO 68, SALUD
Art. primero Nº 22
D.O. 23.01.2006
Art. primero Nº 22
D.O. 23.01.2006
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 302.- Las cecinas crudas frescas, acidificadas y cecinas cocidas se deben mantener en refrigeración (0-6ºC) inmediatamente después de su elaboración, y en los locales de expendio al público. Las cecinas maduradas se deben mantener en lugar fresco y seco (máximo 12ºC).
Artículo 303.- El transporte y distribución de todo tipo de cecinas deberá efectuarse en vehículos autorizados bajo condiciones de refrigeración (entre 0 y 6ºC). Esta última exigencia se hará efectiva después de transcurridos 24 meses de la entrada en vigencia del presente reglamento.
Artículo 304.- Jamón es una cecina cocida yDTO 475, SALUD
Art. Unico, Nº 92
D.O. 13.01.2000 curada, preparada con carne de pierna de cerdo, entera o trozada, separada del resto en un punto posterior al extremo del hueso de la cadera y sin pernil, adicionada con agua, sal y aditivos permitidos, y con o sin otros ingredientes permitidos. Su humedad no será superior a 77%.
Art. Unico, Nº 92
D.O. 13.01.2000 curada, preparada con carne de pierna de cerdo, entera o trozada, separada del resto en un punto posterior al extremo del hueso de la cadera y sin pernil, adicionada con agua, sal y aditivos permitidos, y con o sin otros ingredientes permitidos. Su humedad no será superior a 77%.
Artículo 305.- Fiambre de jamón es una cecinaDTO 475, SALUD
Art. Unico, Nº 92
D.O. 13.01.2000 cocida y curada, preparada con carne de cerdo trozada, picada o molida, y adicionada de agua, sal, aditivos y otros ingredientes permitidos. Este producto deberá contener como mínimo 12% de proteína y un máximo de 5% de grasa libre.
Art. Unico, Nº 92
D.O. 13.01.2000 cocida y curada, preparada con carne de cerdo trozada, picada o molida, y adicionada de agua, sal, aditivos y otros ingredientes permitidos. Este producto deberá contener como mínimo 12% de proteína y un máximo de 5% de grasa libre.
Artículo 306.- Salchicha o vienesa es una cecinaDTO 475, SALUD
Art. Unico, Nº 92
D.O. 13.01.2000 cocida y curada, de masa homogénea, elaborada en base a carne de cerdo, vacuno u otras especies y adicionada con grasa o aceite, agua, sal, aditivos, con o sin cuero, y otros ingredientes permitidos. Este producto deberá contener como mínimo 12% de proteínas (N x 6,25) y un máximo 25% de grasa libre.
Art. Unico, Nº 92
D.O. 13.01.2000 cocida y curada, de masa homogénea, elaborada en base a carne de cerdo, vacuno u otras especies y adicionada con grasa o aceite, agua, sal, aditivos, con o sin cuero, y otros ingredientes permitidos. Este producto deberá contener como mínimo 12% de proteínas (N x 6,25) y un máximo 25% de grasa libre.
Artículo 307.- Cuando se usen membranas artificiales no comestibles en el embutido de cecinas, su rotulación deberá advertir que ellas deben ser retiradas antes de consumir el producto.
Artículo 308.- Se prohíbe agregar colorantesDTO 475, SALUD
Art. Unico, Nº 92
D.O. 13.01.2000 artificiales a las carnes y pastas, empleadas en la elaboración de cecinas. Se permite el uso de estos colorantes en tripas naturales y en membranas artificiales no comestibles y siempre que el colorante no difunda al contenido.
Art. Unico, Nº 92
D.O. 13.01.2000 artificiales a las carnes y pastas, empleadas en la elaboración de cecinas. Se permite el uso de estos colorantes en tripas naturales y en membranas artificiales no comestibles y siempre que el colorante no difunda al contenido.
Artículo 309.- Se prohíbe agregar sustancias amiláceas a las cecinas, salvo las que se expendan enlatadas, en cuyo caso se permitirá hasta un 5%.
Artículo 310.- En la elaboración de cecinas se permitirá el uso de nitrito de sodio, nitrato de sodio y nitrato de potasio, solos o en mezcla bajo las siguientes condiciones:
a) como "sal nitrificada". Sal nitrificada es unaDTO 475, SALUD
Art. Unico, Nº 93
D.O. 13.01.2000
Art. Unico, Nº 93
D.O. 13.01.2000
mezcla de cloruro de sodio, adicionado de nitrito
de sodio en una concentración de 0,7 a 0,8%;
b) "sales de cura" mezcla de cloruro de sodio, nitrito de
sodio, nitrato de sodio o potasio, y otros aditivos
permitidos. El porcentaje total de nitrito de sodio y
nitrato de sodio o potasio, expresado como nitrito de sodio
no debe ser superior al 10%;
c) la sal nitrificada y sales de cura deben ser elaboradas
exclusivamente en establecimientos autorizados para estos
fines por la autoridad sanitaria, quedando prohibida su
elaboración en las fábricas de cecinas.
Queda asimismo prohibido mantener nitrito de sodio, nitrato
de sodio y/o potasio como tales, en fábricas de cecinas;
d) en la sal nitrificada y las sales de cura se deberán
declarar en forma destacada en su rótulo los porcentajes de
nitrito de sodio y nitrato de sodio y/o potasio que contiene,
como asimismo sus recomendaciones de uso.
e) las sales de cura deberán ser coloreadas paraDTO 475, SALUD
Art. Unico, Nº 93
D.O. 13.01.2000
Art. Unico, Nº 93
D.O. 13.01.2000
diferenciarlas de la sal común. Para ello se
utilizará el colorante azorrubina en una cantidad
que no supere los 250 mg/kg de sal de cura.
Artículo 311.- En cecinas se permitirá:
a) un contenido máximo de 125 mg/kg de nitrito de sodio residual;
b) un contenido máximo de 30 mg/kg de nitrosaminas expresadas como nitrosodimetilamina.
Párrafo IV
De los jugos y extractos de carne
Artículo 312.- Los productos elaborados de carne y productos cárneos, comprenden entre otros:
a) jugo de carne es la parte líquida de las fibras musculares obtenida por presión y concentración al vacío, a baja temperatura. No debe contener más de 15% de cenizas totales, no más de 2,5% de cloruro de sodio y no menos de 12% de nitrógeno, calculados sobre materia seca;
b) extracto de carne es el producto resultante de la filtración y concentración, hasta consistencia pastosa, del caldo preparado con tejido muscular de reses bovinas, prácticamente libres de grasas, tendones, cartílagos y huesos. El extracto de carne de otras especies deberá expenderse con indicación precisa de la especie de origen.
El extracto de carne debe contener como mínimo 6% de creatinina total y como máximo 22% de humedad, 2% de materia grasa, 10% de cloruro de sodio y 1% de residuo insoluble;
c) gelatina es el producto obtenido del tejido colágeno o ligamentos de origen animal, en medio ácido o alcalino y que se presenta en forma de polvo, láminas o tabletas transparentes. Contendrá como mínimo 15% de nitrógeno total y un máximo de 3,5% de cenizas totales.
La solución al 1% en agua dará al enfriarse una jalea inodora.
TITULO XII
De los pescados
Artículo 313.- Pescado fresco es aquel recientemente capturado y que no ha sido sometido a ningún proceso después de su extracción, a excepción del eviscerado cuando corresponda. Desde el momentoDTO 45, SALUD
Art. único Nº 3
D.O. 12.07.2006 de la extracción se deberán adoptar las medidas necesarias para reducir la temperatura de los productos, a través de mecanismos adecuados, que no contaminen el recurso extraído.
Art. único Nº 3
D.O. 12.07.2006 de la extracción se deberán adoptar las medidas necesarias para reducir la temperatura de los productos, a través de mecanismos adecuados, que no contaminen el recurso extraído.
Durante la distribución estos productos deberán ser conservados a temperaturas no superiores a 5º C.
Artículo 314.- Pescado fresco enfriado es aquel que después de su extracción, ha sido eviscerado y enfriado a una temperatura entre 0 y 3ºC con el objeto de conservarlo durante su distribución.
Artículo 315.- Pescado congelado es aquel que recientemente capturado, es procesado y sometido a una temperatura de -18°C como máxima, medida en su centro térmico.
Artículo 316.- Pescado ahumado es aquel, que previamente salado o no, es sometido a la acción del humo de maderas duras u otro procedimiento.
Artículo 317.- Todos los pescados frescos y enfriados que se expenden o elaboren deben ser eviscerados tan pronto sean capturados, excepto algunas especies de talla reducida (sardinas, pejerreyes, anchovetas y otros).
Artículo 318.- El pescado fresco que no sea eviscerado inmediatamente después de su captura, sólo podrá comercializarse si ha sido sometido de inmediato a la congelación a temperatura de -18ªC como máxima, medida en su centro térmico.
Artículo 319.- El pescado fresco destinado a la exportación, podrá transportarse y comercializarse sin eviscerar previa autorización en tal sentido del Director del Servicio de Salud correspondiente.
Artículo 320.- El pescado fresco y el pescado fresco enfriado, deberán cumplir con las características físico-organolépticas siguientes:
a) aspecto general: buen aspecto, pigmentación bien definida, mucosidad cutánea escasa, transparente, incolora o bien ligeramente opaca;
b) olor: fresco a mar o algas frescas;
c) consistencia muscular: superficie rígida, que no se hunde a la presión del dedo o bien, si lo hace, retorna de inmediato a su condición normal. Existencia de rigor mortis o en tránsito a desaparecer;
d) ojos: el globo ocular convexo llena la cavidad orbitaria o bien se presenta ligeramente hundido. Pupilas negras y brillantes, de forma y contorno definido. Córnea transparente e iris pigmentado;
e) branquias: color rojo brillante, olor propio o neutro.
Laminillas perfectamente separadas unas de otras, de longitud similar yuxtapuestas regularmente;
f) cavidad abdominal:
- ejemplares enteros: vísceras tersas y brillantes, perladas y sin daño aparente.
- ejemplares eviscerados: peritoneo adherente, restos de sangre roja;
g) escamas: adheridas con brillo metálico.
Artículo 321.- El pescado fraccionado deberá cumplir con las siguientes características
físico-organolépticas:
a) aspecto externo
- tronco: mantener la pigmentación externa;
- medallones y filetes: color rosado traslúcido; blanquecino en carnes provenientes de pescados de carne blanca;
b) olor: fresco y propio;
c) consistencia muscular: firme, no se hunde a la presión del dedo, o bien retorna a su condición normal;
d) textura: miómeros definidos;
e) pH: máximo 6,8.
Artículo 322.- Todo local de venta que fraccioneDTO 475, SALUD
Art. Unico, Nº 94
D.O. 13.01.2000 pescado con antelación al expendio, deberá contar con un lugar adecuado para dicho propósito el cual deberá cumplir con lo establecido en el Título I del presente reglamento. El producto fraccionado, deberá manipularse respetando todas las normas de higiene, procurando que su manipulación y exposición a condiciones ambientales desfavorables sea mínima.
Art. Unico, Nº 94
D.O. 13.01.2000 pescado con antelación al expendio, deberá contar con un lugar adecuado para dicho propósito el cual deberá cumplir con lo establecido en el Título I del presente reglamento. El producto fraccionado, deberá manipularse respetando todas las normas de higiene, procurando que su manipulación y exposición a condiciones ambientales desfavorables sea mínima.
Artículo 323.- Los pescados que se comercialicenDTO 45, SALUD
Art. único Nº 4
D.O. 12.07.2006 para el consumo humano deberán estar refrigerados y exentos de parásitos y sus quistes.
Art. único Nº 4
D.O. 12.07.2006 para el consumo humano deberán estar refrigerados y exentos de parásitos y sus quistes.
Artículo 324.- Los pescados frescos, frescos enfriados y congelados no deberán contener más de:
a) 30 mg/100g de nitrógeno básico volátil total (NBVT) para peces no seláceos;
b) 70 mg/100g de nitrógeno básico volátil total (NBVT) para peces seláceos;
c) 20 mg/100g de histamina.
TITULO XIII
De los mariscos
Artículo 325.- Marisco es todo aquel animal invertebrado comestible que tiene en el agua su medio normal de vida. Comprende moluscos, crustáceos, equinodermos, tunicados y otros.
Artículo 326.- Los mariscos que pueden permanecerDTO 475, SALUD
Art. Unico, Nº 96
D.O. 13.01.2000 vivos fuera de su medio natural (bivalvos, crustáceos, equinodermos y tunicados), cuando se expendan en estado fresco, deberán ser conservados vivos hasta el momento de su venta.
Art. Unico, Nº 96
D.O. 13.01.2000 vivos fuera de su medio natural (bivalvos, crustáceos, equinodermos y tunicados), cuando se expendan en estado fresco, deberán ser conservados vivos hasta el momento de su venta.
Artículo 327.- Marisco fresco es aquel recientemente capturado y que no ha sido sometido a ningún proceso después de su extracción. DesdeDTO 45, SALUD
Art. único Nº 5
D.O. 12.07.2006 el momento de la extracción se deberán adoptar las medidas necesarias para reducir la temperatura de los productos, a través de mecanismos adecuados, que no contaminen el recurso extraído.
Art. único Nº 5
D.O. 12.07.2006 el momento de la extracción se deberán adoptar las medidas necesarias para reducir la temperatura de los productos, a través de mecanismos adecuados, que no contaminen el recurso extraído.
Durante la distribución estos productos deberán ser conservados a temperaturas no superiores a 5º C.
Artículo 328.- Marisco fresco enfriado es aquel que después de su extracción ha sido enfriado a una temperatura entre 0 y 3ªC, con el objeto de conservarlo durante su distribución.
Artículo 329.- Marisco congelado es aquel que inmediatamente después de su extracción ha sido procesado y sometido a una temperatura de -18ºC como máxima, medidos en su centro térmico.
Artículo 330.- Para evaluar el estado de frescura de los mariscos, deberán observarse las siguientes características:
Moluscos bivalvos y gastrópodos:
a) aspecto general: vivos, buen aspecto;
b) olor: fresco y propio;
c) estimulación física:cierre de valvas en bivalvos, retracción dentro o bajo la caparazón en gastrópodos.
Moluscos cefalópodos:
a) aspecto externo: pigmentación muy definida con cromatóforos intactos; piel lisa, sana e intacta;
b) olor: neutro;
c) color: propio, carne blanca, firme y nacarado;
d) tentáculos: bien adheridos al manto;
Crustáceos:
a) aspecto general: vivos, buen aspecto, ausencia de melanósis;
b) ojos: negros, brillantes y turgentes;
d) membrana tóraco-abdominal: resistente, brillante y clara;
e) olor: neutro;
Equinodermos:
a) aspecto general: vivos, buen aspecto;
b) olor: propio;
c) espículas: móviles y erectas.
Artículo 331.- Los mariscos que se comercialicenDTO 475, SALUD
Art. Unico, Nº 97
D.O. 13.01.2000 para el consumo humano deberán estar exentos de quistes de parásitos .
Art. Unico, Nº 97
D.O. 13.01.2000 para el consumo humano deberán estar exentos de quistes de parásitos .
Artículo 332.- El Nitrógeno Básico Volátil Total (N.B.V.T.), en mariscos frescos, enfriados y congelados con excepción de crustáceos, será de 30mg/100 gramos como máximo. En crustáceos no se debe sobrepasar los 60mg/100 gramos como máximo.
Artículo 333.- Decreto 20,
SALUD
Art. 1° N° 1)
D.O. 14.01.2025Los contenidos máximos de toxinas marinas en mariscos destinados al consumo humano (cuerpo entero o cualquier parte consumible por separado) deberán ser los que se indican a continuación:
SALUD
Art. 1° N° 1)
D.O. 14.01.2025Los contenidos máximos de toxinas marinas en mariscos destinados al consumo humano (cuerpo entero o cualquier parte consumible por separado) deberán ser los que se indican a continuación:
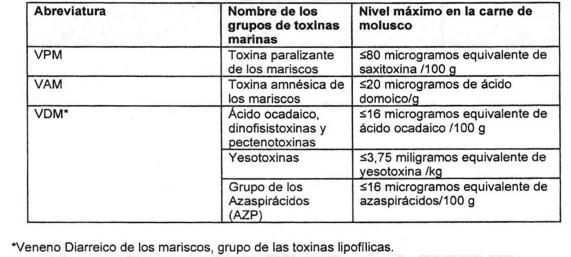
Los análisis para las determinaciones de toxinas marinas serán la prueba del bioensayo u otros métodos instrumentales reconocidos internacionalmente, los que serán establecidos mediante resolución emanada de este Ministerio.
Los análisis deberán realizarse en laboratorios reconocidos por la Autoridad Sanitaria o por laboratorios reconocidos o autorizados por otras instituciones del Estado que desarrollen acciones de diagnóstico y control para toxinas marinas.
En las áreas declaradas como afectadas por marea roja por la autoridad sanitaria, ésta establecerá, mediante resolución, las especies de mariscos cuya recolección o captura queda prohibida. En tales áreas, la autoridad sanitaria podrá autorizar, mediante resolución fundada, la recolección, captura y procesamiento industrial de mariscos contaminados con toxinas de marea roja en aquellos casos en que se demuestre que su procesamiento disminuye los niveles de toxina por debajo de los límites establecidos en el presente reglamento.
Artículo 334.- El marisco expuesto a posibles contaminaciones, sean naturales o provocadas por el hombre, deberá ser sometido a un proceso de purificación, debiendo la autoridad sanitaria controlar la inocuidad del producto purificado.
Artículo 335.- La instalación y funcionamiento de establecimientos destinados a la crianza, cultivo, engorda y purificación de mariscos destinados al consumo, así como los viveros dedicados a la comercialización de dichas especies, deberán ubicarse en lugares con agua limpia, cuyas condiciones microbiológicas permitan a los productos cumplir los requisitos establecidos en el Título V de este reglamento y contar con la autorización otorgada por el Servicio de Salud correspondiente.
TITULO XIV
De los huevos
Artículo 336.- Huevo es el óvulo completamenteDTO 90, SALUD
Art. 1°
D.O. 28.04.2000 evolucionado de la gallina. Los huevos de otras aves deben designarse con la calificación complementaria de la especie de ave que proceda.
Art. 1°
D.O. 28.04.2000 evolucionado de la gallina. Los huevos de otras aves deben designarse con la calificación complementaria de la especie de ave que proceda.
Artículo 337.- Huevo fresco es el huevo entero en suDTO 90, SALUD
Art. 1°
D.O. 28.04.2000 cáscara que no ha sufrido ningún proceso de conservación y que tiene un período de almacenaje no superior a 8 días. La cámara de aire del huevo fresco no deberá ser superior a 8 mm.
Art. 1°
D.O. 28.04.2000 cáscara que no ha sufrido ningún proceso de conservación y que tiene un período de almacenaje no superior a 8 días. La cámara de aire del huevo fresco no deberá ser superior a 8 mm.
Artículo 338.- Huevo conservado es el huevo enteroDTO 90, SALUD
Art. 1°
D.O. 28.04.2000 en su cáscara que se ha mantenido refrigerado o en un lugar fresco y que tiene un período de almacenaje no superior a 30 días. La cámara de aire no deberá ser superior a 10 mm. El envase de este tipo de huevos deberá ser rotulado con las palabras ''Huevo conservado en lugar fresco''.
Art. 1°
D.O. 28.04.2000 en su cáscara que se ha mantenido refrigerado o en un lugar fresco y que tiene un período de almacenaje no superior a 30 días. La cámara de aire no deberá ser superior a 10 mm. El envase de este tipo de huevos deberá ser rotulado con las palabras ''Huevo conservado en lugar fresco''.
Artículo 339.- Huevo refrigerado es el huevo enteroDTO 90, SALUD
Art. 1°
D.O. 28.04.2000 en su cáscara que ha sido sometido desde su producción a la acción del frío y mantenido en esas condiciones durante más de 30 días, a una temperatura máxima de 2°C y a una humedad relativa entre 80 y 90%. El pH de la clara y la yema no será mayor de 8,8 y 6,9 respectivamente; y la cámara de aire no deberá exceder de 10 mm. El envase de este tipo de huevos deberá ser rotulado con las palabras ''Huevo Refrigerado''.
Art. 1°
D.O. 28.04.2000 en su cáscara que ha sido sometido desde su producción a la acción del frío y mantenido en esas condiciones durante más de 30 días, a una temperatura máxima de 2°C y a una humedad relativa entre 80 y 90%. El pH de la clara y la yema no será mayor de 8,8 y 6,9 respectivamente; y la cámara de aire no deberá exceder de 10 mm. El envase de este tipo de huevos deberá ser rotulado con las palabras ''Huevo Refrigerado''.
Artículo 340.- Todo huevo entero en su cáscara,DTO 90, SALUD
Art. 1°
D.O. 28.04.2000 destinado a consumo directo, deberá ser transportado a los sitios de expendio en envases o bandejas nuevas.
Art. 1°
D.O. 28.04.2000 destinado a consumo directo, deberá ser transportado a los sitios de expendio en envases o bandejas nuevas.
Todos los embalajes que se usen en el transporte de los huevos (cajas o bandejas), deben ser de primer uso. Se permite el empleo de embalajes de retorno siempre que sea posible lavarlos y desinfectarlos para lograr una correcta higienización de los mismos, la eficacia de dicho proceso deberá ser verificada por la autoridad sanitaria.
Los huevos deben ser transportados en vehículos cerrados cuyas estructuras sean de materiales y construcción tal, que permitan mantener una temperatura adecuada, su limpieza y desinfección.
Artículo 341.- Queda prohibida la venta de huevosDTO 90, SALUD
Art. 1°
D.O. 28.04.2000 que presenten las siguientes alteraciones:
Art. 1°
D.O. 28.04.2000 que presenten las siguientes alteraciones:
- Manchados
- Cáscara fisurada
- Cáscara trizada o rota
- Signos de putrefacción
- Manchas de sangre
- Embriones en franco desarrollo
- Mohos y parásitos
- Alta deshidratación
- Cuerpos extraños
Artículo 342.- Huevo entero deshidratado o desecadoDTO 90, SALUD
Art. 1°
D.O. 28.04.2000 es aquel desprovisto de su cáscara y al que se le ha extraído el agua por evaporación. No deberá contener más de un 5% de agua si se usa antiaglutinante; de no hacerlo se aceptará hasta un 8% de agua. El contenido de proteínas no será menor de 45% y el de grasa 42%. No deberá contener colorantes artificiales.
Art. 1°
D.O. 28.04.2000 es aquel desprovisto de su cáscara y al que se le ha extraído el agua por evaporación. No deberá contener más de un 5% de agua si se usa antiaglutinante; de no hacerlo se aceptará hasta un 8% de agua. El contenido de proteínas no será menor de 45% y el de grasa 42%. No deberá contener colorantes artificiales.
Artículo 343.- Huevo entero líquido es aquel privadoDTO 90, SALUD
Art. 1°
D.O. 28.04.2000 de la cáscara, que conserva las proporciones naturales de la clara y de la yema, las que mezcladas dan lugar a un producto homogéneo. No se permitirá el uso de aditivos alimentarios artificiales para su conservación.
Art. 1°
D.O. 28.04.2000 de la cáscara, que conserva las proporciones naturales de la clara y de la yema, las que mezcladas dan lugar a un producto homogéneo. No se permitirá el uso de aditivos alimentarios artificiales para su conservación.
Los huevos o sus partes en estado líquido que han sido congelados deben mantenerse en envases de cierre hermético. Deberán preservarse a una temperatura inferior a -12°C, la que se mantendrá hasta la descongelación necesaria para su uso inmediato.
Artículo 344.- Se permite el agregado comoDTO 90, SALUD
Art. 1°
D.O. 28.04.2000 antiaglomerante o antihumectante al huevo en polvo de no más de 1% en peso de dióxido de silicio, y no más de 1,5% en peso de silicato de aluminio y sodio.
Art. 1°
D.O. 28.04.2000 antiaglomerante o antihumectante al huevo en polvo de no más de 1% en peso de dióxido de silicio, y no más de 1,5% en peso de silicato de aluminio y sodio.
Artículo 345.- Los establecimientos que elaborenDTO 90, SALUD
Art. 1°
D.O. 28.04.2000 huevo líquido y huevo congelado deberán someter los huevos a utilizar como materia prima a un proceso de lavado previo con agua potable de flujo continuo o adicionando a la misma, antisépticos autorizados atóxicos, en aquellos casos en que el proceso de elaboración no contemple alguna etapa tendiente a reducir la flora bacteriana tal como pasteurización u otros.
Art. 1°
D.O. 28.04.2000 huevo líquido y huevo congelado deberán someter los huevos a utilizar como materia prima a un proceso de lavado previo con agua potable de flujo continuo o adicionando a la misma, antisépticos autorizados atóxicos, en aquellos casos en que el proceso de elaboración no contemple alguna etapa tendiente a reducir la flora bacteriana tal como pasteurización u otros.
TITULO XV
De los alimentos farináceos
Párrafo I
Disposiciones generales
Artículo 346.- La denominación genérica de alimentos farináceos está reservada para designar a los productos naturales, simples o transformados, que se caracterizan por contener sustancias amiláceas como componente dominante, acompañado o no de otros nutrientes, tales como proteínas, grasas, azúcares y otros.
Párrafo II
De las harinas
Artículo 347.- Harina, sin otro calificativo, es el producto pulverulento obtenido por la molienda gradual y sistemática de granos de trigo de la especie Triticum aestivum sp. vulgare, previa separación de las impurezas, hasta un grado de extracción determinado.
Artículo 348.- El producto pulverulento proveniente de la molienda de otros granos, será designado con la palabra harina, seguida de un calificativo que indique la o las especies de grano de la que provenga.
Artículo 349.- La harina deberá responder a losDTO 475, SALUD
Art. Unico, Nº 100
D.O. 13.01.2000 siguientes requisitos:
Art. Unico, Nº 100
D.O. 13.01.2000 siguientes requisitos:
a) contener hasta un máximo de 15,0% de humedad;
b) contener hasta un máximo de 0,25% de acidez expresada en ácido sulfúrico, sobre la base de 14,0% de humedad;
c) contener hasta un máximo de 0,65% de cenizas, sobre la base de 14,0% de humedad;
d) contener hasta un máximo de 0,4% de fibra cruda sobre la base de 14,0% de humedad;
e) no contener menos de 7,0% de materias nitrogenadas (N x 5,7), sobre la base de 14,0% de humedad, y
f) ser blanca, marfil o ligeramente amarillenta.
Decreto 75, SALUD
Art. 1 Nº 1
D.O. 16.03.2010 Artículo 350.- La harina deberá contener como mínimo las siguientes cantidades de vitaminas y sales minerales:
Art. 1 Nº 1
D.O. 16.03.2010 Artículo 350.- La harina deberá contener como mínimo las siguientes cantidades de vitaminas y sales minerales:
Tiamina 6,3 mg/kg
Riboflavina 1,3 mg/kg
Niacina 13,0 mg/kg
Hierro 30,0 mg/kg
El hierro debe agregarse en forma de sulfato ferroso, en el evento de no ser esto posible podrá usarse fumarato ferroso siempre que se mantenga la equivalencia con el sulfato ferroso.
Asimismo, la harina debe contener 1,8 mg/kg de ácido fólico, sin embargo éste se aceptará que esté presente en un rango de 1,0 a 2,6 mg/kg.
La Decreto 48, SALUD
Art. 1°, N° 3
D.O. 05.07.2022harina deberá ser fortificada con vitamina D3, en la cual deberá usarse preferentemente vitamina D 3 vegetal. Cuando se utilice vitamina D 3 animal, el producto necesariamente deberá comercializarse envasado de manera que se advierta al consumidor respecto al origen animal de la vitamina D empleada.
Art. 1°, N° 3
D.O. 05.07.2022harina deberá ser fortificada con vitamina D3, en la cual deberá usarse preferentemente vitamina D 3 vegetal. Cuando se utilice vitamina D 3 animal, el producto necesariamente deberá comercializarse envasado de manera que se advierta al consumidor respecto al origen animal de la vitamina D empleada.
La harina deberá ser fortificada con vitamina D3, colecalciferol, de origen vegetal o animal, en una cantidad mínima de 2,25 µg/100g, pudiendo excederse hasta en un 40%, alcanzando el nivel de 3,15 µg/100g.
El origen vegetal o animal de la vitamina D3 utilizada, deberá declararse, de acuerdo a lo establecido en el artículo 107 letra h) del presente reglamento, como: "vitamina D 3 vegetal" o "vitamina D3 animal", según corresponda.
La verificación de la fortificación se realizará en la harina como materia prima, para ser utilizada en otros alimentos o comercializada a público. En consecuencia, se excluirá la verificación de fortificación a aquellos productos elaborados a partir de la harina o de sus subproductos.
Artículo 351.- Las mezclas vitamínicas que se comercialicen para enriquecer la harina sean nacionales o importadas deberán indicar en su rotulación las cantidades de nutrientes que aportan por gramo de mezcla.
EDecreto 75, SALUD
Art. 1 Nº 2
D.O. 16.03.2010l Ministerio de Salud mediante decreto, dictado bajo la fórmula "Por orden del Presidente de la República", aprobará la directriz sobre los parámetros técnicos adecuados para que la composición de la premezcla vitamínica para harinas sea uniforme.
Art. 1 Nº 2
D.O. 16.03.2010l Ministerio de Salud mediante decreto, dictado bajo la fórmula "Por orden del Presidente de la República", aprobará la directriz sobre los parámetros técnicos adecuados para que la composición de la premezcla vitamínica para harinas sea uniforme.
Artículo 352.- Harina integral es el producto resultante de la trituración del cereal previa limpieza y acondicionamiento, hasta llegar a un 100% de extracción.
Artículo 353.- La harina integral deberá cumplir con las características siguientes:
a) humedad, no más de 15,0%;
b) fibra cruda, no más de 1,5% sobre la base de 14,0% de humedad;
c) cenizas, no más de 1,5%, sobre la base de 14,0% de humedad, y d) acidez, no más de 0,3% expresada en ácido sulfúrico sobre la base de un 14% de humedad.
Artículo 354.- Las harinas de legumbres no debenDTO 475, SALUD
Art. Unico, Nº 102
D.O. 13.01.2000 contener más de 10 unidades de inhibidor de tripsina por miligramo de harina seca, 300 unidades de hemoaglutinantes por gramo de harina seca ni más de 0,1 mg de ácido cianhídrico por gramo de harina seca. Las harinas de lupino además no deberán contener más de 0,05% de alcaloides.
Art. Unico, Nº 102
D.O. 13.01.2000 contener más de 10 unidades de inhibidor de tripsina por miligramo de harina seca, 300 unidades de hemoaglutinantes por gramo de harina seca ni más de 0,1 mg de ácido cianhídrico por gramo de harina seca. Las harinas de lupino además no deberán contener más de 0,05% de alcaloides.
Artículo 355.- Las harinas no deberán contener insectos, partes de éstos o sus estados evolutivos, ácaros ni otros elementos extraños.
Párrafo III
Del pan y los productos de pastelería y repostería
Artículo 356.- Con el nombre de pan sin otra denominación, se entiende el producto de la cocción de la masa resultante de una mezcla de harina de trigo, levadura de panificación, agua potable y sal comestible, con o sin adición de mejoradores de panificación y/o enriquecedores, tales como: leche, azúcar, materias grasas u otros autorizados por este reglamento.
Si el pan se fabrica con otra harina, se denominará con el nombre de la harina que se emplee.
Artículo 357.- El pan deberá presentar las características siguientes:
a) olor y sabor característico;
b) cocción y panificación normales;
c) limpio y sin cuerpos extraños;
d) agua, no más de 36% en muestra tomada 1 hora después de salida del horno, y
e) acidez, no más de 0,25% expresada en ácido sulfúrico y calculada sobre la base de 30,0% de agua.
Artículo 358.- Con el nombre de masas o pastas horneadas se designan diversos productos elaborados en base a harinas, y adicionados o no de especies y otros ingredientes o aditivos permitidos, las que deberán cumplir con las siguientes especificaciones:
a) el aspecto de la masa será homogéneo, adecuado paraDTO 475, SALUD
Art. Unico, Nº 103
D.O. 13.01.2000
Art. Unico, Nº 103
D.O. 13.01.2000
dar la característica típica del producto;
b) acidez no superior al 0,25% expresada en ácido
sulfúrico.
Artículo 359.- El pan, los pasteles, las masas, pastas y otros productos de pastelería y repostería, no deberán contener sustancias extrañas, insectos, parte de éstos o sus estados evolutivos, ni ácaros.
Artículo 360.- Las mezclas de aditivos mejoradores de panificación usados en la industria panadera no deberán contener bromato de potasio.
Párrafo IV
De los fideos y productos afines
Artículo 361.- Fideos son los productos constituidos por mezclas de sémolas de trigo y/o harina con agua potable, no fermentadas, sin cocción y que han sido sometidos a un proceso de desecación. Podrán adicionarse huevos, hortalizas y otros ingredientes y aditivos autorizados.
Artículo 362.- Los fideos deberán cumplir con los siguientes requisitos:
a) agua, máximo 13,5% y
b) acidez total no superior a 0,25%, expresada en ácido sulfúrico, sobre la base de 14,0% de humedad.
Las demás exigencias y características corresponderán a las de la materia prima de origen, sin considerar nutrientes u otras sustancias agregadas permitidas.
Artículo 363.- Fideos enriquecidos con vitaminas y sales minerales son aquellos que contienen como mínimo los siguientes nutrientes por cada kilogramo de producto final:
Tiamina 9,0 mg
Riboflavina 3,0 mg
Niacina 57,0 mg
Hierro 30,0 mg
El hierro debe agregarse en forma de sulfato ferroso o pirofosfato ferroso.
Artículo 364.- Fideos o pastas con o al huevo son aquellos a los cuales se les ha agregado huevos frescos enteros o su equivalente deshidratado, de modo que contengan como mínimo 330 mg de colesterol, por cada kilogramo de producto terminado.
Artículo 365.- Pastas alimenticias frescas son los productos fabricados con sémolas de trigo y/o harina con agua potable, adicionados o no con huevos, hortalizas u otros ingredientes y aditivos autorizados, y que no han sufrido un proceso de desecación.
Artículo 366.- Las pastas alimenticias frescas deben cumplir con los siguientes requisitos:
a) humedad, máximo 35%, y
b) acidez, máximo 0,20% expresada en ácido sulfúrico, sobre la base de un 14,0% de humedad.
Artículo 367.- Los fideos y productos afines no deberán contener insectos o sus estados evolutivos, ácaros ni hongos.
Párrafo V
De otros productos farináceos
Artículo 368.- Los productos farináceos para coctelDTO 475, SALUD
Art. Unico, Nº 104
D.O. 13.01.2000 que se comercializan envasados, tales como: papas fritas, ramitas, productos extruidos, cereales dilatados, tortillas de maíz y similares, deberán presentar un máximo 40% de materia grasa y 5% de humedad.
Art. Unico, Nº 104
D.O. 13.01.2000 que se comercializan envasados, tales como: papas fritas, ramitas, productos extruidos, cereales dilatados, tortillas de maíz y similares, deberán presentar un máximo 40% de materia grasa y 5% de humedad.
Artículo 369.- Los cereales para el desayuno sonDTO 475, SALUD
Art. Unico, Nº 105
D.O. 13.01.2000 los productos elaborados a base de harinas o granos de cereales adicionados o no de aditivos autorizados, sal con aceites vegetales y/o jarabes azucarados comestible u otros ingredientes alimenticios. Pueden ser recubiertos y enriquecidos con vitaminas y minerales.
Art. Unico, Nº 105
D.O. 13.01.2000 los productos elaborados a base de harinas o granos de cereales adicionados o no de aditivos autorizados, sal con aceites vegetales y/o jarabes azucarados comestible u otros ingredientes alimenticios. Pueden ser recubiertos y enriquecidos con vitaminas y minerales.
Artículo 370.- Los productos descritos en este párrafo deberán presentar los caracteres que les son propios como sabor, olor, aspecto, textura y estar exentos de sustancias extrañas, insectos o parte de ellos.
Párrafo VI
De los derivados de cereales y tubérculos
Artículo 371.- Se incluyen en este grupo diversos productos derivados de cereales y tubérculos tales como:
chuchoca es el producto total de la molienda gruesa del grano de maíz tierno (choclo), previamente cocido y seco;
maicena es la fécula de maíz blanco, variedad dulce;
mote es el grano de trigo blando y tierno, obtenido por cocción y descortezado con lejía de ceniza u otro procedimiento equivalente autorizado y lavado con agua potable hasta eliminación total del álcali (pH 6,9);
mote de maíz es el maíz cocido y descortezado mediante lejía caliente de ceniza u otro procedimiento autorizado, y lavado con agua potable hasta eliminación del álcali (pH 6,9);
polenta es el producto de la molienda gruesa del grano de maíz seco y descortezado;
sémola es el producto de estructura granulosa, obtenido por la molienda gruesa y cernida del trigo duro (Triticum durum);
tapioca es el producto obtenido de la fécula de mandioca, humedecida y granulada;
avena laminada es el producto obtenido, por compresión mecánica del grano de avena industrialmente limpio y desprovisto de sus tegumentos;
chuño es el producto obtenido a partir de fécula de papa y puede contener hasta un máximo de 18% de humedad;
afrecho o salvado de trigo es el producto obtenido en el proceso de molienda del cereal y corresponde a las materias fibrosas no digeribles obtenidas a partir de las envolturas externas (pericarpio y testa) de la semilla o cariopse;
gérmen de trigo es el producto obtenido en el proceso de molienda a partir de la extracción del embrión de la semilla o cariopse.
TITULO XVI
De las levaduras de panificación y de los agentes
leudantes
Artículo 372.- Levadura para panificación es el producto obtenido de la propagación industrial de levaduras del género Saccharomyces en medios de cultivos adecuados.
Artículo 373.- Levadura prensada o filtrada para panificación corresponde a la levadura que ha sido centrifugada, prensada o filtrada, de manera que su humedad no sea mayor de 75% en peso.
Artículo 374.- Levadura seca y levadura seca instantánea para panificación corresponde a la levadura que ha sido deshidratada, de manera que su humedad no sea superior al 10% en peso.
Artículo 375.- Polvos de hornear son aquellos productos formados de ácido carbónico y sus sales sódica, potásica, cálcica y amónica y otros leudantes químicos autorizados, pudiendo adicionarles excipientes como material inerte.
Artículo 376.- Se podrán usar como agentes leudantes otros productos, siempre que estén expresamente autorizados para este fin en este reglamento.
TITULO XVII
De los azúcares y de la miel
Párrafo I
De los azúcares
Artículo 377.- Con el nombre de azúcar sólo podrá denominarse a la sacarosa natural cristalizada proveniente de la raíz de la remolacha azucarera (Beta vulgaris var.saccharina o saccharifera) o de losDTO 68, SALUD
Art. primero Nº 23
D.O. 23.01.2006 tallos de la caña de azúcar (Saccharum officinarum).
Art. primero Nº 23
D.O. 23.01.2006 tallos de la caña de azúcar (Saccharum officinarum).
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 378.- Azúcar crudo es el producto sólido cristalizado, obtenido de la caña de azúcar o de la remolacha azucarera, constituido esencialmente por cristales sueltos de sacarosa cubiertos de una película de su licor madre. Su polarización mínima a 20ºC debe ser de 96.
Artículo 379.- Azúcar blanco granulado o refinado es el producto que contiene por lo menos un 99,5% de sacarosa y no más de 0,1% de sustancias insolubles en agua. No deberá contener más de 0,10% de cenizas, 0,10% de sustancias reductoras ni más de 0,10% de humedad y su color será como máximo 150 unidades ICUMSA.
Al azúcar blanco podrá adicionarse hasta en un 2%, en total, de silicatos o fosfatos de calcio como agentes antihumectantes u otros productos permitidos.
Artículo 380.- Azúcar rubio granulado es el producto cristalizado obtenido de la caña de azúcar o de la remolacha azucarera que contiene como mínimo 98.5% de sacarosa y como máximo 0,2% de sustancias insolubles en agua, 0,4% de cenizas y 0,10% de humedad.
Artículo 381.- Azúcar flor o azúcar en polvo (azúcar glacé) es el producto que se obtiene al moler finamente el azúcar blanco granulado o el azúcar refinado granulado. Sus características deben corresponder a las del azúcar utilizado en su fabricación, permitiéndose agregar silicato o fosfato de calcio u otros agentes antihumectantes, en las concentraciones indicadas en este reglamento. Como ingrediente facultativo, se podrá utilizarDTO 475, SALUD
Art. Unico, Nº 106
D.O. 13.01.2000 almidón en una concentración máxima de 5% a condición de que no se emplee otro antiaglutinante o antihumectante.
Art. Unico, Nº 106
D.O. 13.01.2000 almidón en una concentración máxima de 5% a condición de que no se emplee otro antiaglutinante o antihumectante.
Artículo 382.- Chancaca es el producto obtenido al concentrar y cristalizar el jugo purificado de caña o de remolacha. Debe contener como mínimo 80% de sacarosa y como máximo 1% de sustancias insolubles en agua, 1,2% de cenizas y 6% de humedad.
Artículo 383.- Con el nombre de azúcares seDTO 68, SALUD
Art. primero Nº 24
D.O. 23.01.2006 entenderá a los carbohidratos endulzantes, monosacáridos y disacáridos refinados, concentrados y/o cristalizados, para efectos de rotulación, los que deberán rotularse con su nombre específico.
Art. primero Nº 24
D.O. 23.01.2006 entenderá a los carbohidratos endulzantes, monosacáridos y disacáridos refinados, concentrados y/o cristalizados, para efectos de rotulación, los que deberán rotularse con su nombre específico.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Párrafo II
De los jarabes
Artículo 384.- Se reserva la denominación de jarabes a los derivados, sucedáneos y subproductos de los azúcares naturales que comprenden a las sustancias cuya nomenclatura y requisitos se detallan en los artículos siguientes.
Artículo 385.- DEROGADODTO 68, SALUD
Art. primero Nº 25
D.O. 23.01.2006
Art. primero Nº 25
D.O. 23.01.2006
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 386.- DEROGADODTO 68, SALUD
Art. primero Nº 25
D.O. 23.01.2006
Art. primero Nº 25
D.O. 23.01.2006
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 387.- Jarabe de glucosa es una soluciónDTO 68, SALUD
Art. primero Nº 26
D.O. 23.01.2006 concentrada y purificada de sacáridos nutritivos obtenidos del almidón.
Art. primero Nº 26
D.O. 23.01.2006 concentrada y purificada de sacáridos nutritivos obtenidos del almidón.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 388.- El jarabe de glucosa destinado a la fabricación de productos de confitería podrá contener como máximo 400 mg/kg de anhídrido sulfuroso, aceptándose para el jarabe de glucosa destinado a otros usos un máximo de 40 mg/kg de anhídrido sulfuroso.
Artículo 389.- Jarabe de glucosa "deshidratada" es el jarabe de glucosa del que se ha separado parcialmente el agua. Debe contener como mínimo 20% m/m de azúcares reductores (equivalente en dextrosa), expresados en D-glucosa en seco y 90% m/m de sólidos totales y como máximo 1% m/m en seco de cenizas sulfatadas y 1 mg/kg de arsénico. El jarabe de glucosa deshidratado destinado a laDTO 238, SALUD
Art. 1°, N° 4
D.O. 26.05.2000 fabricación de productos de confitería deberá contener como máximo 150 mg/kg de anhídrido sulfuroso, aceptándose para el jarabe de glucosa deshidratado destinado a otros usos un máximo de 40 mg/kg de anhídrido sulforoso.
Art. 1°, N° 4
D.O. 26.05.2000 fabricación de productos de confitería deberá contener como máximo 150 mg/kg de anhídrido sulfuroso, aceptándose para el jarabe de glucosa deshidratado destinado a otros usos un máximo de 40 mg/kg de anhídrido sulforoso.
Artículo 390.- Jarabe de maíz de alta fructosa,DTO 238, SALUD
Art. 1°, N° 5
D.O. 26.05.2000 es un jarabe de maíz, obtenido por isomerización enzimática de una solución de alta dextrosa, conteniendo al menos un 70,5% de sólidos, no menos de un 92% de monosacáridos, conteniendo como mínimo un 42% de fructosa y no más de un 8% de otros sacáridos.
Art. 1°, N° 5
D.O. 26.05.2000 es un jarabe de maíz, obtenido por isomerización enzimática de una solución de alta dextrosa, conteniendo al menos un 70,5% de sólidos, no menos de un 92% de monosacáridos, conteniendo como mínimo un 42% de fructosa y no más de un 8% de otros sacáridos.
Artículo 391.- Jarabes naturales son los jugosDTO 475, SALUD
Art. Unico, Nº 107
D.O. 13.01.2000 naturales azucarados de productos vegetales (caña, maíz, remolacha, palma, frutas y otros), concentrados hasta la consistencia de jarabe, debiendo tener como mínimo 62º Brix y no contener sustancias aromáticas artificiales ni sustancias colorantes.
Art. Unico, Nº 107
D.O. 13.01.2000 naturales azucarados de productos vegetales (caña, maíz, remolacha, palma, frutas y otros), concentrados hasta la consistencia de jarabe, debiendo tener como mínimo 62º Brix y no contener sustancias aromáticas artificiales ni sustancias colorantes.
Artículo 392.- Jarabes artificiales son las soluciones concentradas de azúcares en agua potable, con adición de sustancias aromáticas, colorantes y ácidos permitidos.
Párrafo III
De la miel
Artículo 393.- Se Decreto 75, SALUD
Art. 1 N° 3
D.O. 12.11.2019entiende por "miel" la sustancia dulce natural producida por abejas Apis mellifera a partir del néctar de las plantas o de secreciones de partes vivas de éstas o de excreciones de insectos succionadores de plantas que quedan sobre partes vivas de las mismas y que las abejas recogen, transforman y combinan con sustancias específicas propias, y depositan, deshidratan, almacenan y dejan en el panal para que madure y añeje.
Art. 1 N° 3
D.O. 12.11.2019entiende por "miel" la sustancia dulce natural producida por abejas Apis mellifera a partir del néctar de las plantas o de secreciones de partes vivas de éstas o de excreciones de insectos succionadores de plantas que quedan sobre partes vivas de las mismas y que las abejas recogen, transforman y combinan con sustancias específicas propias, y depositan, deshidratan, almacenan y dejan en el panal para que madure y añeje.
"Miel de flores" o "miel de néctar" es la miel que procede del néctar de las plantas.
"Miel de mielada" es la miel que procede principalmente de excreciones que los insectos succionadores (Hemiptera) dejan sobre las partes vivas de las plantas o de secreciones de partes vivas de las mismas.
La miel se compone esencialmente de diferentes azúcares, predominantemente fructosa y glucosa, además de otras sustancias como ácidos orgánicos, enzimas y partículas sólidas derivadas de la recolección. El color de la miel varía de casi incoloro a pardo oscuro. Su consistencia puede ser fluida, viscosa, o total o parcialmente cristalizada. El sabor y el aroma varían, pero derivan de la planta de origen.
La miel deberá cumplir con las siguientes restricciones y características:
a) No contener ningún ingrediente adicional, incluidos los aditivos alimentarios u otra sustancia que no sea definida como miel.
b) No contener ninguna materia, sabor, aroma o mancha objetables que hayan sido absorbidas desde materias extrañas durante su procesamiento y almacenamiento.
c) No haber comenzado a fermentar o producir efervescencia.
d) No haber sido sometida a extracción de polen ni ningún constituyente particular de la miel, excepto cuando sea imposible evitarlo para garantizar la ausencia de materias extrañas, inorgánicas u orgánicas.
e) No deberá calentarse ni elaborarse la miel de forma tal que se modifique su composición esencial y/o se menoscabe su calidad.
f) No se deberán utilizar tratamientos químicos o bioquímicos para influir en la cristalización de la miel.
g) Debe contener como máximo 20% de agua, con excepción de las mieles descritas en la norma del Codex Alimentarius para la miel "Norma para la Miel CODEX STAN 12-1981", de acuerdo a su última versión, para las cuales regirá el valor según corresponda.
h) Debe contener no menos de 60 gramos de fructosa más glucosa por 100 gramos de miel o 45 gramos de fructosa más glucosa por 100 gramos de miel de mielada o mezclas de miel de mielada con miel de flores.
i) Debe contener no más de 5 gramos de sacarosa por 100 gramos de miel con excepción de las mieles descritas en la norma del Codex Alimentarius para la miel "Norma para la Miel CODEX STAN 12-1981", de acuerdo a su última versión, para las cuales regirá el valor que corresponda.
j) No debe contener más de 0,1 gramo de sólidos insolubles en agua por 100 gramos de miel obtenida mediante la centrifugación de los panales desoperculados, sin larvas, u obtenida mediante el drenaje de los panales desoperculados, sin larvas, o no contener más de 0,5 gramo de sólidos insolubles en agua por 100 gramos de miel obtenida mediante el prensado de los panales, sin larvas.
Los envases de miel destinados al consumidor final deberán rotular en su cara principal la siguiente frase: "Este producto no debe ser consumido por menores de 12 meses". Las características de las letras deberán corresponder a lo establecido en el artículo 115, letra c), números 1 y 2, de este reglamento.
Artículo 393 bis.- Se Decreto 75, SALUD
Art. 1 N° 4
D.O. 12.11.2019entenderá por "polen corbicular" el conglomerado de polen extraído desde las flores por la abeja de la especie Apis mellifera, la cual mezcla y aglutina con secreciones salivales y néctar, para ser depositadas en forma de gránulos redondeados en las corbículas de su tercer par patas traseras y transportadas a la colmena. Para efectos de rotulación, se aceptará el uso de la denominación "polen", "polen de abeja", "polen granulado" u otro que informe a los consumidores sobre la naturaleza de este producto, resguardando el cumplimiento del artículo 110 del presente reglamento.
Art. 1 N° 4
D.O. 12.11.2019entenderá por "polen corbicular" el conglomerado de polen extraído desde las flores por la abeja de la especie Apis mellifera, la cual mezcla y aglutina con secreciones salivales y néctar, para ser depositadas en forma de gránulos redondeados en las corbículas de su tercer par patas traseras y transportadas a la colmena. Para efectos de rotulación, se aceptará el uso de la denominación "polen", "polen de abeja", "polen granulado" u otro que informe a los consumidores sobre la naturaleza de este producto, resguardando el cumplimiento del artículo 110 del presente reglamento.
Se entenderá por "jalea real" la sustancia cremosa semifluida de color blanco amarillento, de sabor ácido, ligeramente picante, la cual es producida por la acción combinada de la glándula hipofaringeas y por la glándula mandibulares de las abejas nodrizas de la especie Apis mellifera
Artículo 394.- Podrá Decreto 75, SALUD
Art. 1 N° 5
D.O. 12.11.2019denominarse como "miel de palma" al producto dulce, viscoso y de color caramelo oscuro, obtenido por concentración de savia de palma chilena (Jubea chilensis). El producto no deberá contener saborizantes/aromatizantes, preservantes, espesantes y/o colores artificiales.
Art. 1 N° 5
D.O. 12.11.2019denominarse como "miel de palma" al producto dulce, viscoso y de color caramelo oscuro, obtenido por concentración de savia de palma chilena (Jubea chilensis). El producto no deberá contener saborizantes/aromatizantes, preservantes, espesantes y/o colores artificiales.
TITULO XVIII
De los productos de confitería y similares
Párrafo I
De la confitería de azúcar
Decreto 106, SALUD
Art. 1 Nº 30
D.O. 23.04.2009 Artículo 395.- Productos de confitería son las preparaciones de diferentes formas de presentación y consistencia, que contienen azúcares como materia básica característica, o en su reemplazo total o parcial edulcorantes no nutritivos, con o sin adición de miel, leche, materias grasas, frutas al estado natural o elaboradas, semillas u otros ingredientes y aditivos permitidos.
Art. 1 Nº 30
D.O. 23.04.2009 Artículo 395.- Productos de confitería son las preparaciones de diferentes formas de presentación y consistencia, que contienen azúcares como materia básica característica, o en su reemplazo total o parcial edulcorantes no nutritivos, con o sin adición de miel, leche, materias grasas, frutas al estado natural o elaboradas, semillas u otros ingredientes y aditivos permitidos.
Párrafo II
De los productos del cacao y del chocolate
Artículo 396.- Semilla de cacao o cacao en grano es la semilla sana y limpia del Theobroma cacao L., que ha sido sometida a fermentación y posterior desecación. Deberá contener como máximo 8% de humedad, 12% de cáscara y no contener insectos o sus estados evolutivos.
Artículo 397.- Cacao o cacao en polvo es el producto obtenido de la pulverización de la torta de cacao. Deberá contener como máximo 8% de humedad y 5% de cascarillas o sustancias extrañas, expresadas sobre materia seca desgrasada. Si su contenido de materia grasa es igual o superior al 10% se denominará "Cacao natural en polvo" y si es menor de 10% se denominará como "Cacao desgrasado en polvo".
Artículo 398.- Chocolate es el producto homogéneoDTO 475, SALUD
Art. Unico, Nº 109
D.O. 13.01.2000 obtenido de un proceso de fabricación adecuado de materias de cacao que puede ser combinado con productos lácteos, azúcares y/o edulcorantes, emulsificadores y/o saborizantes. Debe contener como mínimo 20% de sólidos de cacao del cual, por lo menos 18% será manteca de cacao. Pueden agregarse hasta un límite de un 40% del peso total del producto terminado otros ingredientes alimenticios.
Art. Unico, Nº 109
D.O. 13.01.2000 obtenido de un proceso de fabricación adecuado de materias de cacao que puede ser combinado con productos lácteos, azúcares y/o edulcorantes, emulsificadores y/o saborizantes. Debe contener como mínimo 20% de sólidos de cacao del cual, por lo menos 18% será manteca de cacao. Pueden agregarse hasta un límite de un 40% del peso total del producto terminado otros ingredientes alimenticios.
Artículo 399.- Chocolate sucedáneo es el producto en el que la manteca de cacao ha sido reemplazada parcial o totalmente por materias grasas de origen vegetal, debiendo poseer los demás ingredientes del chocolate. Deberá contener como mínimo un 4% de sólidos no grasos de cacao y su humedad no deberá ser superior al 3%. El chocolate sucedáneo de leche deberá contener unDTO 475, SALUD
Art. Unico, Nº 110
D.O. 13.01.2000 mínimo de 12% de sólidos de leche desgrasados y el chocolate blanco sucedáneo deberá contener como mínimo un 4% de manteca de cacao. En la rotulación de estos productos deberá destacarse claramente Sabor a chocolate.
Art. Unico, Nº 110
D.O. 13.01.2000 mínimo de 12% de sólidos de leche desgrasados y el chocolate blanco sucedáneo deberá contener como mínimo un 4% de manteca de cacao. En la rotulación de estos productos deberá destacarse claramente Sabor a chocolate.
Artículo 400.- Cacao azucarado en polvo es el producto obtenido a partir de cacao en polvo, con la adición de azúcar y destinado a ser disuelto en aguaDTO 68, SALUD
Art. primero Nº 28
D.O. 23.01.2006 o leche. Deberá contener como máximo 65% de azúcar y como mínimo 20% de sólidos de cacao. Podrá llevar adicionado leche en polvo u otros ingredientes y aditivos permitidos, no podrá contener colorantes.
Art. primero Nº 28
D.O. 23.01.2006 o leche. Deberá contener como máximo 65% de azúcar y como mínimo 20% de sólidos de cacao. Podrá llevar adicionado leche en polvo u otros ingredientes y aditivos permitidos, no podrá contener colorantes.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Párrafo III
De los productos en polvo para preparar postres y
refrescos
Artículo 401.- Con el nombre genérico de producto en polvo para preparar postres y refrescos, se denominan los productos en polvo o granulados que, por dispersión en agua y/o leche, permiten la obtención de las preparaciones correspondientes (gelatinas, flanes, budines, refrescos u otros).
Artículo 402.- Polvos para preparar postres de gelatina son los productos constituidos por mezclas de gelatina y azúcares o edulcorantes autorizados, adicionados o no de acidulantes, saborizantes, colorantes y otros ingredientes autorizados por este reglamento. Su contenido máximo de humedad será de 5%. Cuando se utilicen otros espesantes o hidrocoloidesDTO 115, SALUD
Art. primero Nº 20
D.O. 25.11.2003 autorizados que no sea gelatina de origen animal, deberá indicarse en el rótulo "gelatina de origen vegetal", sin perjuicio de la correspondiente declaración de los nombres específicos de los espesantes o hidrocoloides constituyentes.
Art. primero Nº 20
D.O. 25.11.2003 autorizados que no sea gelatina de origen animal, deberá indicarse en el rótulo "gelatina de origen vegetal", sin perjuicio de la correspondiente declaración de los nombres específicos de los espesantes o hidrocoloides constituyentes.
NOTA:
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
Artículo 403.- La gelatina utilizada en laDTO 115, SALUD
Art. primero Nº 21
D.O. 25.11.2003 elaboración de postres debe provenir de la hidrólisis selectiva del colágeno principal proteína estructural de la piel, tejido conectivo y huesos de animales sanos. Deberán cumplir con las normas de identidad y pureza de FAO/OMS.
Art. primero Nº 21
D.O. 25.11.2003 elaboración de postres debe provenir de la hidrólisis selectiva del colágeno principal proteína estructural de la piel, tejido conectivo y huesos de animales sanos. Deberán cumplir con las normas de identidad y pureza de FAO/OMS.
NOTA:
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
Artículo 404.- Polvos para preparar refrescos oDTO 68, SALUD
Art. primero Nº 29
D.O. 23.01.2006 bebidas instantáneas en polvo son los productos constituidos por azúcares o mezclas de azúcares y edulcorantes autorizados o mezclas de edulcorantes autorizados, acidulantes, saborizantes, colorantes, con o sin adición de enturbiantes y otros ingredientes.
Art. primero Nº 29
D.O. 23.01.2006 bebidas instantáneas en polvo son los productos constituidos por azúcares o mezclas de azúcares y edulcorantes autorizados o mezclas de edulcorantes autorizados, acidulantes, saborizantes, colorantes, con o sin adición de enturbiantes y otros ingredientes.
Estos productos deberán contener lo siguiente:
a) porcentaje máximo de humedad de 5% al momento de envasar estos productos;
b) porcentaje máximo de cenizas totales 2% con excepción de los enriquecidos o fortificados, para los cuales no regirá este límite;
c) porcentaje mínimo de 85% de azúcares totales en peso del producto final, salvo para los refrescos o bebidas instantáneas en polvo, en los que se ha sustituido total o parcialmente los azúcares por edulcorantes no nutritivos.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 405.- La rotulación de edulcorantes en estos productos deberá ajustarse a lo estipulado en el Título III. De los Aditivos Alimentarios de este reglamento.
TITULO XIX
De las confituras y similares
Artículo 406.- Con la denominación genérica de "confituras", se entienden los productos obtenidos por cocción de frutas, hortalizas o tubérculos (enteros o fraccionados), sus jugos y/o pulpas, con azúcares (azúcar, dextrosa, azúcar invertido, jarabe de glucosa o sus mezclas) con o sin adición de otros edulcorantes, aditivos e ingredientes. Comprenden mermeladas, dulces, jaleas, frutas confitadas, glaseadas, cristalizada o escarchadas, escurridas y almibaradas.
Artículo 407.- Las frutas y hortalizas confitadas, glaseadas cristalizadas o escarchadas, escurridas y almibaradas, deberán cumplir con lo siguiente:
a) deben estar libres de hojas, fragmentos de insectos y materias ajenas al producto;
b) los frutos deben poseer un mínimo de transparencia, brillo y turgencia y su textura debe ser firme y no desintegrarse al ser presionada entre los dedos;
c) podrán contener colorantes y aromatizantes u otros aditivos autorizados.
TITULO XX
De las conservas
Párrafo I
Disposiciones generales
Artículo 408.- Conserva es el producto alimenticioDTO 475, SALUD
Art. Unico, N° 113
D.O. 13.01.2000 contenido en envase herméticamente sellado y que ha sido sometido posteriormente a un tratamiento térmico que garantice su esterilidad comercial.
Art. Unico, N° 113
D.O. 13.01.2000 contenido en envase herméticamente sellado y que ha sido sometido posteriormente a un tratamiento térmico que garantice su esterilidad comercial.
Artículo 409.- Envase herméticamente sellado es aquel que ha sido diseñado para impedir la entrada de microorganismos durante y después del tratamiento térmico, con el objeto de mantener la esterilidad comercial.
Artículo 410.- Tratamiento térmico son las condiciones de tiempo y temperatura necesarias para conseguir la esterilidad comercial.
Artículo 411.- Tratamiento programado es el tratamiento térmico utilizado por el fabricante para un producto determinado y un tamaño de envase definido, para conseguir la esterilidad comercial.
Artículo 412.- Esterilidad comercial es el estado que se consigue aplicando calor suficiente, solo o en combinación con otros procesos de conservación de alimentos, que aseguren la destrucción de formas viables de microorganismos patógenos y de otros microorganismos capaces de alterar el producto y que pudieran multiplicarse a temperatura ambiente, durante su almacenamiento y distribución.
Artículo 413.- Alimento ácido es todo alimento cuyo pH natural sea de 4.5 o menor.
Artículo 414.- Alimento de baja acidez es cualquier alimento con un valor de pH mayor de 4.5 y una actividad de agua mayor de 0.85. Incluye frutas, vegetales o productos vegetales de acidez naturalmente baja, a los cuales se les ha reducido el pH por acidificación, previo a su tratamiento térmico.
Artículo 415.- Alimento en conserva acidificado es todo alimento que haya sido tratado para obtener un pH de equilibrio de 4.5 o menor después del tratamiento térmico.
Artículo 416.- El agua utilizada para el enfriamiento de las conservas deberá ser clorada, debiendo controlarse, para asegurar en todo momento un nivel no inferior a 0,2 mg/l de cloro libre residual.DTO 475, SALUD
Art. Unico, N° 114
D.O. 13.01.2000 Si esta agua se recircula debe separarse toda materia orgánica insoluble.
Art. Unico, N° 114
D.O. 13.01.2000 Si esta agua se recircula debe separarse toda materia orgánica insoluble.
Artículo 417.- Se debe asegurar laDTO 475, SALUD
Art. Unico, N° 115
D.O. 13.01.2000 hermeticidad de las conservas mediante procedimientos idóneos. Se deberá llevar un registro de los controles de hermeticidad.
Art. Unico, N° 115
D.O. 13.01.2000 hermeticidad de las conservas mediante procedimientos idóneos. Se deberá llevar un registro de los controles de hermeticidad.
Artículo 418.- Los autoclaves utilizados en el tratamiento térmico deben estar provistos de un termómetro de precisión de 1ºC y además de un dispositivo de registro de la temperatura y tiempo de esterilización.
Artículo 419.- Se prohíbe la tenencia, distribución y expendio de conservas cuyos envases se presenten hinchados, abollados, con evidencia de haber perdido su hermeticidad por daño en sus cierres, visiblemente oxidados o que haya excedido el plazo recomendado para su consumo establecido por el fabricante. Estos productos no podrán ser reprocesados para consumo humano.
Artículo 420.- En productos en conserva, la fechaDTO 475, SALUD
Art. Unico, N° 116
D.O. 13.01.2000 o código de elaboración se estampará en una de las tapas del envase bajo relieve o con equipos automáticos de impresión mediante tinta indeleble, en la forma y orden establecidos en este reglamento.
Art. Unico, N° 116
D.O. 13.01.2000 o código de elaboración se estampará en una de las tapas del envase bajo relieve o con equipos automáticos de impresión mediante tinta indeleble, en la forma y orden establecidos en este reglamento.
Párrafo II
De los requisitos para alimentos de baja acidez
Artículo 421.- El tratamiento térmico deberá ser establecido por el fabricante para cada producto, formulación y formato mediante instrumentos y estudios de curvas de penetración de calor realizados en los autoclaves de la industria. Este tratamiento deberá supervisarse por personal técnicamente competente.
Párrafo III
De los requisitos para alimentos en conserva
acidificados
Artículo 422.- Deberá llevarse en registro para cada carga que contenga la siguiente información:
a) condiciones del tratamiento térmico;
b) productos empleados para el ajuste del pH.
El producto final deberá tener un pH de equilibrio igual o menor a 4,5.
Párrafo IV
De los requisitos para conservas de carne
Artículo 423.- Las conservas de carne no deberánDTO 475, SALUD
Art. Unico, N° 117
D.O. 13.01.2000 contener más de 100 mg/Kg de nitrito residual, expresado como nitrito de sodio.
Art. Unico, N° 117
D.O. 13.01.2000 contener más de 100 mg/Kg de nitrito residual, expresado como nitrito de sodio.
TITULO XXI
De los encurtidos
Artículo 424.- Encurtidos o pickles son los frutos u hortalizas sometidas a fermentación láctica con adición de sal, conservados o no en vinagre. Los encurtidos deben cumplir los siguientes requisitos:
a) las frutas y hortalizas utilizadas como materias primas deberán ser sanas, de madurez adecuada y estar libres de alteraciones producidas por agentes físicos, químicos o biológicos;
b) el líquido de cobertura de los encurtidos conservados en vinagre deberá tener una acidez mínima de 1,5% expresada como ácido acético, y un pH no mayor de 3,8 (a 20ºC).
Debe contener un máximo de 100 mg/kg de anhídrido sulfuroso total, cuando las materias primas hayan sido tratadas con sulfito, bisulfitos o anhídrido sulfuroso.
Artículo 425.- Las aceitunas conservadas por esterilización térmica (como las aceitunas aderezadas ennegrecidas por oxidación) deberán haber recibido un tratamiento suficiente, tanto en tiempo como en temperatura para destruir las esporas de Clostridium botulinum.
TITULO XXII
De los caldos y sopas deshidratadas
Artículo 426.- Caldo deshidratado es el productoDTO 475, SALUD
Art. Unico, N° 118
D.O. 13.01.2000 constituido por verduras o mezclas de carne y sus extractos, grasa, sal comestible, condimentos, especias y acentuantes del sabor. Pueden contener verduras deshidratadas, proteínas hidrolizadas, extractos de levaduras y aditivos autorizados en este reglamento. Los caldos deshidratados no deben contener más de un 5% de humedad y reconstituidos de acuerdo a su rotulación, deben contener como máximo 12,5 g de cloruro de sodio y como mínimo 100 mg de nitrógeno total por litro de caldo. Los caldos de carne de vacuno deben contener como mínimo 20 mg de creatinina total y los de otras carnes 10 mg de creatinina total por litro de caldo preparado.
Art. Unico, N° 118
D.O. 13.01.2000 constituido por verduras o mezclas de carne y sus extractos, grasa, sal comestible, condimentos, especias y acentuantes del sabor. Pueden contener verduras deshidratadas, proteínas hidrolizadas, extractos de levaduras y aditivos autorizados en este reglamento. Los caldos deshidratados no deben contener más de un 5% de humedad y reconstituidos de acuerdo a su rotulación, deben contener como máximo 12,5 g de cloruro de sodio y como mínimo 100 mg de nitrógeno total por litro de caldo. Los caldos de carne de vacuno deben contener como mínimo 20 mg de creatinina total y los de otras carnes 10 mg de creatinina total por litro de caldo preparado.
Artículo 427.- Sopas y sopas cremas deshidratadas son aquellos productos elaborados a base de mezclas de cereales y sus derivados, leguminosas sometidas a tratamiento térmico, verduras deshidratadas, callampas, carnes en general incluyendo las de aves, pescados y mariscos, leche y sus derivados, alimentos grasos, extractos de carnes y levaduras, proteínas hidrolizadas, sal, especias y sus extractos y otros productos alimenticios acentuantes del sabor y aditivos permitidos. Para su consumo requieren la adición de agua y cocción de acuerdo a lo indicado en su rotulación. Las sopas cremas deshidratadas deberán contener como mínimo 0,8% de nitrógeno total y como máximo un 8% de humedad. Deberán contener por litro de sopa como máximo 12,5DTO 475, SALUD
Art. Unico, N° 119
D.O. 13.01.2000 g de cloruro de sodio. Las sopas cremas en cuyas denominaciones se haga alusión a la presencia de carne, deben contener como mínimo 60 mg de creatinina total por litro de sopa preparada cuando corresponda a variedades con carne de vacuno y 10 mg de creatinina total en variedades con otras carnes.
Art. Unico, N° 119
D.O. 13.01.2000 g de cloruro de sodio. Las sopas cremas en cuyas denominaciones se haga alusión a la presencia de carne, deben contener como mínimo 60 mg de creatinina total por litro de sopa preparada cuando corresponda a variedades con carne de vacuno y 10 mg de creatinina total en variedades con otras carnes.
Artículo 428.- Sopas y sopas cremas deshidratadas instantáneas no necesitarán cocción y para ser consumidas sólo requieren la adición de agua de acuerdo a las instrucciones de preparación indicadas en su rótulo. Deben cumplir los mismos requisitos que las sopas y sopas cremas deshidratadas no instantáneas.
Artículo 429.- La creatinina de los caldos, sopas y sopas cremas debe corresponder exclusivamente a los componentes del producto natural.
TITULO XXIII
De las especias, condimentos y salsas
Párrafo I
De las especias
Artículo 430.- La denominación de "especias" comprende a plantas o partes de ellas (raíces, rizomas, bulbos, hojas, cortezas, flores, frutos y semillas) que contienen sustancias aromáticas, sápidas o excitantes, o sus principios activos suspendidos en un soporte alimenticio adecuado, empleadas para condimentar alimentos y bebidas. Se incluyen en esta denominación, entre otras, las siguientes especias:
Anís común o verde : Frutos desecados del Pimpinela anisum L.
Anís estrellado : Frutos del Illicium verum H.
Azafrán : Filamentos de color rojo-anaranjado
provenientes de los estigmas desecados de
la flor del Croccus sativus L.
Canela de Ceylán : Corteza desecada y privada en su mayor
parte de la capa epidérmica, proveniente el
Cinnamomum zeylanicum N. Toda canela que
no corresponda a los caracteres macro y
microscópicos de la de Ceylán, como la del
Cinnamomum cassia, debe denominarse "canela
común"
Cardamomo : Semillas del Elettaria cardamomum L.
Clavo de olor : Botones florales secos del Caryophyllus
aromaticus L. o Eugenia Caryphyllata T.
Comino : Frutos del Cuminum cyminum L.
Comino alemán o
alcaravea : Frutos del Carum carvi L.
Curcuma : Rizoma del Curcuma longa L.
Curry : Mezcla de especies de sabor picante,
constituida por diversas especias como
pimientas, jengibre, cúrcuma y otros
condimentos
Jengibre : Rizoma lavado y desecado de Zingiber
officinale R.
Macis : Envoltura o arilo que recubre la semilla de
la nuez moscada Myristica fragans H.
Mejorana : Hojas y partes aéreas floridas del Origa
num mejorana L.
Menta piperita : Hojas y partes aéreas floridas de la Mentha
piperita L.
Mostaza blanca : Semillas de la Sinapis alba
Mostaza negra : Semillas de la Brassica nigra L.
Nuez moscada : Semilla desecada de Myristica fragans H.,
desprovista totalmente de su envoltura
(macis)
Pimienta blanca : Fruto maduro y seco, privado de la parte
exterior de su pericarpio, proveniente del
Piper nigrum L.
Pimienta negra : Fruto incompletamente maduro y seco,
proveniente del Piper nigrum L.
Pimienta de Jamaica : Fruto de Pimienta officinalis B. o Allspice
Pimienta de Cayena : Frutos especialmente picantes del Capsicum
frutescens
Vainilla : Fruto inmaduro, fermentado y desecado de
vainilla olanifolia A.
Artículo 431.- Las especias deben ser sanas, limpias, genuinas y presentar las características que les son propias. Deben contener la totalidad de sus principios activos y estar privadas de otras partes del vegetal exentas de valor como condimento.
Artículo 432.- Las especias no deben estar agotadas, alteradas, contaminadas con insectos o parásitos, ni en mal estado de conservación o higiene. Queda prohíbido adicionarles sustancias inertes, amiláceas o cualquier otra materia extraña.
Artículo 433.- Las especias que a continuación se indican deben cumplir con los siguientes límites de humedad, cenizas totales,cenizas insolubles en ácido clorhídrico, fibra cruda y esencias:
Especia Humedad Cenizas Cenizas Fibra Esen-
materias totales insolubles cruda cia
volátiles HCL 10
máx. % máx. % máx. % máx. % mín.%
Anís común 13 9,0 1,5 - 2
Anís estrellado - 3,0 1 - 4,5
Azafrán 15 8 1 5 4,5
Canela de Ceylán 10 6 2 20 2
Cardamomo 12 8 3 - 0,5
Clavo de olor 15 8 2 15 2
Comino 9 9,5 1 7 0,3
Comino alemán 9,5 9 1 18 10
Curcuma 10 8 1 6 2,5
Jengibre 14 7,5 2 8 2,5
Macis 17 3 0,5 10 4
Mejorana 15 15 5 19 0,7
Menta piperita 12 12 1 - 0,8
Mostaza blanca - 5 1 22 -
Mostaza negra - 5 1,5 - 0,6
Nuez moscada 14 5 0,8 20 5
Pimienta blanca 15 2 0,3 5 1,5
Pimienta negra 12 7 1 12,5 2
Pimienta de 10 8 1 - -
Cayena
Pimienta de 10 6 0,4 25 -
Jamaica
Vainilla 30 7 - - 1,5
Artículo 434.- Si se sustituye la vainilla natural por vainillina o etil-vainillina, los rótulos y publicidad deberán indicar: "aromatizado con vainillina o etil-vainillina".
Párrafo II
De la Sal Comestible
Artículo 435.- Sal comestible es el cloruro de sodio proveniente de depósitos geológicos, de lagos salados o de agua de mar. Se incluye en esta definiciónDTO 475, SALUD
Art. Unico, N° 120
D.O. 13.01.2000 aquella destinada al consumo directo, así como aquella destinada a la elaboración y preparación de alimentos por la industria.
Art. Unico, N° 120
D.O. 13.01.2000 aquella destinada al consumo directo, así como aquella destinada a la elaboración y preparación de alimentos por la industria.
Artículo 436.- La sal Decreto 33, SALUD
Art. 1 N° 1
D.O. 28.11.2016 comestible, sin otra denominación, sea cristalizada o molida, deberá contener un mínimo de 97% de cloruro de sodio en base seca, con exclusión de los aditivos.
Art. 1 N° 1
D.O. 28.11.2016 comestible, sin otra denominación, sea cristalizada o molida, deberá contener un mínimo de 97% de cloruro de sodio en base seca, con exclusión de los aditivos.
Artículo 437.- La sal comestible con menorDTO 475, SALUD
Art. Unico, N° 121
D.O. 13.01.2000 contenido de sodio deberá ceñirse a las especificaciones que para cada descriptor nutricional establece el artículo 120 del presente reglamento.
Art. Unico, N° 121
D.O. 13.01.2000 contenido de sodio deberá ceñirse a las especificaciones que para cada descriptor nutricional establece el artículo 120 del presente reglamento.
Artículo 438.- Toda Decreto 70, SALUD
Art. 1° N° 1
D.O. 11.11.2022sal comestible deberá contener yodo adicionado, en forma de yodatos o de yoduros de sodio o de potasio, en una concentración entre 0,015 y 0,025 gramos de yodo por kilogramo de sal.
Art. 1° N° 1
D.O. 11.11.2022sal comestible deberá contener yodo adicionado, en forma de yodatos o de yoduros de sodio o de potasio, en una concentración entre 0,015 y 0,025 gramos de yodo por kilogramo de sal.
Cuando se utilicen sucedáneos de la sal comestible o sal baja en sodio, ella deberá ser yodada según lo dispuesto en el inciso anterior.
Se exceptuarán de la utilización de sal yodada los quesos en general, frescos, semimaduros y maduros.
NOTA
El artículo segundo transitorio del Decreto 70, Salud, publicado el 11.11.2022, dispone que el rango de concentración de yodo en la sal señalado en la presente norma, entrará en vigencia en forma progresiva conforme a lo señalado en el cuadro contenido en la referida disposición.
El artículo segundo transitorio del Decreto 70, Salud, publicado el 11.11.2022, dispone que el rango de concentración de yodo en la sal señalado en la presente norma, entrará en vigencia en forma progresiva conforme a lo señalado en el cuadro contenido en la referida disposición.
Artículo 439.- Toda sal comestible deberáDTO 475, SALUD
Art. Unico, N° 123
D.O. 13.01.2000 estar exenta de cualquier sustancia tóxica. No deberá contener:
Art. Unico, N° 123
D.O. 13.01.2000 estar exenta de cualquier sustancia tóxica. No deberá contener:
a) más de 0,5% de nitratos, expresados como nitrato de potasio;
b) no más de 1,5% de sulfatos expresados como sulfato de sodio;
c) no más de 1% de sólidos insolubles en agua; y
d) no más de 1 mg/kg de nitritos como NO 2 .
Párrafo III
Del Vinagre
Artículo 440.- La designación de "vinagre" o "vinagre de vino" corresponde al producto de la fermentación acética del vino. Los vinagres obtenidos por fermentación de otras bebidas o líquidos alcohólicos deberán llevar, en la rotulación de sus envases, la declaración de "vinagre...", seguido del nombre de la materia prima de origen.
Artículo 441.- El vinagre o vinagre de vino debe presentar las siguientes características: a) líquido de color, olor y sabor propios de su naturaleza,
límpido, sin presentar hongos y levaduras, ni otras
alteraciones;
b) su contenido de alcohol no debe sobrepasar el 1% en
volumen y su acidez total, expresada en ácido
acético, debe ser como mínimo 5%;DTO 475, SALUD
Art. Unico, N° 124
D.O. 13.01.2000
Art. Unico, N° 124
D.O. 13.01.2000
c) deberá contener como mínimo 10 g/l de extracto seco,
una acidez fija, expresada en tartrato ácido de
potasio, de 5g/l y cenizas totales 1 g/l.
Artículo 442.- Los vinagres que no procedan de vino (alcohol, azúcares, hidromiel, zumos de frutas, cerveza, malta, sidra, suero lácteo u otros) corresponderán a la composición normal de sus materias de origen y su acidez total, expresada en ácido acético, no será inferior a 4%.
Artículo 443.- Los vinagres, en general, no deben contener sustancias extrañas a su materia prima de origen, ni se aceptará que sean adicionados de ácidos minerales ni orgánicos, incluso ácido acético, materias acres, irritantes o tóxicas, colorantes extraños como tampoco, de otras sustancias destinadas a realzar artificialmente las propiedades características de los vinagres genuinos.
Artículo 444.- No se permitirá la elaboración, distribución o expendio bajo el nombre de vinagre, de productos a base de ácido acético o láctico, que no provengan de la fermentación acética natural de los productos de origen.
Párrafo IV
De las Salsas
Artículo 445.- Se denomina salsa a los productos preparados, de consistencia líquida o semilíquida a base de pulpa de frutos, condimentos naturales o elaborados, ácidos orgánicos, productos aromáticos o picantes, azúcares, sal u otros productos permitidos.
Artículo 446.- Salsa de mostaza es la mezcla de harina de mostaza con vinagre, sal, otros condimentos y acidulantes permitidos. Debe responder a los siguientes requisitos:
a) contener hasta un máximo de 75% de humedad;
b) no contener menos de un 0,1% de esencia de mostaza natural, expresada en base seca;
c) contener hasta un máximo de 12% de cenizas totales, expresadas en base seca;
e) acidez no menor de 1% expresada como ácido acético.
Artículo 447.- Toda mezcla con otras sustancias espesantes, colorantes permitidos u otros ingredientes no señalados en la definición de salsa de mostaza, sólo puede expenderse como "condimento de mostaza".
Artículo 448.- Salsa de tomates es el producto resultante de la molienda y tamizaje parcial de tomates de las variedades rojas (Lycopersicum esculentum Mill), sanos, maduros, cuya pulpa y jugo parcialmente libre de piel y semillas ha sido concentrado por evaporación y adicionado de condimento, sal y aditivos permitidos. Debe responder a los siguientes requisitos:
a) sólidos solubles mínimo 8° Brix;
b) acidez total expresada como ácido cítrico anhidro, máximo 2,5%.
Artículo 449.- Ketchup es el producto obtenido de la molienda y tamizaje de tomates de las variedades rojas (Lycopersicum esculentum Mill.), sanos y maduros cuya pulpa y jugo, libre de piel y semillas ha sido evaporado y adicionado de vinagre, azúcar, condimentos, sal y aditivos permitidos. Debe responder a los siguientes requisitos:
a) sólidos solubles mínimo 26º Brix;
b) pH:4,4 como máximo.
Artículo 450.- Mayonesa es la emulsión deDTO 475, SALUD
Art. Unico, N° 125
D.O. 13.01.2000 aceite comestible en huevo y agua, adicionada de vinagre, jugo de limón, otros ácidos orgánicos, sal comestible, condimentos y aditivos. Se permite la adición de caroteno y otros aditivos autorizados.
Art. Unico, N° 125
D.O. 13.01.2000 aceite comestible en huevo y agua, adicionada de vinagre, jugo de limón, otros ácidos orgánicos, sal comestible, condimentos y aditivos. Se permite la adición de caroteno y otros aditivos autorizados.
En los locales de atención a público que ofrezcan o incluyan mayonesa en alimentos, la mayonesaDecreto 11, SALUD
Art. 1 N° 1
D.O. 29.10.2011 sólo se podrá elaborar a base de huevos pasteurizados, líquidos, congelados o deshidratados que cumplan con las especificaciones microbiológicas del artículo 173 del presente reglamento o estar lista para el consumo procedente de fábricas autorizadas
Art. 1 N° 1
D.O. 29.10.2011 sólo se podrá elaborar a base de huevos pasteurizados, líquidos, congelados o deshidratados que cumplan con las especificaciones microbiológicas del artículo 173 del presente reglamento o estar lista para el consumo procedente de fábricas autorizadas
Artículo 451.- Aderezos para ensaladas (salad dressings) son las emulsionesDecreto 11, SALUD
Art. 1 N° 2
D.O. 29.10.2011 en las cuales el aceite comestible se encuentra finamente disperso en un medio acuoso que puede contener uno o más de los siguientes ingredientes: sal, azúcares, vinagre, especias, huevo y/o derivados lácteos y aditivos autorizados. En caso de incluir huevo, deberá cumplirse con lo establecido en el artículo precedente.
Art. 1 N° 2
D.O. 29.10.2011 en las cuales el aceite comestible se encuentra finamente disperso en un medio acuoso que puede contener uno o más de los siguientes ingredientes: sal, azúcares, vinagre, especias, huevo y/o derivados lácteos y aditivos autorizados. En caso de incluir huevo, deberá cumplirse con lo establecido en el artículo precedente.
TITULO XXIV
De los estimulantes o fruitivos
Párrafo I
Del té
Artículo 452.- Té, sin otra denominación es el producto obtenido de hojas tiernas, yemas, pecíolos o pedúnculos, sanos y limpios de las especies del género Thea, preparado por deshidratación, con o sin fermentación/oxDecreto 32, SALUD
Art. 1 N° 1
D.O. 26.01.2013idación enzimática.
Art. 1 N° 1
D.O. 26.01.2013idación enzimática.
Decreto 32, SALUD
Art. 1 N° 2
D.O. 26.01.2013 Artículo 453.- Las materias primas para la elaboración de los distintos tipos de té deben cumplir con los siguientes requisitos:
Art. 1 N° 2
D.O. 26.01.2013 Artículo 453.- Las materias primas para la elaboración de los distintos tipos de té deben cumplir con los siguientes requisitos:
a) Contener un máximo de:
20% de tallos, pecíolos o pedúnculos en conjunto.
12% de humedad.
8% de cenizas totales y 1% de cenizas insolubles en ácido clorhídrico
al 10%, ambos expresados en base seca.
b) Contener un mínimo, expresado en base seca, de 1% de cafeína.
Los té elaborados podrán comercializarse en distintas formas, hojas, molido, bolsitas preparadas o líquida como infusión o reconstituida con agua, ya sea solo o en mezcla, los que, al igual que todos los alimentos, deben rotularse y comercializarse de acuerdo a lo establecido en el Título II, párrafo II, del Reglamento Sanitario de los Alimentos, de acuerdo a sus características y composición.
Té en polvo soluble o té instantáneo es el producto resultante de la deshidratación del extracto obtenido, exclusivamente, a partir del té hasta consistencia de polvo. No debe tener menos de 2,0% de cafeína en base seca y su humedad no debe ser mayor a 5%.
Párrafo II
De la Yerba Mate
Artículo 454.- Yerba Mate es el producto constituido por hojas, ramas jóvenes, brotes, pecíolos o pedúnculos desecados, ligeramente tostados o desmenuzados, de especies del género Ilex (I.brasiliensis, I. paraguariensis). La yerba mate elaborada debe cumplir con los siguientes requisitos:
a) contener un mínimo de 0,7% de cafeína y de 25% de extracto acuoso, expresados en base seca;
b) no contener más de 11% de humedad 9% de cenizas totales, 1,5% de cenizas insolubles en ácido clorhídrico al 10% y 30% de palos que no pasen por un tamiz con perforaciones de 70 mm de largo y 2,5 mm de ancho.
c) no contener sustancias vegetales extrañas: máximo 1,0%, semillaDecreto 32, SALUD
Art. 1 N° 3
D.O. 26.01.2013s de yerba mate: máximo 1,0% y no deberá estar quemada, alterada o agotada.
Art. 1 N° 3
D.O. 26.01.2013s de yerba mate: máximo 1,0% y no deberá estar quemada, alterada o agotada.
La yerba mate podrá comercializarse en distintas formas, hojas, polvo, preparada o líquida como infusión o reconstituida con agua, ya sea sola o en mezcla, los que al igual que todos los alimentos deben rotularse y comercializarse según lo establecido en el Título II, párrafo II, del Reglamento Sanitario de los Alimentos, de acuerdo a sus características y composición."
Párrafo III
Del café
Artículo 455.- Café tostado es el productoDTO 475, SALUD
Art. Unico, N° 125
D.O. 13.01.2000 constituido por las semillas sanas y limpias de las diferentes especies del género Coffea, que por medio del calor han tomado una coloración oscura y aroma característico. No contendrá más de: 5% de granos carbonizados 1% de materias extrañas 5% de humedad Contendrá como mínimo 0,9% de cafeína y 20% de extracto acuoso, ambos expresados en base seca. El café tostado descafeinado no deberá tener más de 0,1% de cafeína, expresado en base seca.
Art. Unico, N° 125
D.O. 13.01.2000 constituido por las semillas sanas y limpias de las diferentes especies del género Coffea, que por medio del calor han tomado una coloración oscura y aroma característico. No contendrá más de: 5% de granos carbonizados 1% de materias extrañas 5% de humedad Contendrá como mínimo 0,9% de cafeína y 20% de extracto acuoso, ambos expresados en base seca. El café tostado descafeinado no deberá tener más de 0,1% de cafeína, expresado en base seca.
Artículo 456.- Café Decreto 38, SALUD
Art. 1 N° 5
D.O. 02.02.2021soluble o café instantáneo es el producto resultante de la deshidratación del extracto obtenido exclusivamente a partir del café en grano recientemente tostado y secado hasta consistencia de polvo o gránulo, sin adición de otros ingredientes. Su contenido de humedad no debe ser mayor a 5%.
Art. 1 N° 5
D.O. 02.02.2021soluble o café instantáneo es el producto resultante de la deshidratación del extracto obtenido exclusivamente a partir del café en grano recientemente tostado y secado hasta consistencia de polvo o gránulo, sin adición de otros ingredientes. Su contenido de humedad no debe ser mayor a 5%.
El café soluble o instantáneo descafeinado no deberá tener más de 0,3% de cafeína, expresado en base seca.
El café tostado y café soluble o instantáneo, descafeinado o no, se pDecreto 32, SALUD
Art. 1 N° 4
D.O. 26.01.2013odrá comercializar en distintas formas, grano, polvo, preparados o líquidos como infusión o reconstituidos con agua, ya sea solo o en mezcla, los que, al igual que todos los alimentos, deben rotularse y comercializarse según lo establecido en el Título II, párrafo II, del Reglamento Sanitario de los Alimentos, de acuerdo a sus características y composición.
Art. 1 N° 4
D.O. 26.01.2013odrá comercializar en distintas formas, grano, polvo, preparados o líquidos como infusión o reconstituidos con agua, ya sea solo o en mezcla, los que, al igual que todos los alimentos, deben rotularse y comercializarse según lo establecido en el Título II, párrafo II, del Reglamento Sanitario de los Alimentos, de acuerdo a sus características y composición.
Artículo 457.- Sucedáneos del café son aquellos productos de origen vegetal (soya, higo, achicoria u otros), que desecados y/o tostados o tostados con azúcar o en mezcla, permiten la preparación de infusiones semejantes a la del café. La naturaleza de sucedáneo de café debe estar claramente indicada en el rótulo.
Artículo 458.- Sucedáneo del café instantáneo o soluble es el producto resultante de la deshidratación del extracto acuoso de los sucedáneos del café mencionados en el artículo anterior. Su humedad no será mayor a 5% . La naturaleza de sucedáneo de café instantáneo o soluble deberá estar claramente indicada en el rótulo.
Los sucedáneos del café y los sucedáneos del café soluble o instantáneDecreto 32, SALUD
Art. 1 N° 5
D.O. 26.01.2013o se podrán comercializar en distintas formas, polvo, preparados o líquidos como infusión o reconstituidos con agua, ya sea solo o en mezcla, los que, al igual que todos los alimentos, deben rotularse y comercializarse según lo establecido en el Título II, del párrafo II, del Reglamento Sanitario de los Alimentos, de acuerdo a sus características y composición.
Art. 1 N° 5
D.O. 26.01.2013o se podrán comercializar en distintas formas, polvo, preparados o líquidos como infusión o reconstituidos con agua, ya sea solo o en mezcla, los que, al igual que todos los alimentos, deben rotularse y comercializarse según lo establecido en el Título II, del párrafo II, del Reglamento Sanitario de los Alimentos, de acuerdo a sus características y composición.
Párrafo IV
De las hierbas aromáticas
Artículo 459.- La denominación de hierbas aromáticas comprende ciertas plantas o partes de ellas (raíces, rizomas, bulbos, hojas, cortezas, flores, frutos y semillas) que contienen sustancias aromáticas, y que por sus sabores característicos, se destinan a la preparación de infusiones de agrado.DTO 475, SALUD
Art. Unico, N° 126
D.O. 13.01.2000
Art. Unico, N° 126
D.O. 13.01.2000
Artículo 460.- Las hierbas aromáticas deben ser genuinas, sanas, presentar las características macroscópicas y microscópicas que les son propias. No deben contener materias o cuerpos extraños a su naturaleza ni más de 20% de otras partes del vegetal exentas de valor como aromatizantes.
Artículo 461.- Las hierbas aromáticas deben contener la totalidad de sus principios activos y otros metabolitos secundarios de importancia para su caracterización química.
Artículo 462.- Las hierbas aromáticas puedenDTO 115, SALUD
Art. primero Nº 22
D.O. 25.11.2003 expenderse enteras o molidas, ya sea solas o en mezclas.
Art. primero Nº 22
D.O. 25.11.2003 expenderse enteras o molidas, ya sea solas o en mezclas.
NOTA:
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
Artículo 463.- Las hierbas aromáticas no deberán tener materias o sustancias contaminantes en niveles nocivos para la salud, ni principios activosDTO 115, SALUD
Art. primero Nº 23
D.O. 25.11.2003 en concentraciones terapéuticas, asimismo las hierbas aromáticas/infusiones no deberán estar afectas a la ley Nº 19.366, que sanciona el tráfico ilícito de estupefacientes y sustancias sicotrópicas.
Art. primero Nº 23
D.O. 25.11.2003 en concentraciones terapéuticas, asimismo las hierbas aromáticas/infusiones no deberán estar afectas a la ley Nº 19.366, que sanciona el tráfico ilícito de estupefacientes y sustancias sicotrópicas.
NOTA:
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
Artículo 464.- Las hierbas aromáticas debenDTO 475, SALUD
Art. Unico, N° 127
D.O. 13.01.2000 envasarse en materiales apropiados que permitan conservar en condiciones óptimas su sabor y aroma.
Art. Unico, N° 127
D.O. 13.01.2000 envasarse en materiales apropiados que permitan conservar en condiciones óptimas su sabor y aroma.
Las hierbas aromáticas se podrán comercializar en distintas forDecreto 32, SALUD
Art. 1 N° 6
D.O. 26.01.2013mas, hojas, polvo o bolsitas, preparada o líquida como infusión o reconstituidas con agua, ya sea solas o en mezcla, las que, al igual que todos los alimentos, deben rotularse y comercializarse según lo establecido en el Título II, párrafo II, del Reglamento Sanitario de los Alimentos, de acuerdo a sus características y composición.
Art. 1 N° 6
D.O. 26.01.2013mas, hojas, polvo o bolsitas, preparada o líquida como infusión o reconstituidas con agua, ya sea solas o en mezcla, las que, al igual que todos los alimentos, deben rotularse y comercializarse según lo establecido en el Título II, párrafo II, del Reglamento Sanitario de los Alimentos, de acuerdo a sus características y composición.
TITULO XXV
De las comidas y platos preparados
Artículo 465.- Comidas o platos preparados son aquellas elaboraciones culinarias que se expenden, listos para su consumo, sean fríos o calientes o que requieran sólo de un proceso de calentamiento.
Las materias primas, ingredientes y el producto final deberán cumplir con los requisitos establecidos en este reglamento.
Artículo 466.- Las comidas o platos preparados que se expendan calientes deberán mantenerse y transportarse en receptáculos térmicos que aseguren la conservación de éstas a una temperatura uniforme y permanente de 65ºC. Las comidas o platos preparados que se expendan fríos deberán conservarse y transportarse a una temperatura máxima de 5ºC.
Esta disposición rige igualmente sobre la distribución de alimentos en todo tipo de transporte de pasajeros.
Artículo 467.- Las vitrinas en que se exhiban comidas o platos preparados deberán cumplir con los requisitos establecidos en este reglamento.
Decreto 13, SALUD
Art. 1 N° 7
D.O. 26.06.2015 Artículo 468.- Las comidas o platos preparados que se presenten envasados para la venta, que se expendan para llevar en porciones y/o variedades predefinidas por el elaborador deberán rotularse con el nombre del alimento, domicilio del establecimiento elaborador del alimento, nombre del representante legal de este último, número y fecha de la resolución sanitaria que autorizó el funcionamiento de dicho establecimiento de alimentos y nombre de la autoridad sanitaria que la emitió, fecha de elaboración, fecha de vencimiento o plazo de duración del producto, instrucciones para el almacenamiento, contenido neto y toda la información descrita en el artículo 115 del presente reglamento, salvo el número de porciones por envase.
Art. 1 N° 7
D.O. 26.06.2015 Artículo 468.- Las comidas o platos preparados que se presenten envasados para la venta, que se expendan para llevar en porciones y/o variedades predefinidas por el elaborador deberán rotularse con el nombre del alimento, domicilio del establecimiento elaborador del alimento, nombre del representante legal de este último, número y fecha de la resolución sanitaria que autorizó el funcionamiento de dicho establecimiento de alimentos y nombre de la autoridad sanitaria que la emitió, fecha de elaboración, fecha de vencimiento o plazo de duración del producto, instrucciones para el almacenamiento, contenido neto y toda la información descrita en el artículo 115 del presente reglamento, salvo el número de porciones por envase.
Esta información deberá estar impresa en el envase o contenida en una etiqueta adherida al mismo, de modo visible, indeleble y fácil de leer en circunstancias normales de compra y uso.
TITULO XXVI
Del agua potable, de las aguas minerales y del hielo
Artículo 469.- Agua potable es aquella agua apta para usos alimentarios, y deberá cumplir con la normativa sanitaria vigente.
Artículo 470.- Agua mineral de mesa es aquella de composición química especial proveniente de fuentes naturales oficialmente registradas, que es apropiada para servir como bebida de uso común y cuya mineralización es inferior a 1,5 g/l.
Artículo 471.- El agua mineral de mesa deberáDTO 475, SALUD
Art. Unico, N° 128
D.O. 13.01.2000 obtenerse en condiciones que garantice la pureza bacteriológica original y envasarse en su fuente de origen, salvo que su aducción sea hecha desde la captación al punto de envase por medio de tuberías.
Art. Unico, N° 128
D.O. 13.01.2000 obtenerse en condiciones que garantice la pureza bacteriológica original y envasarse en su fuente de origen, salvo que su aducción sea hecha desde la captación al punto de envase por medio de tuberías.
Artículo 472.- El agua mineral natural embotellada deberá cumplir con la normativa sanitaria vigente.DTO 475, SALUD
Art. Unico, N° 129
D.O. 13.01.2000 (Decreto Nº 106 de 1997, del Ministerio de Salud, Reglamento de Aguas Minerales).
Art. Unico, N° 129
D.O. 13.01.2000 (Decreto Nº 106 de 1997, del Ministerio de Salud, Reglamento de Aguas Minerales).
Artículo 473.- El agua mineral no deberáDTO 475, SALUD
Art. Unico, N° 130
D.O. 13.01.2000 contener los contaminantes ni sobrepasar los límites de las sustancias que específicamente determina el Reglamento de Aguas Minerales.
Art. Unico, N° 130
D.O. 13.01.2000 contener los contaminantes ni sobrepasar los límites de las sustancias que específicamente determina el Reglamento de Aguas Minerales.
Artículo 474.- La rotulación del envase de agua mineral, deberá cumplir con los siguientes requisitos adicionales a los establecidos en el Título II:
a) cuando el producto contenga más de 600 mg/l de sulfato que no sea sulfato de calcio, se incluirá en forma destacada la siguiente leyenda " puede ser laxante";
b) cuando el producto contenga más de 1000 mg/l de sólidos totales disueltos o 600 mg/l de HCO3-, se incluirá en forma destacada la siguiente leyenda "puede ser diurético";
c) no se incluirá declaración alguna de propiedades o efectos medicinales.
Artículo 475.- El anhídrido carbónico empleado en la preparación de aguas de bebidas carbonatadas debe contener un mínimo de 98% de este gas y no más de 0,2% de monóxido de carbono y estará exento de sustancias extrañas que le confieran olor y/o sabor desagradable o de cualquiera otra naturaleza.
Artículo 476.- Hielo para consumo humano es el producto obtenido por congelación de agua potable. Sus características químicas y microbiológicas serán las exigidas para el agua potable.
Artículo 477.- Se prohíbe el fraccionamiento del hielo en barras para ser incorporado a los alimentos.
TITULO XXVII
De las bebidas analcohólicas, jugos de frutas yDTO 68, SALUD
Art. primero Nº 30
D.O. 23.01.2006 hortalizas y aguas envasadas
Art. primero Nº 30
D.O. 23.01.2006 hortalizas y aguas envasadas
Párrafo I
De las bebidas analcohólicas
Artículo 478.- Son bebidas analcohólicas aquellas elaboradas a base de agua potable, carbonatada o no, y adicionadas de una o más de las siguientes sustancias: azúcares, jugos de fruta, extractos vegetales, ácidos, esencias, proteínas, sales minerales, colorantes y otros aditivos permitidos; que no contengan más de 0,5% enDTO 475, SALUD
Art. Unico, N° 131
D.O. 13.01.2000 volumen de alcohol etílico, con excepción de los jarabes, los que podrán contener hasta 2,5 % en volumen de alcohol etílico.
Art. Unico, N° 131
D.O. 13.01.2000 volumen de alcohol etílico, con excepción de los jarabes, los que podrán contener hasta 2,5 % en volumen de alcohol etílico.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 479.- Bebida refrescante de fruta, es aquella bebida analcohólica a la cual se le ha adicionado jugos de frutas o sus extractos y cuyo contenido de sólidos solubles procedentes de frutas es igual o mayor al 10% m/m de los sólidos solubles de la fruta madura que se declara.
Artículo 480.- Bebida de fantasía, es aquella bebida analcohólica que no contiene jugos de frutas o sus extractos, o que ha sido adicionada de éstos pero en cantidad tal que su contenido de sólidos solubles de fruta es menor al 10% m/m.
Artículo 481.- Las bebidas analcohólicas que contengan cafeína o quinina no deberán exceder la cantidad de 180 mg/l de cafeína, ni 130 mg/l de quinina o sus sales expresadas en quinina anhidra.
Párrafo II
De los jugos, néctares y concentrados de frutas y
hortalizas
Artículo 482.- Jugo o zumo puro de fruta u hortaliza es el producto sin fermentar, pero fermentable, pulposo, turbio o claro, destinado al consumo directo, obtenido por procedimientos mecánicos a partir de frutas u hortalizas maduras en buen estado o de sus carnes y conservados exclusivamente por medios físicos. El jugo podrá haber sido concentrado y luego reconstituido con agua para conservar la composición esencial y los factores de calidad del mismo.
Los Decreto 37, SALUD
Art. 1 N° 2
D.O. 18.01.2017productos que usen la expresión de fantasía "agua de.", siendo líquidos provenientes de una especie vegetal determinada, deberán rotular, además, el nombre del alimento de que se trate, en los términos exigidos por la letra a) del artículo 107 del presente reglamento, informando la verdadera naturaleza del producto en forma específica.
Art. 1 N° 2
D.O. 18.01.2017productos que usen la expresión de fantasía "agua de.", siendo líquidos provenientes de una especie vegetal determinada, deberán rotular, además, el nombre del alimento de que se trate, en los términos exigidos por la letra a) del artículo 107 del presente reglamento, informando la verdadera naturaleza del producto en forma específica.
Artículo 483.- El jugo o zumo puro de frutas u hortalizas deberá cumplir los siguientes requisitos:
a) el contenido de sólidos solubles, con exclusión de los azúcares añadidos, será igual al contenido de sólidos solubles de la fruta u hortaliza madura de la que provenga;
b) el producto deberá tener el color, aroma y sabor característicos de la fruta u hortaliza de origen. Se permitirá la restitución de los componentes volátiles naturales del jugo cuando hayan sido extraídos, con componentes volátiles exclusivamente naturales;
c) cuando el producto lo requiera podrá añadirse uno o más de los azúcares sólidos definidos en este reglamento, en una cantidad total que no exceda los 50 g/kg, excepto para frutas muy ácidas, en cuyo caso no deberá exceder de 200 g/kg de producto terminado.
Artículo 484.- Jugo o zumo concentrado es el producto sin fermentar pero fermentable una vez reconstituido, conservado exclusivamente por medios físicos y obtenido mediante un proceso de concentración de jugo puro de fruta u hortaliza.
El producto obtenido por la reconstitución del jugo concentrado, mediante la adición de agua en la cantidad indicada por el fabricante, deberá tener las características físico-químicas y organolépticas del jugo de la fruta u hortaliza de origen.
Se permitirá el uso de coadyuvantes de elaboración, antioxidantes, antiespumantes y acidulantes establecidos en el presente reglamento.
Artículo 485.- Néctar de fruta es el producto pulposo o no pulposo, sin fermentar pero fermentable,DTO 68, SALUD
Art. primero Nº 31
D.O. 23.01.2006 obtenido mezclando el jugo o zumo de fruta y/o toda la parte comestible de frutas maduras y sanas concentrado o sin concentrar, con adición de agua y azúcares o miel, y aditivos autorizados.DTO 475, SALUD
Art. Unico, N° 132
D.O. 13.01.2000
Art. primero Nº 31
D.O. 23.01.2006 obtenido mezclando el jugo o zumo de fruta y/o toda la parte comestible de frutas maduras y sanas concentrado o sin concentrar, con adición de agua y azúcares o miel, y aditivos autorizados.DTO 475, SALUD
Art. Unico, N° 132
D.O. 13.01.2000
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 486.- El néctar de frutas deberá cumplir los siguientes requisitos:
a) el contenido de sólidos solubles de los néctares, con
exclusión de azúcares añadidos, será mayor o igual al 20% m/m
de los sólidos solubles de la fruta madura de la que
provenga;
b) podrán adicionarse uno o más azúcares sólidosDTO 475, SALUD
Art. Unico, N° 133
D.O. 13.01.2000
Art. Unico, N° 133
D.O. 13.01.2000
definidos en este reglamento. La cantidad total de
azúcar o miel adicionada no podrá exceder de 200
g/kg calculados como extracto seco, en el producto
final;
c) el producto deberá tener el color, aroma y saborDTO 475, SALUD
Art. Unico, N° 133
D.O. 13.01.2000
DTO 475, SALUD
Art. Unico, N° 133
D.O. 13.01.2000
Art. Unico, N° 133
D.O. 13.01.2000
DTO 475, SALUD
Art. Unico, N° 133
D.O. 13.01.2000
característico de la fruta con que ha sido
elaborado.
d) ELIMINADA
Artículo 487.- Los valores mínimos de sólidosDTO 68, SALUD
Art. primero
Nº 32 a)
D.O. 23.01.2006 solubles en las frutas que se enuncian a continuación son referenciales: Frutas Sólidos solubles,
Art. primero
Nº 32 a)
D.O. 23.01.2006 solubles en las frutas que se enuncian a continuación son referenciales: Frutas Sólidos solubles,
% m/m mínimo
Boysenberry 10,0
Chirimoya 7,5DTO 68, SALUD
Art. primero
Nº 32 b)
D.O. 23.01.2006
Art. primero
Nº 32 b)
D.O. 23.01.2006
Ciruela 10,0
Coco 5,0
Damasco Decreto 37, SALUD
Art. 1 N° 3
D.O. 18.01.2017 10,0
Art. 1 N° 3
D.O. 18.01.2017 10,0
Durazno 10,0
Frambuesa 10,0
Frutilla 6,0
Kiwi 8,0
Limón 6,0
Mango 10,0
Maracujá 6,0
Manzana 10,0
Melón 8,7DTO 68, SALUD
Art. primero
Nº 32 b)
D.O. 23.01.2006
Art. primero
Nº 32 b)
D.O. 23.01.2006
Membrillo 10,0
Naranja 9,0
Papaya 5,0
Pera 10,0
Piña 10,0
Pomelo 9,0
Tomate 6,0
Uva 13,0
En mezclas de frutas se deberá considerar como base la fruta que se encuentre en mayor proporción de acuerdo a lo declarado en la rotulación.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que las modificaciones introducidas al presente artículo rigen a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que las modificaciones introducidas al presente artículo rigen a contar de 180 días después de su publicación.
Párrafo IIIDTO 68, SALUD
Art. primero Nº 33
D.O. 23.01.2006
Art. primero Nº 33
D.O. 23.01.2006
De las aguas envasadas
Artículo 487 A.- Aguas envasadas, son aguasDTO 68, SALUD
Art. primero Nº 33
D.O. 23.01.2006 potables tratadas que pueden ser o no purificadas (destilación, nanofiltración, osmosis inversa o cualquier otro método similar) y podrán ser coloreadas, saborizadas, carbonatadas, mineralizadas, y debiendo estar exentas de edulcorantes naturales y/o artificiales.
Art. primero Nº 33
D.O. 23.01.2006 potables tratadas que pueden ser o no purificadas (destilación, nanofiltración, osmosis inversa o cualquier otro método similar) y podrán ser coloreadas, saborizadas, carbonatadas, mineralizadas, y debiendo estar exentas de edulcorantes naturales y/o artificiales.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 487 B.- Las aguas envasadas sin gasDTO 68, SALUD
Art. primero Nº 33
D.O. 23.01.2006 deberán ser sometidas a procesos necesarios para asegurar su calidad sanitaria, estos procesos pueden ser: ozonificación, UV o cualquier otro que asegure la inocuidad del producto envasado.
Art. primero Nº 33
D.O. 23.01.2006 deberán ser sometidas a procesos necesarios para asegurar su calidad sanitaria, estos procesos pueden ser: ozonificación, UV o cualquier otro que asegure la inocuidad del producto envasado.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 487 C.- Las aguas envasadas solo podránDTO 68, SALUD
Art. primero Nº 33
D.O. 23.01.2006 expenderse cuando contengan electrolitos y deberán contener como mínimo 10 mg/l de sólidos totales.
Art. primero Nº 33
D.O. 23.01.2006 expenderse cuando contengan electrolitos y deberán contener como mínimo 10 mg/l de sólidos totales.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 487 D.- A las aguas envasadas se lesDTO 68, SALUD
Art. primero Nº 33
D.O. 23.01.2006 podrán incorporar nutrientes, en concentraciones según la normativa respectiva. Los nutrientes incorporados a estas aguas no deberán estar comprendidos en los programas de Salud Pública, en este tipo de productos.
Art. primero Nº 33
D.O. 23.01.2006 podrán incorporar nutrientes, en concentraciones según la normativa respectiva. Los nutrientes incorporados a estas aguas no deberán estar comprendidos en los programas de Salud Pública, en este tipo de productos.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 487 E.- La rotulación de las aguasDTO 68, SALUD
Art. primero Nº 33
D.O. 23.01.2006 envasadas deberá incluir, la composición y concentración de las sales minerales o electrolitos, según corresponda a su definición, la que será adicional a los requisitos de rotulación establecidos en el Título II Párrafo II del presente Reglamento.
Art. primero Nº 33
D.O. 23.01.2006 envasadas deberá incluir, la composición y concentración de las sales minerales o electrolitos, según corresponda a su definición, la que será adicional a los requisitos de rotulación establecidos en el Título II Párrafo II del presente Reglamento.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 487 F.- El anhídrido carbónico empleado enDTO 68, SALUD
Art. primero Nº 33
D.O. 23.01.2006 la elaboración de aguas envasadas, debe contener un mínimo de 98% de este gas y no más de 0,2% de monóxido de carbono y estará exento de sustancias extrañas que le confieran olor y/o sabor desagradable o de cualquier otra naturaleza.
Art. primero Nº 33
D.O. 23.01.2006 la elaboración de aguas envasadas, debe contener un mínimo de 98% de este gas y no más de 0,2% de monóxido de carbono y estará exento de sustancias extrañas que le confieran olor y/o sabor desagradable o de cualquier otra naturaleza.
NOTA:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
TITULO XXVIII
De los alimentos para regimenes especiales
Párrafo I
Disposiciones generales
Artículo 488.- Los alimentos Decreto 24, SALUD
Art. 1 Nº 3
D.O. 24.11.2011para regímenes especiales son aquellos elaborados o preparados, especialmente, para satisfacer necesidades fisiológicas o fisiopatológicas, particulares de nutrición.
Art. 1 Nº 3
D.O. 24.11.2011para regímenes especiales son aquellos elaborados o preparados, especialmente, para satisfacer necesidades fisiológicas o fisiopatológicas, particulares de nutrición.
Los productos regulados por este artículo deberán formularse de acuerdo a principios médicos y nutricionales aceptados, científicamente reconocidos o consensuados internacionalmente y deberán satisfacer las necesidades particulares de nutrición que indica el productor. Se excluyen de esta categoría los alimentos de uso por vía parenteral, los que serán regulados por el decreto supremo Nº 1.876/05 del Ministerio de Salud.
Artículo 489.- Los alimentosDecreto 24, SALUD
Art. 1 Nº 4
D.O. 24.11.2011 para regímenes especiales, sin perjuicio del cumplimiento de las normas generales de etiquetado del presente reglamento, deberán indicar en la cara principal del envase la(s) característica(s) esencial(es) o modificación(es) realizada(s).
Art. 1 Nº 4
D.O. 24.11.2011 para regímenes especiales, sin perjuicio del cumplimiento de las normas generales de etiquetado del presente reglamento, deberán indicar en la cara principal del envase la(s) característica(s) esencial(es) o modificación(es) realizada(s).
La información y rotulación nutricional de los alimentos comprendidos en el párrafo II del presente Título, deberán expresarse por cada 100 g o 100 ml, según corresponda y por cada 100 kilocalorías (kcal) utilizables del producto, opcional por cada porción del producto listo para el consumo.
La información y rotulación nutricional de los alimentos comprendidos en el párrafo III del presente Título deberán expresarse por cada 100 g o 100 ml, según corresponda, y por cada porción del producto listo para el consumo, opcional por cada 100 kilocalorías (kcal) utilizables del producto.
La información y rotulación nutricional de los alimentos comprendidos en el párrafo V del presente Título deberán expresarse por cada 100 g o 100 ml, según corresponda, y por cada 100 kilocalorías (kcal) utilizables del producto, opcional por cada porción del producto listo para el consumo.
La información y rotulación nutricional de los alimentos para uso médico o medicinal para mayores de 36 meses deberá dar cumplimiento a lo establecido en el Título II del presente Reglamento.
Párrafo II
De las fórmulas para lactantes
Artículo 493.- Las Decreto 13, SALUD
Art. 1 N° 1
D.O. 03.07.2019fórmulas para lactantes son aquellos productos que satisfacen los requerimientos nutricionales de los lactantes, cuando la alimentación con leche materna no es posible o es insuficiente.
Art. 1 N° 1
D.O. 03.07.2019fórmulas para lactantes son aquellos productos que satisfacen los requerimientos nutricionales de los lactantes, cuando la alimentación con leche materna no es posible o es insuficiente.
Se entiende por lactantes a los niños que tengan hasta 12 meses de edad.
La información y rotulación nutricional de estas fórmulas deberán expresarse por cada 100g o 100ml, según corresponda, y por cada 100 kilocalorías (kcal) utilizables del producto, así como por 100 ml del producto listo para el consumo, de acuerdo a las instrucciones indicadas por el fabricante. Además, deberá declararse la cantidad total de cada vitamina, mineral y cuando corresponda los "ingredientes opcionales" referidos en el artículo 495.
Artículo 494.- Las fórmulas para lactantes se clasifican en:
a) fórmula Decreto 13, SALUD
Art. 1 N° 2
D.O. 03.07.2019de inicio: es el producto líquido o en polvo para reconstituir, especialmente fabricados para satisfacer por sí solo las necesidades nutricionales de los lactantes durante al menos los primeros seis meses de vida en reemplazo de la leche materna, cuando no sea posible o sea insuficiente la alimentación con ésta. Debe estar fabricada a base de leche de vaca o de otros animales, o de mezclas de la leche de éstos, o de otros ingredientes autorizados por este reglamento.
Art. 1 N° 2
D.O. 03.07.2019de inicio: es el producto líquido o en polvo para reconstituir, especialmente fabricados para satisfacer por sí solo las necesidades nutricionales de los lactantes durante al menos los primeros seis meses de vida en reemplazo de la leche materna, cuando no sea posible o sea insuficiente la alimentación con ésta. Debe estar fabricada a base de leche de vaca o de otros animales, o de mezclas de la leche de éstos, o de otros ingredientes autorizados por este reglamento.
b) fórmula de continuación: es aquella que forma parte de un esquema de alimentación mixta destinada al consumo de los lactantes de más de seis meses hasta los 12 meses de edad.
c) fórmulas para lactantes con necesidades nutricionales especiales, tales como, intolerancia Decreto 106, SALUD
Art. 1 Nº 33
D.O. 23.04.2009a la lactosa, intolerancia al gluten, fenilcetonuria u otros problemas metabólicos. Éstas deberán indicar en el rótulo en forma clara y destacada la necesidad especial para la que debe emplearse, las propiedades específicas en que se basa y recomendaciones concretas y advertencias en relación a su consumo, si fuese necesario.
Art. 1 Nº 33
D.O. 23.04.2009a la lactosa, intolerancia al gluten, fenilcetonuria u otros problemas metabólicos. Éstas deberán indicar en el rótulo en forma clara y destacada la necesidad especial para la que debe emplearse, las propiedades específicas en que se basa y recomendaciones concretas y advertencias en relación a su consumo, si fuese necesario.
Artículo 495.- El Decreto 13, SALUD
Art. 1 N° 3
D.O. 03.07.2019producto debe haber sido elaborado exclusivamente por medios físicos y envasado de manera que se evite su alteración y contaminación en cualquier condición normal de manipulación, almacenamiento, distribución y venta.
Art. 1 N° 3
D.O. 03.07.2019producto debe haber sido elaborado exclusivamente por medios físicos y envasado de manera que se evite su alteración y contaminación en cualquier condición normal de manipulación, almacenamiento, distribución y venta.
Asimismo, deberá estar fabricada a base de leche de vaca o de otros animales o de mezclas de leches de distintos animales o de otros ingredientes sobre los cuales se haya demostrado que son idóneos para la alimentación de los lactantes. Deberá estar científicamente demostrada la inocuidad, así como la idoneidad nutricional, para favorecer el crecimiento y el desarrollo de los lactantes. Estas fórmulas deberán ser libres de gluten.
La fórmula de inicio reconstituida deberá presentar la siguiente composición:
a)
Energía mínimo máximo
60 kcal/100 ml 70 kcal/100 ml
b)
Proteínas mínimo máximo
1,8 g/100 kcal 3,0 g/100 kcal
Cuando las fórmulas a base de proteínas de la leche no hidrolizadas, contengan menos de 2 g de proteínas/100 kcal y, cuando las fórmulas para lactantes a base de proteínas hidrolizadas contengan menos de 2,25 g de proteínas/100 kcal, deberán mantener los antecedentes de las evaluaciones clínicas realizadas, disponibles para cuando la autoridad sanitaria los requiera.
El valor mínimo de proteínas de 1,8 g/100kcal se aplica a las proteínas de la leche de vaca o de otros animales o mezcla de la leche de éstos. En las fórmulas a base de aislados de proteínas de soya, en cambio, se aplica un valor mínimo de 2,25 g/100 kcal.
El cálculo del contenido de proteínas de la fórmula final preparada y lista para el consumo deberá basarse en N x 6,25, salvo que se proporcione una justificación científica para el uso de un factor de conversión diferente aplicable a un determinado producto.
La fórmula debe contener una cantidad disponible de cada aminoácido esencial y semiesencial igual, al menos, a la que contiene la proteína de referencia, según se define en la Tabla Nº 1 del presente artículo. No obstante, a efectos de cálculo, las concentraciones de tirosina y fenilalanina pueden sumarse. Las concentraciones de metionina y cisteína pueden sumarse si la proporción es inferior a 2:1; si la proporción se sitúa entre 2:1 y 3:1, la idoneidad de la fórmula debe demostrarse por medio de ensayos clínicos.
Podrán añadirse al preparado para lactantes aminoácidos aislados únicamente a fin de mejorar su valor nutritivo para los lactantes. Para mejorar la calidad de las proteínas, podrán añadirse aminoácidos esenciales y semiesenciales, pero sólo en las cantidades necesarias a tal efecto. Sólo podrán utilizarse las formas L de los aminoácidos.
Tabla Nº 1: Contenido de aminoácidos de la proteína de referencia de la leche humana*
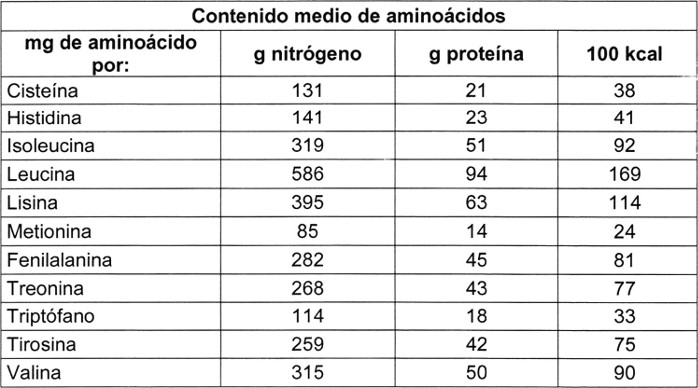 .
. * Adaptado del Codex Stan 72, revisado en 2016.
c)
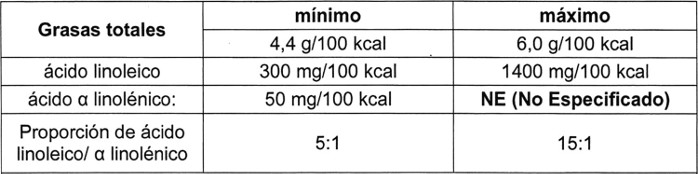 .
. Se prohíbe la utilización de aceite de sésamo y aceite de algodón.
Los ácidos láurico y mirístico en conjunto no deberán superar el 20% del contenido total de ácidos grasos.
Los ácidos grasos trans solamente serán de origen lácteo. El contenido de ácidos grasos trans no deberá ser superior al 3% del contenido total de ácidos grasos.
El contenido de ácido erúcico no deberá superar el 1% del contenido total de ácidos grasos.
El contenido total de fosfolípidos no deberá superar los 300mg/100kcal.
No se podrán utilizar aceites o grasas hidrogenadas comercialmente.
d)
mínimo máximo
Carbohidratos disponibles 9 g/100 kcal 14 g/100 kcal
La lactosa y los polímeros de glucosa deberán ser los carbohidratos preferentes para las fórmulas a base de proteínas de la leche de vaca y de proteínas hidrolizadas. Solo podrán añadirse almidones exentos de gluten precocidos o gelatinizados hasta un máximo de 30% del contenido total de carbohidratos y hasta un máximo de 2 g/100 ml de la fórmula reconstituida.
Deberá evitarse el uso de sacarosa y fructosa: La sacarosa sólo se puede añadir a fórmulas para lactantes con base en proteínas hidrolizadas. Si se añade, el contenido de sacarosa no deberá exceder el 20% del contenido total de hidratos de carbono. Este agregado deberá señalarse en forma destacada en la cara principal del envase.
e)
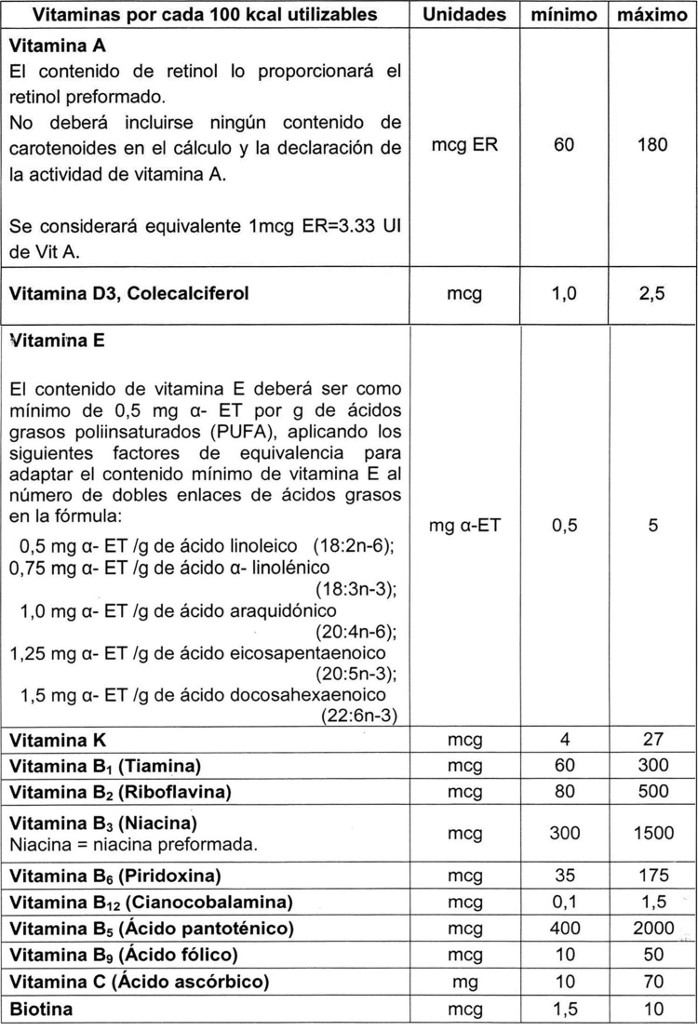 .
. f)
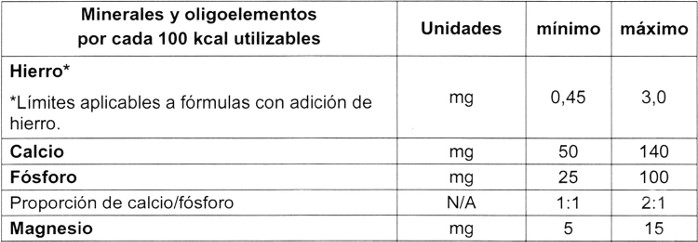 .
.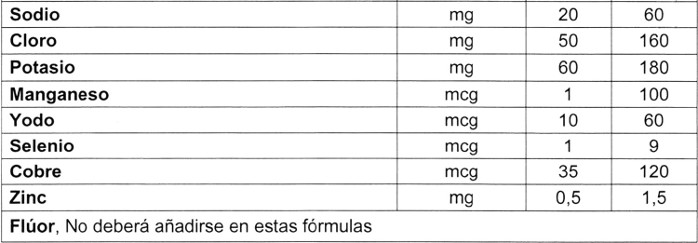 .
. g) Otras sustancias:
Deberán añadirse las sustancias que se indican a continuación, en cuyo caso su contenido por 100 kcal en la fórmula lista para el consumo deberá estar entre los límites siguientes:
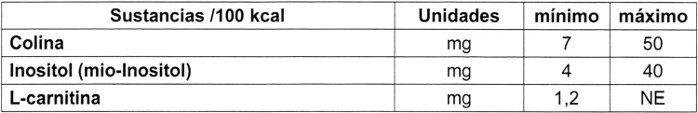 .
. h) Ingredientes opcionales
Se podrán adicionar los siguientes ingredientes opcionales de acuerdo a los límites de la siguiente tabla:
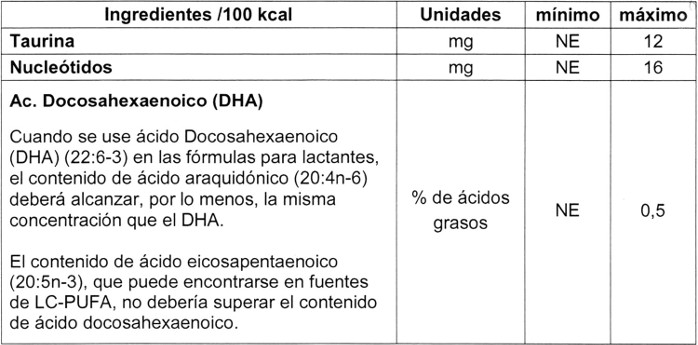 .
. Podrán añadirse otras sustancias que normalmente están presentes en la leche humana, para mejorar la calidad nutricional de las fórmulas. La idoneidad e inocuidad de estas sustancias deberán estar demostradas científicamente. La fórmula deberá contener las cantidades sobre la base de su presencia en la leche humana.
Podrán emplearse únicamente cultivos que produzcan ácido láctico L (+).
i) Aditivos
Sólo se podrán usar los siguientes aditivos en las cantidades señaladas:
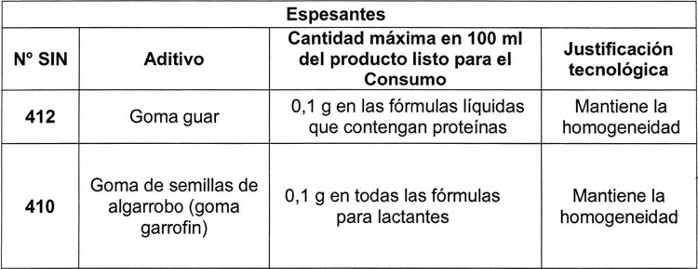 .
.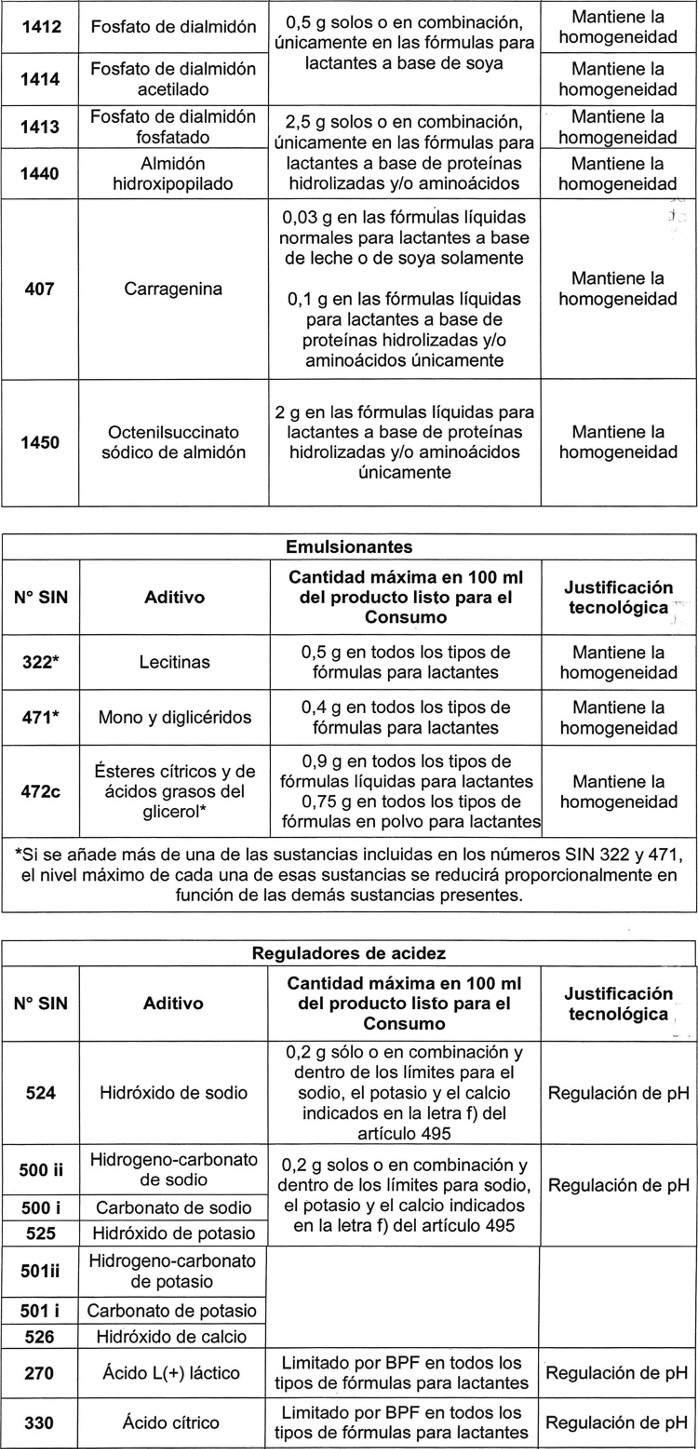 .
.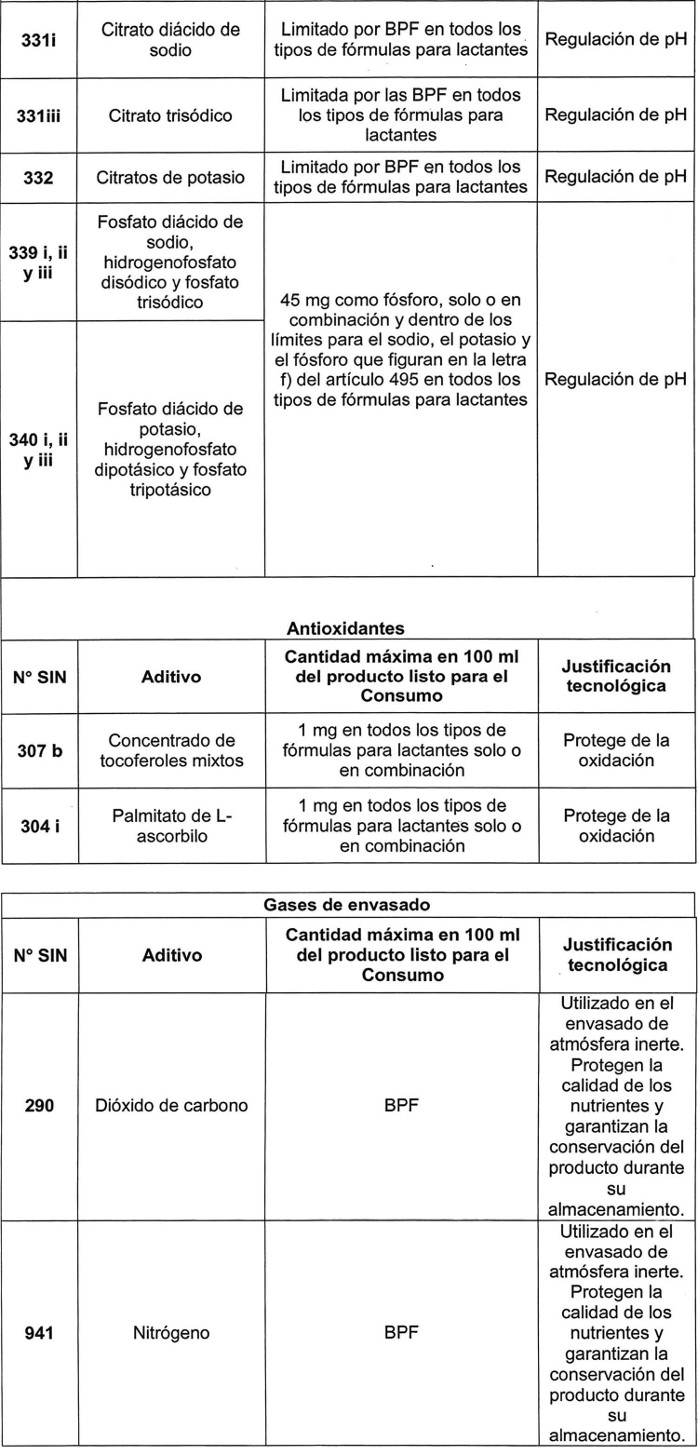 .
.Decreto 106, SALUD
Art. 1 Nº 35
D.O. 23.04.2009 Artículo 496.- La fórmula de continuación reconstituida deberá presentar la siguiente composición básica:
Art. 1 Nº 35
D.O. 23.04.2009 Artículo 496.- La fórmula de continuación reconstituida deberá presentar la siguiente composición básica:
a) energía: mínimo 60 kcal/100 ml
máximo 85 kcal/100 ml
b) proteínas: mínimo 3 g/100 kcal
máximo 5,5 g/100 kcal
c) lípidos: mínimo 3,0 g/100 kcal
máximo 6,0 g/100 kcal
-ácido linoleico:
mínimo : 300 mg/100 kcal
máximo : 1400 mg/100Kcal.
- ácido α-linolénico
mínimo : 50 mg/100 kcal
máximo : N.E. (No Especificado)
Proporción de ácido linoleico/ α-linolénico
mínimo 5:1
máximo 15:1
Se prohíbe la utilización de aceite de sésamo y aceite de algodón
Los ácidos láurico y mirístico en conjunto no deberán superar el 20% del contenido total de ácidos grasos.
El contenido de ácidos grasos trans no deberá ser superior al 3% del contenido total de ácidos grasos.
El contenido de ácido erúcico no deberá superar el 1% del contenido total de ácidos grasos.
El contenido total de fosfolípidos no deberá superar los 300 mg/100 kcal.
En los preparados para lactantes no se utilizarán aceites y grasas hidrogenadas comercialmente
d) carbohidratos: mínimo 7 g/100 kcal.
máximo 14 g/100 kcal.
-Lactosa: mínimo 1,8 g/100 kcal.
-Sacarosa,
glucosa, fructosa,
miel: máximo 20% del contenido total
de carbohidratos por separado o
en conjunto.
e) sales minerales por cada 100 kcal utilizables:Decreto 117, SALUD
Art. 1 N° 1
D.O. 17.09.2014
Art. 1 N° 1
D.O. 17.09.2014
Mín. Máx.
Hierro (mg) 0,45 3
Sodio (mg) 20 60
Potasio (mg) 60 180
Cloro (mg) 50 160
Calcio (mg) 50 140
Fósforo (mg) 25 100
Magnesio (mg) 5 15
Zinc (mg) 0,5 1,5
Cobre (mcg) 35 120
Yodo (mcg) 10 60
Manganeso (mcg) 1 100
Selenio (mcg) 1 9
Mín. Máx.
Relación
calcio/fósforo 1:1 2:1
f) vitaminas por cada 100 kcal utilizables.
Mín. Máx.
Vitamina A
(mcg retinol) 75 225
Vitamina D
(mcg colecalciferol) 1 3
Tiamina (mcg) 40 300
Riboflavina (mcg) 60 500
Nicotinamida
(mcg niacina) 250 1500
Ácido pantoténico
(mcg) 300 2000
Vitamina B6 (mcg) 45 175
los preparados
deberán contener un
mínimo de 15 mcg de
vitamina B6/g de
proteína
Biotina (mcg) 1,5 10
Ácido fólico (mcg) 4 50
Vitamina B12 (mcg) 0,2 1,5
Vitamina C (mg) 8 70
Vitamina K (mcg) 4 27
Vitamina E
(mg-tocoferol) 0,5 5 mg/g de ácidos grasos
poliinsaturados
expresados como
ácido linoleico.
En ningún caso será
inferior a 0,5
mg/100 kcal
disponibles.
g) Otras sustancias: Decreto 24, SALUD
Art. 1 Nº 8
D.O. 24.11.2011por cada 100 kcal.
Art. 1 Nº 8
D.O. 24.11.2011por cada 100 kcal.
Mín. Máx.
Mioinositol (mg) 4 40
L- carnitina (mg) 1,2 NE
h) Ingredientes facultativos
Min. Máx.
h.1) Taurina (mg) por cada 100 kcal - 12
h.2) Ac. Docosahexaenoico (% total de lípidos) - 0,5
Cuando se use ácido Docosahexaenoico (DHA) (22:6-3) en los preparados para lactantes, el contenido de ácido araquidónico (20:4n-6) deberá alcanzar, por lo menos, la misma concentración que el DHA.
Mín. Máx.
h.3) Nucleótidos: mg/100 Kcal - 16
i) aditivos.
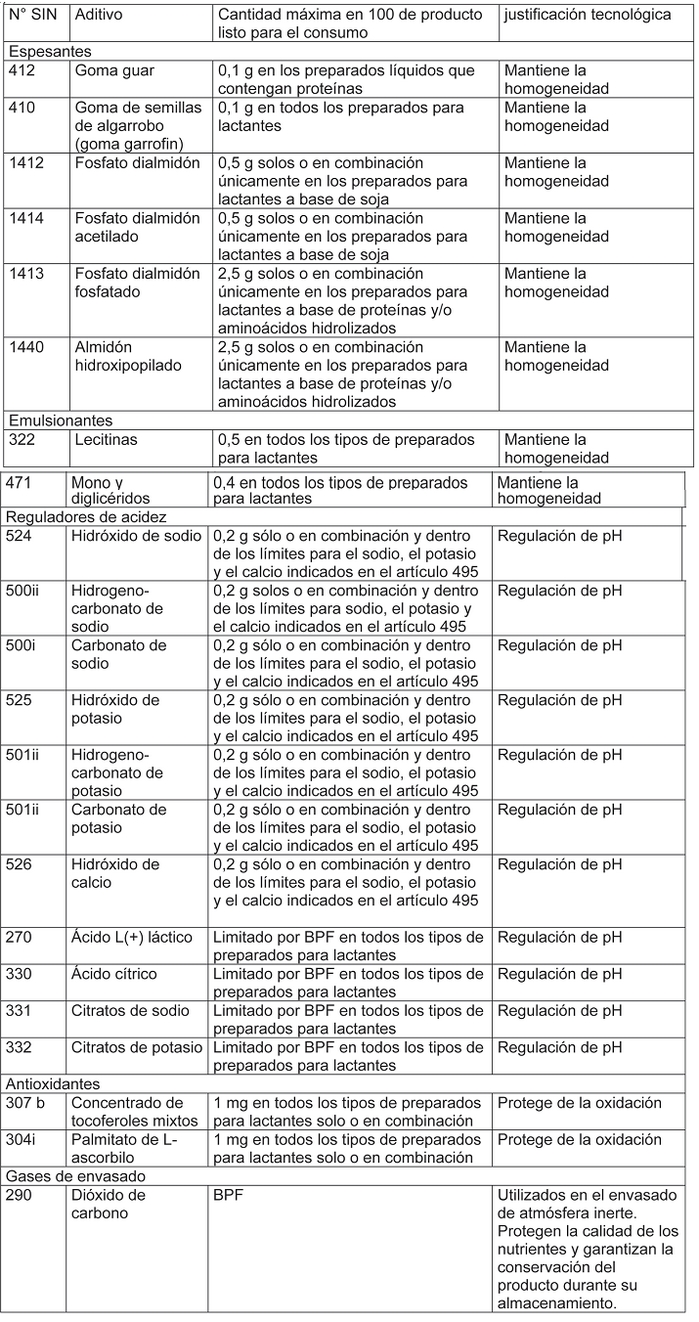
Decreto 106, SALUD
Art. 1 Nº 36
D.O. 23.04.2009 Artículo 497.- Además de lo dispuesto en el presente reglamento para etiquetado general y para regímenes especiales, en la rotulación y/o publicidad de cualquier tipo de las fórmulas para lactantes sólo podrá proveerse la siguiente información, la que, además, tiene el carácter de obligatoria:
Art. 1 Nº 36
D.O. 23.04.2009 Artículo 497.- Además de lo dispuesto en el presente reglamento para etiquetado general y para regímenes especiales, en la rotulación y/o publicidad de cualquier tipo de las fórmulas para lactantes sólo podrá proveerse la siguiente información, la que, además, tiene el carácter de obligatoria:
a) origen de las proteínas que contiene el producto. Si el 90% de las proteínas como mínimo, procede de leche deberá denominarse "Fórmula para lactantes a base de leche"; si el producto no contiene leche ni ninguno de sus derivados deberá indicarse "no contiene leche ni productos lácteos".
b) rotulación del valor energético disponible (expresado en kcal), contenido de proteínas, lípidos y carbohidratos disponibles (expresados en gramos), los que deberán expresarse según Artículo 491 del presente Reglamento.
c) rotulación de otros nutrientes opcionales, los que deberán rotularse de acuerdo al Artículo 491 del presente reglamento
d) los productos que contengan un mínimo de 1 mg de hierro por 100 kcal utilizables deberán tener la denominación "Fórmula con hierro para lactantes".
e) deberá indicarse en caracteres destacados que la fórmula "NO SUSTITUYE A LA LECHE MATERNA".
f) En la rotulación y publicidad de las fórmulas para lactantes queda totalmente prohibido el uso de los términos "humanizada", "maternalizada" u otros similares y de imágenes que puedan inducir a la indebida comparación con la lactancia materna o a desalentar su práctica, como por ejemplo, lactantes, mujeres, biberones, entre otros.
g) Asimismo la etiqueta de cada envase deberá contener un mensaje claro, visible y fácilmente legible que incluya las palabras "AVISO IMPORTANTE: LA LECHE MATERNA ES EL MEJOR ALIMENTO PARA SU NIÑO/A" o una declaración equivalente que exprese inequívocamente la superioridad de la leche materna por sobre las fórmulas para lactantes.
h) Deberá advertirse la necesidad de combinar el alimento para lactantes con alimentación complementaria adecuada al desarrollo del menor, a partir de los 6 meses de edad.
i) el producto destinado a lactantes con necesidades especiales de nutrición, deberá indicar la necesidad especial para la que va a emplearse la fórmula y la propiedad o las propiedades dietéticas en que se basa.
j) Deberá informarse que el producto debe ser usado únicamente bajo indicación de un profesional de la salud.
k) Deberá rotularse, además, la fecha de elaboración y la fecha de vencimiento e instrucciones sobre su correcta preparación y uso, así como su almacenamiento y conservación antes y después de abrir el envase.
Artículo 497 bis.- Se Decreto 24
Art. 1 N° 2
D.O. 28.11.2017prohíbe toda acción de publicidad de fórmulas de inicio y fórmulas de continuación hasta los 12 meses de edad, de las que trata el presente párrafo, tales como:
Art. 1 N° 2
D.O. 28.11.2017prohíbe toda acción de publicidad de fórmulas de inicio y fórmulas de continuación hasta los 12 meses de edad, de las que trata el presente párrafo, tales como:
- El ofrecimiento o entrega a título gratuito de productos o muestras de éstos.
- La distribución de regalos o elementos publicitarios con el producto o asociado a la venta del mismo.
- La realización de exhibiciones promocionales o degustaciones.
- La realización de publicidad en medios de comunicación u otros soportes.
- La utilización en el envase de imágenes o palabras que correspondan a publicidad.
- La publicación de avisos, carteles o señaléticas que destaquen ofertas como promociones o reducciones en el precio, cupones de descuento, descuento en el precio según la cantidad de productos adquiridos u otras estrategias publicitarias similares.
El profesional que requiera indicar estas fórmulas deberá garantizar que el usuario cuente con la información necesaria para seleccionar adecuadamente la fórmula respectiva, señalando en la prescripción solamente la expresión "Fórmula de inicio" o "Fórmula de continuación", sin indicar marcas comerciales específicas, y la edad del niño o niña que la recibirá.
Párrafo III
De las preparaciones comerciales de alimentos infantiles
Artículo 498.- Decreto 13, SALUD
Art. 1 N° 4
D.O. 03.07.2019Preparaciones comerciales de alimentos infantiles son aquellas utilizadas durante el período de destete y adaptación de los niños a la alimentación sólida. Se preparan para ser administrados directamente, o bien, deshidratados para ser reconstituidos.
Art. 1 N° 4
D.O. 03.07.2019Preparaciones comerciales de alimentos infantiles son aquellas utilizadas durante el período de destete y adaptación de los niños a la alimentación sólida. Se preparan para ser administrados directamente, o bien, deshidratados para ser reconstituidos.
Artículo 499.- Las preparaciones comerciales de alimentos infantiles para administrarse directamente según el tamaño de partículas se clasifican en:
a) colados : aquellas preparaciones de textura fina y homogénea, que contiene partículas pequeñas, de tamaño uniforme y que no requieren ni incitan a la masticación antes de la deglución;
b) picados : aquellas preparaciones de partículas más grandes y textura más gruesa, incluyendo trocitos de alimentos que incitan a la masticación.
Artículo 500.- Los alimentos infantiles deshidratados, una vez reconstituidos serán parecidos en cuanto a consistencia y tamaño de sus partículas a los descritos en a) y b) del artículo anterior.
Artículo 501.- Estos Decreto 13, SALUD
Art. 1 N° 5
D.O. 03.07.2019alimentos infantiles deben contener sustancias inocuas y adecuadas para la alimentación de los lactantes y niños pequeños hasta los 36 meses de edad.
Art. 1 N° 5
D.O. 03.07.2019alimentos infantiles deben contener sustancias inocuas y adecuadas para la alimentación de los lactantes y niños pequeños hasta los 36 meses de edad.
El producto y sus componentes no deberán haber sido tratados con radiaciones ionizantes.
Artículo 502.- Decreto 13, SALUD
Art. 1 N° 6
D.O. 03.07.2019Estos alimentos deberán presentar la siguiente composición:
Art. 1 N° 6
D.O. 03.07.2019Estos alimentos deberán presentar la siguiente composición:
a) Proteínas
El contenido de proteínas de los colados o picados deberá ser el correspondiente a la declaración de ingredientes en su rotulación, según las siguientes condiciones:
a.1) Al menos 7g/100 kcal, cuando la carne, el pollo, el pescado u otra fuente de proteínas de origen animal, individualmente o en combinación, sean los únicos ingredientes mencionados en la denominación del producto. En estos productos, la carne, el pollo, el pescado u otra fuente de proteínas de origen animal deberán constituir en total, como mínimo tanto el 40% del peso total del producto, como el 25% del peso total de las fuentes de proteínas mencionadas.
a.2) Al menos 4g/100 kcal, cuando la carne, el pollo, el pescado u otra fuente de proteínas de origen animal, individualmente o en combinación, sean nombrados en primer lugar en la denominación del producto. En estos productos, la carne, el pollo, el pescado o la otra fuente de proteínas deberán constituir en total, como mínimo tanto el 10% del peso total del producto, como el 25% del peso total de las fuentes de proteínas mencionadas.
a.3) Al menos 3g/100 kcal, cuando la carne, el pollo, el pescado u otra fuente de proteínas de origen animal, individualmente o en combinación, aparecen declarados, aunque no en primer lugar, en la denominación del producto. En estos productos, la carne, el pollo, el pescado o la otra fuente de proteínas de origen animal deberán constituir en total, como mínimo tanto el 8% del peso total del producto, como el 25% del peso total de las fuentes de proteínas mencionadas.
a.4) Al menos 3g/100 kcal, cuando no menciona la carne, el pollo, el pescado u otra fuente de proteínas de origen animal en la denominación del producto.
En los casos en que los productos contengan menos proteínas que 3g/100 kcal, se considerarán bajos en proteínas, y deberá rotular de manera destacada, en la cara frontal del producto, una frase como se indica en la letra c) del artículo 505 de este reglamento.
b) Materia grasa:
No deben utilizarse grasas y aceites parcialmente hidrogenados.
c) Sodio: máximo 200 mg/100 g.
No se permitirá la adición de sal (NaCl) a los productos de postre a base de frutas.
d) Vitaminas y minerales: podrán agregarse vitaminas y minerales hasta los límites máximos establecidos en el artículo 495 del presente reglamento.
e) Fibra dietética total: deberá ser la propia de los alimentos naturales utilizados como ingredientes del producto, y no deberá adicionarse fibra dietética con ingredientes artificiales.
f) Carbohidratos disponibles: No deberán añadirse mono o disacáridos.
Artículo 503.- Decreto 13, SALUD
Art. 1 N° 7
D.O. 03.07.2019Sólo se permitirá el uso de los siguientes aditivos, en la cantidad que se indica por 100 g o 100 ml del producto listo para el consumo:
Art. 1 N° 7
D.O. 03.07.2019Sólo se permitirá el uso de los siguientes aditivos, en la cantidad que se indica por 100 g o 100 ml del producto listo para el consumo:
.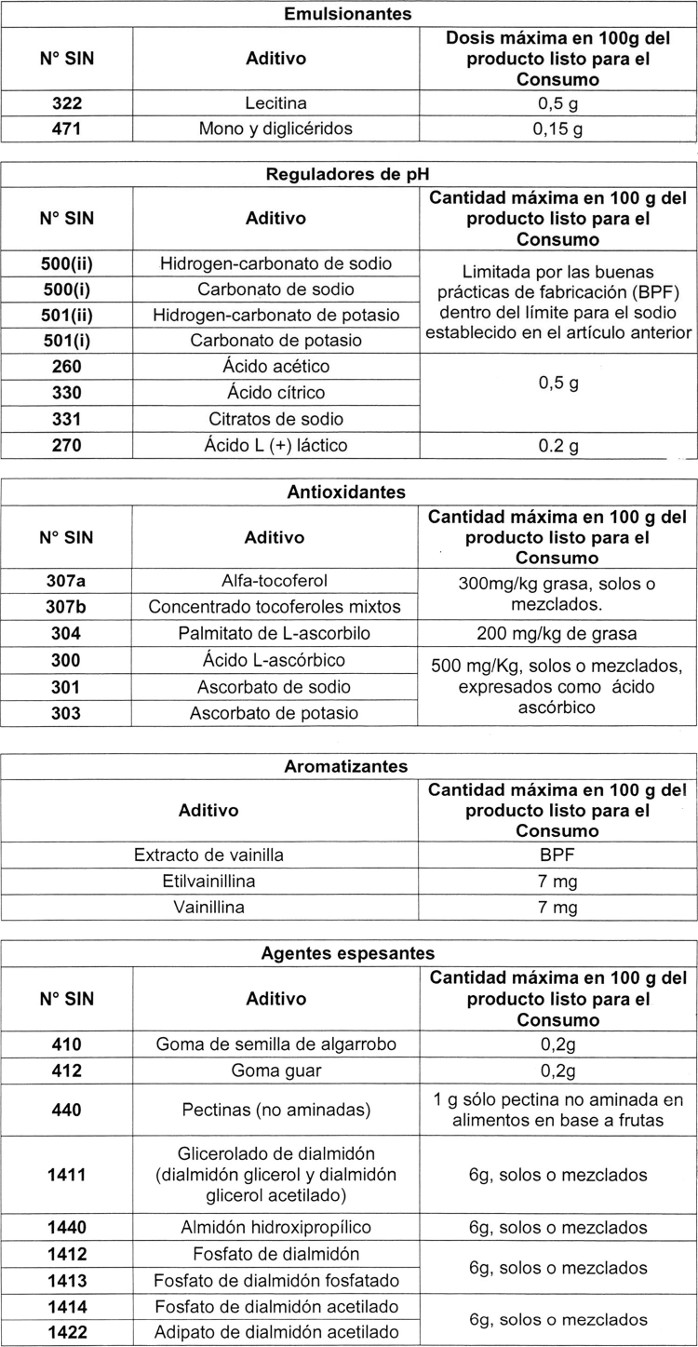 .
.
 .
. Artículo 504.- Decreto 13, SALUD
Art. 1 N° 8
D.O. 03.07.2019El producto deberá prepararse con especial cuidado, mediante buenas prácticas de fabricación, a fin de eliminar totalmente los residuos de los plaguicidas que pueden necesitarse para la producción, el almacenamiento o la elaboración de las materias primas o del ingrediente alimentario acabado o, si ello es técnicamente inevitable, reducirlos en la mayor medida posible.
Art. 1 N° 8
D.O. 03.07.2019El producto deberá prepararse con especial cuidado, mediante buenas prácticas de fabricación, a fin de eliminar totalmente los residuos de los plaguicidas que pueden necesitarse para la producción, el almacenamiento o la elaboración de las materias primas o del ingrediente alimentario acabado o, si ello es técnicamente inevitable, reducirlos en la mayor medida posible.
El producto no deberá contener residuos de hormonas ni de antibióticos determinados mediante métodos convenidos de análisis, y estará prácticamente exento de otros contaminantes y otras sustancias dañinas para la salud, especialmente, de sustancias farmacológicamente activas.
Artículo 505.- Además Decreto 13, SALUD
Art. 1 N° 9
D.O. 03.07.2019de lo dispuesto para etiquetado general y para regímenes especiales, las preparaciones comerciales de alimentos infantiles deberán indicar en su etiqueta lo siguiente:
Art. 1 N° 9
D.O. 03.07.2019de lo dispuesto para etiquetado general y para regímenes especiales, las preparaciones comerciales de alimentos infantiles deberán indicar en su etiqueta lo siguiente:
a) Su denominación de colado o picado, según las definiciones de este reglamento.
b) Se debe indicar la edad a partir de la cual podrá consumirse el producto, teniendo en cuenta su composición, textura y otras propiedades particulares. La edad indicada será, como mínimo, de seis meses para cualquier producto.
c) En los casos en que los productos contengan menos proteínas que 3g/100 kcal deberá indicar claramente y destacado en la cara frontal del envase la siguiente frase: "NO REEMPLAZA UNA COMIDA COMPLETA PARA UN NIÑO".
d) En este tipo de productos, no deberán incorporarse en los rótulos ni publicidad de los mismos, declaraciones de propiedades saludables.
Artículo 505 bis.- Decreto 13, SALUD
Art. 1 N° 10
D.O. 03.07.2019La información y rotulación nutricional de los alimentos comprendidos en este párrafo deberán expresarse por cada 100 g o 100 ml, según corresponda, y por cada porción del producto listo para el consumo. Además, opcionalmente, podrá expresarse por cada 100 kilocalorías (kcal) utilizables del producto
Art. 1 N° 10
D.O. 03.07.2019La información y rotulación nutricional de los alimentos comprendidos en este párrafo deberán expresarse por cada 100 g o 100 ml, según corresponda, y por cada porción del producto listo para el consumo. Además, opcionalmente, podrá expresarse por cada 100 kilocalorías (kcal) utilizables del producto
Párrafo IV
De los alimentos para uso infantil procesados a base de
cereales
Decreto 106, SALUD
Art. 1 Nº 40
D.O. 23.04.2009 Artículo 506.- Los alimentos para uso infantil procesados a base de cereales son aquellos destinados a completar el régimen alimentario normal de niños desde los 6 meses hasta los 36 meses de edad.
Art. 1 Nº 40
D.O. 23.04.2009 Artículo 506.- Los alimentos para uso infantil procesados a base de cereales son aquellos destinados a completar el régimen alimentario normal de niños desde los 6 meses hasta los 36 meses de edad.
Decreto 106, SALUD
Art. 1 Nº 41
D.O. 23.04.2009 Artículo 507.- Los alimentos elaborados a base de cereales están preparados principalmente con uno o más cereales molidos que se procesan para lograr un escaso contenido de humedad y se fragmentan para ser consumidos diluidos con agua, leche u otro líquido conveniente o sin dilución como galletas, bizcochos o pastas y se consumen de acuerdo a las instrucciones que el fabricante debe indicar en el rótulo del producto.
Art. 1 Nº 41
D.O. 23.04.2009 Artículo 507.- Los alimentos elaborados a base de cereales están preparados principalmente con uno o más cereales molidos que se procesan para lograr un escaso contenido de humedad y se fragmentan para ser consumidos diluidos con agua, leche u otro líquido conveniente o sin dilución como galletas, bizcochos o pastas y se consumen de acuerdo a las instrucciones que el fabricante debe indicar en el rótulo del producto.
El contenido de cereales en el producto deberá alcanzar por lo menos el 25 por ciento de la mezcla final en relación con el peso en seco. De acuerdo a su preparación se distinguen las siguientes categorías:
a) Productos que consisten en cereales que se preparan para el consumo añadiendo leche u otros líquidos nutritivos idóneos.
b) Cereales con adición de alimentos de alto valor proteínico, que se preparan para el consumo con agua u otros líquidos apropiados exentos de proteínas.
Decreto 106, SALUD
Art. 1 Nº 42
D.O. 23.04.2009 Artículo 508.- Las categorías descritas en artículo 507 se preparan principalmente con uno o más productos molidos de cereales, como trigo, arroz, cebada, avena, centeno, maíz o sorgo. También podrán contener leguminosas previamente tratadas para eliminar factores antinutricionales (según las buenas prácticas de fabricación), raíces amiláceas como arroz o mandioca, tallos amiláceos y semillas oleaginosas en menor proporción.
Art. 1 Nº 42
D.O. 23.04.2009 Artículo 508.- Las categorías descritas en artículo 507 se preparan principalmente con uno o más productos molidos de cereales, como trigo, arroz, cebada, avena, centeno, maíz o sorgo. También podrán contener leguminosas previamente tratadas para eliminar factores antinutricionales (según las buenas prácticas de fabricación), raíces amiláceas como arroz o mandioca, tallos amiláceos y semillas oleaginosas en menor proporción.
Decreto 106, SALUD
Art. 1 Nº 43
D.O. 23.04.2009 Artículo 509.- Los requisitos relativos al contenido energético y de nutrientes se refieren al producto listo para el consumo tal como se vende, o preparado de conformidad con las instrucciones del fabricante, a menos que se especifique otra cosa y deberán ajustarse a lo siguiente:
Art. 1 Nº 43
D.O. 23.04.2009 Artículo 509.- Los requisitos relativos al contenido energético y de nutrientes se refieren al producto listo para el consumo tal como se vende, o preparado de conformidad con las instrucciones del fabricante, a menos que se especifique otra cosa y deberán ajustarse a lo siguiente:
Contenido energético
El contenido energético de los alimentos elaborados a base de cereales no deberá ser inferior a 0,8 kcal/g.
Proteínas
En aquellos que se consumen de acuerdo a lo descrito en el punto b) del art. 507, el índice químico de la proteína añadida deberá ser equivalente por lo menos al 80 por ciento de la calidad de la caseína. El contenido de proteína no deberá ser inferior a 2 g/100 kcal ni superior a 5,5 g/100 kcal.
Se permite la adición de aminoácidos sólo con el fin de mejorar el valor nutricional de la mezcla proteínica y en las proporciones necesarias para tal fin. Podrán emplearse únicamente formas naturales de L-aminoácidos.
Lípidos
Para los productos mencionados en punto b) del artículo 507, el contenido de lípidos no deberá ser superior a 4,5 g/100 kcal. Sin embargo, si el contenido de lípidos es superior a 3,3 g/100 kcal:
- la cantidad de ácido linoleico (en forma de triglicéridos = linoleatos) no deberá ser inferior a 300 mg/100 kcal. ni superior a 1200 mg/100 kcal.
- la cantidad de ácido láurico no deberá exceder del 15% del contenido lipídico total;
- la cantidad de ácido mirístico no deberá exceder del 15% del contenido lipídico total.
Las categorías de productos a que se refiere la letra a) del artículo 507 no deberán exceder de un contenido máximo de lípidos de 3,3 g/100 kcal.
Hidratos de Carbono
Si a los productos mencionados en el punto a) artículo 507 se añade sacarosa, fructosa, glucosa, jarabe de glucosa o miel:
- la cantidad de carbohidratos añadidos procedentes de estas fuentes no deberá ser superior a 7,5 g/100 kcal
- la cantidad de fructosa añadida no deberá ser superior a 3,75 g/100 kcal.
Si a los productos mencionados en el punto b) del artículo 507 se añade sacarosa, fructosa, glucosa, jarabe de glucosa o miel:
- la cantidad de carbohidratos añadidos procedentes de estas fuentes no deberá ser superior a 5 g/100 kcal.
- la cantidad de fructosa añadida no deberá ser superior a 2,5 g/100 kcal.
Minerales
- El contenido de calcio de los productos mencionados en el punto b) del artículo 507 no deberá ser inferior a 80 mg/100 kcal.
- El contenido de sodio de los productos descritos en el artículo 507 podrá ser como máximo de 100 mg/100 Kcal del producto listo para el consumo.
Vitaminas
La cantidad de vitamina B1 (tiamina) no deberá ser inferior a 50 mcg/100 kcal.
En lo que respecta a los productos mencionados en punto b) del artículo 507 la cantidad de vitamina A y de vitamina D deberá mantenerse dentro de los límites siguientes:
Vitamina
mcg/100 kcl
Vitamina A (en mcg de 60 - 180
retinol equivalente)
Vitamina D 1 - 3
Los productos señalados en el punto a) del artículo 507 a los que se adicione vitamina A o vitamina D deberán cumplir con los límites de esas vitaminas descritos para los productos mencionados en la letra f) del artículo 496.
Las vitaminas y minerales no mencionados en el presente artículo podrán ser agregadas de acuerdo a los límites establecidos en el artículo 496 del presente reglamento.
Humedad
El contenido de humedad de los productos deberá ser conforme a las buenas prácticas de fabricación para cada una de las categorías de productos, y su cuantía deberá ser tal que se reduzca al mínimo la pérdida de valor nutritivo y no pueda haber multiplicación de microorganismos.
Decreto 106, SALUD
Art. 1 Nº 44
D.O. 23.04.2009 Artículo 510.- Tanto el producto como sus componentes no deberán haberse tratado con radiaciones ionizantes.
Art. 1 Nº 44
D.O. 23.04.2009 Artículo 510.- Tanto el producto como sus componentes no deberán haberse tratado con radiaciones ionizantes.
Queda prohibido el uso de grasas hidrogenadas y parcialmente hidrogenadas en estos productos.
El contenido máximo de fibra dietaria total será de 2g/100g de producto listo para el consumo conforme a las instrucciones sugeridas por el fabricante.
Decreto 106, SALUD
Art. 1 Nº 45
D.O. 23.04.2009 Artículo 511.- Todos los ingredientes, incluso los facultativos, deberán estar limpios y ser inocuos, apropiados y de buena calidad.
Art. 1 Nº 45
D.O. 23.04.2009 Artículo 511.- Todos los ingredientes, incluso los facultativos, deberán estar limpios y ser inocuos, apropiados y de buena calidad.
Todos los procedimientos de elaboración y desecación deberán llevarse a cabo de forma que sean mínimas las pérdidas del valor nutritivo, especialmente en la calidad de sus proteínas.
Los productos que contengan miel o jarabe de arce deberán tratarse de manera que se destruyan las esporas de Clostridium botulinum, si las hubiere.
Sólo podrán utilizarse cultivos productores de ácido láctico.
Decreto 106, SALUD
Art. 1 Nº 46
D.O. 23.04.2009 Artículo 512.- Sólo se permitirá el uso de los siguientes aditivos y en las cantidades indicadas por cada 100 g de producto listo para el consumo, preparado conforme a las instrucciones del fabricante, salvo indicación contraria de su médico.
Art. 1 Nº 46
D.O. 23.04.2009 Artículo 512.- Sólo se permitirá el uso de los siguientes aditivos y en las cantidades indicadas por cada 100 g de producto listo para el consumo, preparado conforme a las instrucciones del fabricante, salvo indicación contraria de su médico.
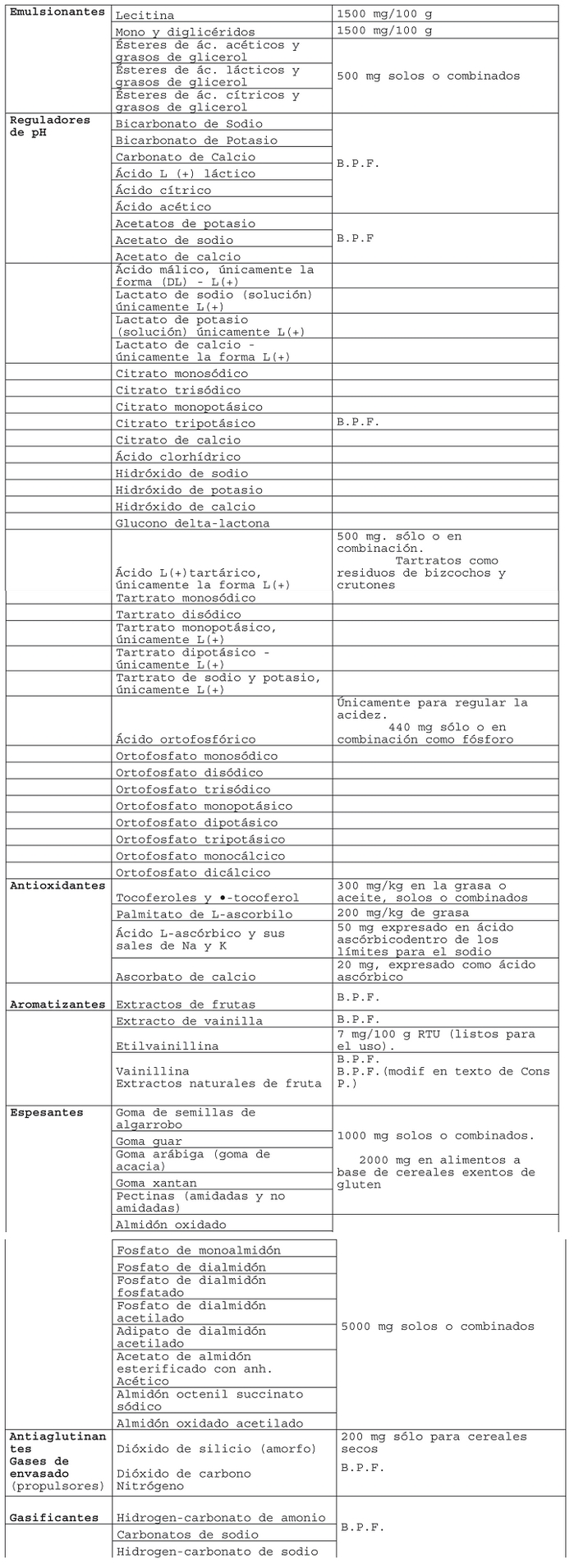
Decreto 106, SALUD
Art. 1 Nº 47
D.O. 23.04.2009 Artículo 513.- Además de lo dispuesto para etiquetado general y para regímenes especiales en el artículo 491 en la etiqueta de estos alimentos se indicará lo siguiente:
Art. 1 Nº 47
D.O. 23.04.2009 Artículo 513.- Además de lo dispuesto para etiquetado general y para regímenes especiales en el artículo 491 en la etiqueta de estos alimentos se indicará lo siguiente:
- la frase "para niños mayores de seis meses";
- Instrucciones sobre su preparación y uso, así como de su almacenamiento y conservación;
- Cuando el producto no haya sido fabricado para ser preparado acorde a lo descrito en el punto b) del artículo 507, deberá indicar el uso de leche para diluirlo o mezclarlo.
- Si el producto contiene cacao se indicará "Para niños mayores de 12 meses de edad".
Los productos contenidos en este párrafo no son sustitutos de la leche materna y no deberán presentarse como tales ni podrán declarar propiedades saludables.
Artículo 514.- Un alimentoDecreto 24, SALUD
Art. 1 Nº 10
D.O. 24.11.2011 de uso médico o medicinal es una categoría de alimentos para regímenes especiales, formulados, elaborados y presentados especialmente para el tratamiento dietético exclusivo o parcial de pacientes, y que deberán utilizarse bajo la supervisión de un profesional de la salud.
Art. 1 Nº 10
D.O. 24.11.2011 de uso médico o medicinal es una categoría de alimentos para regímenes especiales, formulados, elaborados y presentados especialmente para el tratamiento dietético exclusivo o parcial de pacientes, y que deberán utilizarse bajo la supervisión de un profesional de la salud.
Estos alimentos deberán rotular:
- que el producto debe utilizarse bajo supervisión médica o de un profesional de la salud,
- si el producto es o no adecuado para ser consumido como única fuente de alimento,
- si el producto va destinado a un grupo de edad específico, y
- si el producto puede perjudicar la salud de las personas que lo consuman sin estar afectados por alguna de las enfermedades, trastornos o afecciones, para los que vaya destinado.
Artículo 515.- Estos alimentos Decreto 24, SALUD
Art. 1 Nº 10
D.O. 24.11.2011se clasificarán de acuerdo a las instrucciones del fabricante en:
Art. 1 Nº 10
D.O. 24.11.2011se clasificarán de acuerdo a las instrucciones del fabricante en:
a) Alimentos completos con una formulación de nutrientes específica adaptada para determinadas enfermedades, trastornos o situaciones fisiológicas. Pueden constituir la única fuente de alimentos para las personas a las que van destinados. Estos alimentos también pueden utilizarse como sustitutos de una parte del régimen alimentario.
b) Alimentos incompletos con una formulación de nutrientes específica adaptada para determinadas enfermedades, trastornos o afecciones. No son adecuados como única fuente de alimentos, por lo que sólo pueden utilizarse como sustitutos de una parte del régimen alimentario.
Esta información deberá quedar, claramente, indicada en el rótulo para contribuir al uso adecuado del producto.
Párrafo VI
De los alimentos para regímenes exentos de gluten
Decreto 106, SALUD
Art. 1 Nº 48
D.O. 23.04.2009 Artículo 516.- Un alimento libre de gluten es aquel que está preparado únicamente con ingredientes que por su origen natural y por la aplicación de buenas prácticas de fabricación - que impidan la contaminación cruzada - no contiene prolaminas procedentes de trigo, de todas las especies de triticum como la escaña común (Triticum spelta L.), el kamut (Triticum polonicum L.), trigo duro, centeno, cebada, ni sus variedades cruzadas, así como también de la avena.
Art. 1 Nº 48
D.O. 23.04.2009 Artículo 516.- Un alimento libre de gluten es aquel que está preparado únicamente con ingredientes que por su origen natural y por la aplicación de buenas prácticas de fabricación - que impidan la contaminación cruzada - no contiene prolaminas procedentes de trigo, de todas las especies de triticum como la escaña común (Triticum spelta L.), el kamut (Triticum polonicum L.), trigo duro, centeno, cebada, ni sus variedades cruzadas, así como también de la avena.
Para efectos de la inclusión en el rótulo de la leyenda "Libre de Gluten", los elaboradores de alimentos libres de gluten deberán cumplir con las exigencias establecidas en el presente Reglamento, así como contar con un programa de buenas prácticas de fabricación, con el fin de asegurar la no contaminación con los derivados de trigo, centeno, cebada y avena en los procesos, desde la recepción de las materias primas hasta la comercialización del producto final.
Decreto 106, SALUD
Art. 1 Nº 49
D.O. 23.04.2009 Artículo 517.- Las harinas libres de gluten destinadas a la panificación, así como el pan libre de gluten, deberán contener las vitaminas y minerales establecidas en el artículo 350 de este Reglamento. Todos los alimentos libres de gluten deberán etiquetarse nutricionalmente de acuerdo a lo establecido en el etiquetado general y en el artículo correspondiente de este Reglamento.
Art. 1 Nº 49
D.O. 23.04.2009 Artículo 517.- Las harinas libres de gluten destinadas a la panificación, así como el pan libre de gluten, deberán contener las vitaminas y minerales establecidas en el artículo 350 de este Reglamento. Todos los alimentos libres de gluten deberán etiquetarse nutricionalmente de acuerdo a lo establecido en el etiquetado general y en el artículo correspondiente de este Reglamento.
Artículo 518.- El Decreto 10, SALUD
Art. 1 N° 1
D.O. 24.07.2018término "Libre de gluten" y el logo o símbolo de la espiga tachada, sólo podrán utilizarse cuando el resultado del análisis de laboratorio del producto alimenticio no sobrepase los 5 miligramos de gluten, de los cereales establecidos en el artículo 516, por kilogramo del producto listo para su entrega al consumidor final, de acuerdo a las técnicas analíticas que, para estos efectos, determine el Instituto de Salud Pública de Chile. La expresión "Libre de gluten" se rotulará en las proximidades del nombre del producto, con caracteres de buen realce, tamaño y visibilidad.
Art. 1 N° 1
D.O. 24.07.2018término "Libre de gluten" y el logo o símbolo de la espiga tachada, sólo podrán utilizarse cuando el resultado del análisis de laboratorio del producto alimenticio no sobrepase los 5 miligramos de gluten, de los cereales establecidos en el artículo 516, por kilogramo del producto listo para su entrega al consumidor final, de acuerdo a las técnicas analíticas que, para estos efectos, determine el Instituto de Salud Pública de Chile. La expresión "Libre de gluten" se rotulará en las proximidades del nombre del producto, con caracteres de buen realce, tamaño y visibilidad.
Párrafo VII
De los alimentos para regímenes de control de peso
Artículo 519.- Se entiende por alimentos paraDTO 475, SALUD
Art. Unico, N° 151
D.O. 13.01.2000 regímenes de control de peso, aquellos que según las instrucciones correspondientes sustituyen la totalidad de la dieta o una parte de la misma.
Art. Unico, N° 151
D.O. 13.01.2000 regímenes de control de peso, aquellos que según las instrucciones correspondientes sustituyen la totalidad de la dieta o una parte de la misma.
En el rótulo junto al nombre principal del alimento,DTO 115, SALUD
Art. primero Nº 25
D.O. 25.11.2003 formando parte del mismo o junto a la información nutricional deberá señalarse, con caracteres fáciles de leer en circunstancias normales de compra y uso la frase "alimento para control de peso".
Art. primero Nº 25
D.O. 25.11.2003 formando parte del mismo o junto a la información nutricional deberá señalarse, con caracteres fáciles de leer en circunstancias normales de compra y uso la frase "alimento para control de peso".
NOTA:
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
El artículo transitorio del DTO 115, Salud, publicado el 25.11.2003, dispone que la modificaciones a este artículo, regirán 180 días después de su publicación.
Artículo 520.- Un producto que se presente comoDTO 475, SALUD
Art. Unico, N° 1
D.O. 13.01.2000 sustituto de todas las comidas de la dieta diaria deberá aportar como mínimo 800 kcal. y como máximo 1.200 kcal.
Art. Unico, N° 1
D.O. 13.01.2000 sustituto de todas las comidas de la dieta diaria deberá aportar como mínimo 800 kcal. y como máximo 1.200 kcal.
Cuando el producto total se presente dividido en porciones, 3 o 4 diarias, según los hábitos alimenticios de la persona, estas porciones deberán suministrar aproximadamente una tercera o una cuarta parte del aporte energético total del producto, respectivamente.
Artículo 521.- Si el producto se presenta comoDTO 475, SALUD
Art. Unico, N° 1
D.O. 13.01.2000 sustituto de una o más comidas de la dieta diaria deberá aportar como mínimo 200 kcal y como máximo 400 kcal. por comida, esto referido al producto tal como se comercialDecreto 24, SALUD
Art. 1 Nº 11
D.O. 24.11.2011iza.
Art. Unico, N° 1
D.O. 13.01.2000 sustituto de una o más comidas de la dieta diaria deberá aportar como mínimo 200 kcal y como máximo 400 kcal. por comida, esto referido al producto tal como se comercialDecreto 24, SALUD
Art. 1 Nº 11
D.O. 24.11.2011iza.
Artículo 522.- Los sustitutos de comidas para regímenes de control de peso se prepararán con elementos constituyentes de proteínas de origen animal y vegetal que se hayan demostrado aptos para el consumo humano, y con otros ingredientes apropiados para obtener la composición esencial del producto.
Artículo 523.- El contenido de proteínas de estos productos será de un 25% como mínimo y un 50% como máximo de la energía disponible del alimento listo para su consumo.
La ingesta total diaria de proteínas no será superior a 125 g. La calidad biológica de las proteínas no será menor a un 80% de las proteínas del huevo o de la leche. Para mejorar la calidad de las proteínas podrán añadirse aminoácidos esenciales pero sólo en las cantidades necesarias para tal efecto. Los aminoácidos utilizados deberán presentarse en su forma levógira, pero se podrá utilizar DL-metionina.
Artículo 524.- Estos Decreto 24, SALUD
Art. 1 Nº 12
D.O. 24.11.2011alimentos deberán cumplir con el descriptor bajo en grasa y no deberán aportar, en forma de grasa total, más del 30% de la energía disponible en el alimento. No menos del 3% de la energía disponible deberá ser aportada como ácido linoleico.
Art. 1 Nº 12
D.O. 24.11.2011alimentos deberán cumplir con el descriptor bajo en grasa y no deberán aportar, en forma de grasa total, más del 30% de la energía disponible en el alimento. No menos del 3% de la energía disponible deberá ser aportada como ácido linoleico.
Artículo 525.- Cuando unDecreto 24, SALUD
Art. 1 Nº 13
D.O. 24.11.2011 alimento se presente como sustitutivo de todas las comidas de un día, deberá contener, al menos, el 100% de las cantidades de vitaminas y minerales especificadas a continuación, en el producto tal como se comercializa:
Art. 1 Nº 13
D.O. 24.11.2011 alimento se presente como sustitutivo de todas las comidas de un día, deberá contener, al menos, el 100% de las cantidades de vitaminas y minerales especificadas a continuación, en el producto tal como se comercializa:
Vitamina A 600 mcg EAR
Vitamina D 2,5 mcg D 3
Vitamina E 10 mg ET
Vitamina C 60 mg
Tiamina 0,8 mg
Riboflavina 1,2 mg
Niacina 11 mg
Vitamina B 6 2 mg
Vitamina B 12 1 mcg
Folato 200 mcg EFA
Calcio 500 mg
Fósforo 500 mg
Hierro 14 mg
Yodo 140 mcg
Magnesio 300 mg
Cobre 1,5 mg
Zinc 6 mg
Potasio 1,6 g
Sodio 0,6 g
Estos alimentos que se presenten como sustitutivo de todas las comidas de un día deberán contener un mínimo de 13 g de fibra dietética total. Las cantidades por cada tiempo de comida, deberán ajustarse a una cantidad que corresponda al 33% o 25% del total señalado, según si el número de porciones recomendadas por día es de 3 o 4, respectivamente, lo que corresponde a 4,3 g o 3,3 g de fibra dietética/porción, según si son 3 o 4 porciones por día.
Se podrán incluir otros nutrientes esenciales no especificados en esta lista para los que exista Dosis Diaria Remendada o Valores de Referencia Diaria, la sumatoria o concentración final de ellos en el producto, no deberá ser superior al 100% de la Dosis Diaria de Referencia establecida para el nutriente en particular.
Decreto 106, SALUD
Art. 1 Nº 51
D.O. 23.04.2009 Artículo 526.- Cuando un producto se presente como sustituto de una sola comida de la dieta diaria, es decir como reemplazo de una de las principales comidas del día, desayuno, almuerzo, once o cena, las cantidades de vitaminas y minerales deberán ajustarse a una cifra que corresponda al 33% ó 25% del total señalado en el artículo anterior, según si el número de porciones recomendadas por día es de 3 o 4, respectivamente.
Art. 1 Nº 51
D.O. 23.04.2009 Artículo 526.- Cuando un producto se presente como sustituto de una sola comida de la dieta diaria, es decir como reemplazo de una de las principales comidas del día, desayuno, almuerzo, once o cena, las cantidades de vitaminas y minerales deberán ajustarse a una cifra que corresponda al 33% ó 25% del total señalado en el artículo anterior, según si el número de porciones recomendadas por día es de 3 o 4, respectivamente.
Artículo 527.- Estos productos se etiquetaránDTO 475, SALUD
Art. Unico, N° 154
D.O. 13.01.2000 conforme las disposiciones relativas a etiquetado general y según lo dispuesto en el artículo 491. Si en las instrucciones para el uso se indica que el producto debe combinarse con otros ingredientes, en la etiqueta deberá agregarse la declaración del valor nutritivo por porción de consumo habitual del resultado final de la combinación.
Art. Unico, N° 154
D.O. 13.01.2000 conforme las disposiciones relativas a etiquetado general y según lo dispuesto en el artículo 491. Si en las instrucciones para el uso se indica que el producto debe combinarse con otros ingredientes, en la etiqueta deberá agregarse la declaración del valor nutritivo por porción de consumo habitual del resultado final de la combinación.
En lo particular, en la etiqueta o etiquetado no se deberá hacer referencia al ritmo ni a la magnitud de la pérdida de peso resultante del consumo del alimento, como tampoco a la disminución de la sensación de hambre ni al aumento de la sensación de saciedad.
Artículo 528.- En la etiqueta o en el etiquetado deberá hacerse referencia a la necesidad de mantener una ingesta adecuada de líquido cuando se utilizan preparados para el control de peso. Si el consumo de alimentos proporciona una ingestaDTO 475, SALUD
Art. Unico, N° 155
D.O. 13.01.2000 diaria de alcoholes de azúcar superior a los 20 g diarios, la etiqueta deberá llevar una declaración de que el alimento podría tener un efecto laxante. La etiqueta deberá llevar una declaración de que el alimento puede ser útil para el control de peso únicamente como parte de una dieta con un contenido energético controlado. La etiqueta de los productos que se presentan como sustitutos de la dieta total para utilizar durante más de seis semanas, deberá contener una recomendación de que transcurrido ese período deberá solicitarse asesoría médica.
Art. Unico, N° 155
D.O. 13.01.2000 diaria de alcoholes de azúcar superior a los 20 g diarios, la etiqueta deberá llevar una declaración de que el alimento podría tener un efecto laxante. La etiqueta deberá llevar una declaración de que el alimento puede ser útil para el control de peso únicamente como parte de una dieta con un contenido energético controlado. La etiqueta de los productos que se presentan como sustitutos de la dieta total para utilizar durante más de seis semanas, deberá contener una recomendación de que transcurrido ese período deberá solicitarse asesoría médica.
Decreto 24, SALUD
Art. 1 Nº 14
D.O. 24.11.2011 Párrafo VIII De los alimentos con bajo contenido de grasas y/o calorías.- DEROGADO
Art. 1 Nº 14
D.O. 24.11.2011 Párrafo VIII De los alimentos con bajo contenido de grasas y/o calorías.- DEROGADO
TÍTULO XXIX
DE LOS SUPLEMENTOS ALIMENTARIOS Y DE LOS ALIMENTOS
DTO 253, SALUD
Nº 1 A) y B)
D.O. 20.01.2003PARA DEPORTISTAS
Nº 1 A) y B)
D.O. 20.01.2003PARA DEPORTISTAS
Párrafo I
De los Suplementos Alimentarios
DTO 253, SALUD
Nº 1 A) y B)
D.O. 20.01.2003
Nº 1 A) y B)
D.O. 20.01.2003
Artículo 534.- Suplementos alimentarios son aquellos productos elaborados o preparados especialmente para suplementar la dieta con fines saludables y contribuir a mantener o proteger estados fisiológicos característicos tales como adolescencia, adultez o vejez.
Su composición podrá corresponder a un nutriente, mezcla de nutrientes y otros componentes presentes naturalmente en los alimentos, incluyendo compuestos tales como vitaminas, minerales, aminoácidos, lípidos, fibra dietética o sus fracciones.
Se podrán expender en diferentes formas de liberación convencional, tales como polvos, líquidos, granulados, grageas, comprimidos, tabletas, cápsulas u otras propias de los medicamentos.
NOTA:
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la presente modificación entrará en vigencia 30 días después de su publicación en el Diario Oficial.
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la presente modificación entrará en vigencia 30 días después de su publicación en el Diario Oficial.
Artículo 535.- Los ingredientes dietarios paraDTO 287, SALUD
Art. 2º
D.O. 18.02.2002 suplementos alimentarios, que son las substancias utilizadas intencionalmente para suplementar la dieta humana, incrementando la ingesta diaria total de vitaminas, minerales, aminoácidos, lípidos, fibra dietética u otros elementos naturalmente presentes en los alimentos, deberán cumplir con la identidad y pureza indicada en las especificaciones de calidad e inocuidad.
Art. 2º
D.O. 18.02.2002 suplementos alimentarios, que son las substancias utilizadas intencionalmente para suplementar la dieta humana, incrementando la ingesta diaria total de vitaminas, minerales, aminoácidos, lípidos, fibra dietética u otros elementos naturalmente presentes en los alimentos, deberán cumplir con la identidad y pureza indicada en las especificaciones de calidad e inocuidad.
Artículo 536.- La declaración de propiedadesDTO 287, SALUD
Art. 2º
D.O. 18.02.2002 saludables y nutricionales, y la información nutricional complementaria que se describa en los envases de estos productos, deberá ceñirse a las normas establecidas para estos fines en este reglamento, siendo prohibidoDTO 57, SALUD
Art. único Nº 13
D.O. 06.05.2005 promocionar su consumo para fines de diagnóstico, prevención o tratamiento de las enfermedades.
Art. 2º
D.O. 18.02.2002 saludables y nutricionales, y la información nutricional complementaria que se describa en los envases de estos productos, deberá ceñirse a las normas establecidas para estos fines en este reglamento, siendo prohibidoDTO 57, SALUD
Art. único Nº 13
D.O. 06.05.2005 promocionar su consumo para fines de diagnóstico, prevención o tratamiento de las enfermedades.
NOTA:
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
Artículo 537.- La publicidad, a través de cualquierDTO 287, SALUD
Art. 2º
D.O. 18.02.2002 medio, así como la rotulación de los suplementos alimentarios, deberá adecuarse a las normas que sobre el particular se contemplan en este reglamento;
Art. 2º
D.O. 18.02.2002 medio, así como la rotulación de los suplementos alimentarios, deberá adecuarse a las normas que sobre el particular se contemplan en este reglamento;
adicionalmente, estos productos deberán señalar en su etiquetado, en forma destacada en la cara principal del envase y a continuación del nombre del producto, su clasificación de "suplemento alimentario".
Todos los suplementos alimentarios deberán incluir, inmediatamente por debajo de la rotulación como "Suplemento Alimentario", una leyenda que señale: "Su uso no es recomendable para consumo por menores de 8 años, embarazadas y nodrizas, salvo indicación profesional competente y no reemplaza a una alimentación balanceada".
Artículo 538.- Los niveles, máximo y mínimo, deDTO 287, SALUD
Art. 2º
D.O. 18.02.2002 vitaminas, minerales y demás componentes a que alude el artículo 534, serán establecidos por resolución del Ministerio de Salud, dictada en uso de sus atribuciones legales técnico normativas.
Art. 2º
D.O. 18.02.2002 vitaminas, minerales y demás componentes a que alude el artículo 534, serán establecidos por resolución del Ministerio de Salud, dictada en uso de sus atribuciones legales técnico normativas.
Párrafo II,
DTO 253, SALUD
Nº 1 D)
D.O. 20.01.2003 De los Alimentos para Deportistas
Nº 1 D)
D.O. 20.01.2003 De los Alimentos para Deportistas
Artículo 539.- Alimentos para deportistas son aquellos productos alimentarios formulados para satisfacer requerimientos de individuos sanos, en especial de aquellos que realicen ejercicios físicos pesados y prolongados.
Estos alimentos estarán compuestos por un ingrediente alimentario o mezcla de éstos. Se les podrá adicionar uno o más nutrientes, como hidratos de carbono, proteínas, vitaminas, minerales y otros componentes presentes naturalmente en los alimentos, tales como cafeína o aquellos expresamente autorizados en el presente Reglamento. En su elaboración se deberán cumplir las normas de las buenas prácticas de manufactura.
En ellos no se podrá incorporar, solos ni en asociación, hormonas o compuestos con efecto anabolizante. Tampoco se les podrá incorporar sustancias con acción estimulante sobre el sistema nervioso, salvo aquellas que estén expresamente autorizadas y dentro de los límites permitidos para este tipo de alimentos en este Reglamento.
NOTA:
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la presente modificación entrará en vigencia 30 días después de su publicación en el Diario Oficial.
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la presente modificación entrará en vigencia 30 días después de su publicación en el Diario Oficial.
Artículo 540.- Sólo podrán considerarse alimentos para deportistas aquellos que cumplan con los requisitos de alguna de las propiedades nutricionales que se indican a continuación. Ellos deberán colocar en la DTO 253, SALUD
Nº 1 D)
D.O. 20.01.2003etiqueta, en el panel principal del envase, con letras fácilmente legibles en color contrastante con el fondo de la etiqueta: "ALIMENTO PARA DEPORTISTAS ......." con el descriptor que se indica entre comillas, según corresponda:
Nº 1 D)
D.O. 20.01.2003etiqueta, en el panel principal del envase, con letras fácilmente legibles en color contrastante con el fondo de la etiqueta: "ALIMENTO PARA DEPORTISTAS ......." con el descriptor que se indica entre comillas, según corresponda:
a) "Alto en energía". Aquellos alimentos que tienen por porción de consumo habitual un 30%, o más, de la dosis diaria de referencia (DDR) de energía (DDR = 20Decreto 24, SALUD
Art. 1 Nº 15
D.O. 24.11.201100 Kcal/día).
Art. 1 Nº 15
D.O. 24.11.201100 Kcal/día).
b) "Buena fuente de energía". Alimentos que tienen por porción de consumo habitual entre un 20% y un 29% de la dosis diaria de referencia de energía.
c) "Alto en hidratos de carbono disponibles".
Alimentos que tienen por porción de consumo habitual un 30%, o más, de la dosis diaria de referencia de carbohidratos disponibles (DDR = 350 g de carbohidratos disponibles/día).
d) "Buena fuente de hidratos de carbono disponibles".
Alimentos que tienen por porción de consumo habitual entre un 20% y un 29% de la dosis diaria de referencia de carbohidratos disponibles.
e) "Alto en proteínas". Alimentos que tienen por porción de consumo habitual de referencia un 40%, o más, de la dosis diaria de referencia de proteínas equivalente a una óptima calidad y digestibilidad (DDR = 50 g de proteínas).
f) "Buena fuente de proteínas". Alimentos que tienen por porción de consumo habitual entre un 20% y un 39% de la DDR de proteínas equivalente a una óptima calidad y digestibilidad.
g) "Con adición de aminoácidos". A estos alimentos se les podrá adicionar los aminoácidos que a continuación se indican, hasta las cantidades máximas por día que se señalan. En la recomendación de consumo de la etiqueta no se podrá sobrepasar las cantidades máximas por día que se indican en cada caso.
Aminoácido Cantidad máxima por día
mg
Alanina 4800
Arginina 4400
Acido aspártico 2400
Cisteína 1800
Glutamina 5600
Acido glutámico 6400
Glicina 6000
Histidina 1700
Isoleucina 1400
Leucina 1900
Lisina 1700
Metionina 720
Ornitina 1400
Fenilalanina 1900
Prolina 4400
Serina 5600
Taurina 1500
Treonina 1000
Tirosina 1600
Triptofano 100
Valina 1400
Los alimentos que tengan fenilalanina deberán incluir en la etiqueta el siguiente mensaje:
"Fenilcetonúricos: contiene fenilalanina". Los alimentos cuyo contenido de taurina sea igual o superior a 500 mg por porción de consumo deberán incluir en la etiqueta el siguiente mensaje: "No recomendable para diabéticos".
h) "Con adición de electrolitos". Los aliDTO 68, SALUD
Art. primero Nº 34
D.O. 23.01.2006mentos que se presentan como bebidas no alcohólicas o preparaciones a reconstituir podrán contener electrolitos como sodio y/o potasio. El contenido de sodio deberá ser igual o mayor a 10 mmol/l (230 mg Na+/l), el contenido de potasio deberá ser igual o mayor a 2 mmol/l (78 mg K+/l). Estas bebidas podrán ser isotónicas o hipotónicas y deberán ser formuladas para tener una osmolalidad mínima de 200 mosm/kg de agua y máxima de 340 mosm/kg de agua. Las bebidas que presenten una osmolalidad entre 200 y 250 mosm/kg de agua podrán denominarse: "hipotónicas" y aquellas que presenten una osmolalidad entre 250 y 340 mosm/kg de agua, podrán denominarse: "isotónicas".
Art. primero Nº 34
D.O. 23.01.2006mentos que se presentan como bebidas no alcohólicas o preparaciones a reconstituir podrán contener electrolitos como sodio y/o potasio. El contenido de sodio deberá ser igual o mayor a 10 mmol/l (230 mg Na+/l), el contenido de potasio deberá ser igual o mayor a 2 mmol/l (78 mg K+/l). Estas bebidas podrán ser isotónicas o hipotónicas y deberán ser formuladas para tener una osmolalidad mínima de 200 mosm/kg de agua y máxima de 340 mosm/kg de agua. Las bebidas que presenten una osmolalidad entre 200 y 250 mosm/kg de agua podrán denominarse: "hipotónicas" y aquellas que presenten una osmolalidad entre 250 y 340 mosm/kg de agua, podrán denominarse: "isotónicas".
La recomendación de consumo de los "Alimentos para Deportistas" que se rotule, adjunte o relacione con el producto no podrá sobrepasar, por día, las cantidades de sodio y potasio, que se indican a continuación:
Electrolito Cantidad máxima por día
mmol mg
Sodio 70 1610
Potasio 95 3715
i) "Con adición de vitaminas y/o minerales". Si se adicionan vitaminas y/o minerales, estos productos alimenticios deberán clasificarse según corresponda como "Alimento Fortificado" o "Suplemento Alimentario", respetando los límites establecidos para cada nutriente en cada categoría.
Cuando un "Alimento para Deportistas" califique además como "Suplemento Alimentario" deberá dar cumplimiento a los artículos correspondientes de este Reglamento, especialmente, pero no sólo, a lo establecido en el Párrafo I del Título XXIX.
j) Con cafeína. La cafeína podrá ser incorporada en forma pura o por adición de uno o más ingredientes alimentarios que la contengan. De los cuales sólo se podrán utilizar los siguientes ingredientes:
café (Coffea spp.), té verde o té negro (Camellia sinensis o Thea sinensis), cacao (Theobroma cacao), yerba mate (Ilex brasillensis e Ilex paraguariensis), nuez de cola (Kola spp.) y guaraná (Paullinia cupana), como tales o en forma de extractos. La recomendación de consumo en la etiqueta y/o publicidad no podrá sobrepasar los 500 mg. de cafeína por día.
k) Con adición de otros compuestos. A los alimentos para deportistas se les podrá incorporar los ingredientes alimentarios que a continuación se indican pudiendo contener las cantidades máximas por porción de consumo habitual que se establecen.
La recomendación de consumo que se rotule, adjunte o relacione con el producto no podrá sobrepasar, por día, las cantidades máximas que se indican en cada caso. En estos alimentos se deberá usar el descritpor: "Con ................", indicando el nombre del ingrediente, según corresponda, así por ejemplo si tiene adición de L-carnitina y colina, se deberá utilizar el descriptor: "Con L-carnitina y colina"
Ingrediente alimentario Cantidad máxima
por día
L - carnitina 2 g
Inosina 10 mg
Ubiquinona 15 mg
Creatina 5 g
Delta-gluconolactona o 600 mg
Glucono-delta-lactona
l) Con hierbas: Se podrá incorporar como ingredientes alimentarios las hierbas, y/o extractos de las hierbas que a continuación se indican, en las cantidades máximas por porción de consumo habitual que se establecen. La recomendación de consumo de los "Alimentos para Deportistas" que se rotule, adjunte o relacione con el producto no podrá sobrepasar las cantidades máximas por día que se indican en cada caso.
Ingrediente alimentario Cantidad máxima
por día
Raíz de Panax Ginseng C.A. Meyer
(Ginseng Coreano, Ginseng
Asiático o Ginseng Oriental)
1,0 g de raíz
Fruto de Schizandra Chinesis
(Turcz.)
Baill. (Chisandra) 1,5 g de fruto
Raíz y risoma de Eleuterococcus
Senticosus Rupr. et Maxim.
(Ginseng Siberiano) 2,0 g de raíz y
rizoma
Si estos ingredientes se incorporan en forma de extractos, éstos deberán ser apropiados para uso en alimentos y su concentración máxima deberá ser calculada considerando la equivalencia del contenido especificado en cada una de las formas incluidas en esta tabla.
En los alimentos que contengan una o más de estas hierbas, el contenido máximo de cafeína en el producto listo para el consumo será de 54 mg. por porción de consumo habitual y no más de 180 mg. de cafeína/litro en los alimentos que se consumen líquidos y de 90 mg/100 g. en los que se consumen sólidos.
NOTA:
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la presente modificación entrará en vigencia 30 días después de su publicación en el Diario Oficial.
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la presente modificación entrará en vigencia 30 días después de su publicación en el Diario Oficial.
NOTA 1:
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
El Art. segundo del DTO 68, Salud, publicado el 23.01.2006, dispuso que la modificación introducida al presente artículo rige a contar de 180 días después de su publicación.
Artículo 541.- Los alimentos para deportistasDTO 253, SALUD
Nº 1 D)
D.O. 20.01.2003 se etiquetarán conforme a las disposiciones relativas a etiquetado general y según lo dispuesto en los artículos 110 y 540 de este Reglamento.
Nº 1 D)
D.O. 20.01.2003 se etiquetarán conforme a las disposiciones relativas a etiquetado general y según lo dispuesto en los artículos 110 y 540 de este Reglamento.
Los que tengan adición de: aminoácidos, L- carnitina, colina, inosina, ubiquinona, creatina, hierbas o extractos de Panax ginseng C.A. Meyer, Schizandra chinesis (Turcz.) Baill., Eleuterococcus senticosus Rupr. et Maxim, o que su contenido de cafeína sea mayor a 180 mg/l. en los alimentos líquidos y en los sólidos mayor a 90 mg/100 g., deberán incluir una leyenda que diga: "NO RECOMENDABLE PARA MENORES DE 15 AÑOS, EN EMBARAZO NI LACTANCIA" en letras mayúsculas y negrita (destacado).
INCISO DEROGADODTO 57, SALUD
Art. único Nº 14
D.O. 06.05.2005
Art. único Nº 14
D.O. 06.05.2005
NOTA:
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la presente modificación entrará en vigencia 30 días después de su publicación en el Diario Oficial.
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la presente modificación entrará en vigencia 30 días después de su publicación en el Diario Oficial.
NOTA 1:
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
El artículo transitorio del DTO 57, Salud, publicado el 06.05.2005, dispone que las modificaciones a la presente norma entrarán en vigencia dieciocho meses después de su publicación.
TITULO XXXDTO 287,SALUD
Art. 2º
D.O. 18.02.2002
Art. 2º
D.O. 18.02.2002
De las Sanciones
Artículo 542.- Las infracciones a las disposicionesDTO 253, SALUD
Nº 1 C)
D.O. 20.01.2003 del presente reglamento serán sancionadas por los Servicios de Salud en cuyo territorio se hayan cometido, previa instrucción del respectivo sumario, en conformidad con lo establecido en el Libro X del Código Sanitario.
Nº 1 C)
D.O. 20.01.2003 del presente reglamento serán sancionadas por los Servicios de Salud en cuyo territorio se hayan cometido, previa instrucción del respectivo sumario, en conformidad con lo establecido en el Libro X del Código Sanitario.
NOTA:
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la modificación introducida al presente artículo entrará en vigencia 30 días después de su publicación en el Diario Oficial.
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la modificación introducida al presente artículo entrará en vigencia 30 días después de su publicación en el Diario Oficial.
TITULO FINAL.
Artículo 543.- El presente reglamento entrará enDTO 253, SALUD
Nº 1 C)
D.O. 20.01.2003 vigencia ciento ochenta días después de su publicación en el Diario Oficial, fecha en que se entenderán derogados el decreto supremo N° 60, del 5 de abril de 1982, del Ministerio de Salud y sus modificaciones, así como cualquier otra norma, resolución o disposición que fuera contraria o incompatible con las contenidas en este decreto supremo.
Nº 1 C)
D.O. 20.01.2003 vigencia ciento ochenta días después de su publicación en el Diario Oficial, fecha en que se entenderán derogados el decreto supremo N° 60, del 5 de abril de 1982, del Ministerio de Salud y sus modificaciones, así como cualquier otra norma, resolución o disposición que fuera contraria o incompatible con las contenidas en este decreto supremo.
NOTA:
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la modificación introducida al presente artículo entrará en vigencia 30 días después de su publicación en el Diario Oficial.
El Art. transitorio del DTO 253, Salud, publicado el 20.01.2003, dispuso que la modificación introducida al presente artículo entrará en vigencia 30 días después de su publicación en el Diario Oficial.
Artículo Transitorio.- Sin perjuicio de lo dispuesto en el artículo anterior, la autoridad sanitaria podrá, por resolución fundada, autorizar la comercialización de productos alimenticios que no cumplan con las disposiciones de este reglamento, por un plazo máximo de un año, contado desde la fecha de su publicación.
Anótese, tómese razón, publíquese en el Diario Oficial e insértese en la Recopilación de Reglamentos de la Contraloría General de República.- EDUARDO FREI RUIZ-TAGLE, Presidente de la República.- Carlos Massad A., Ministro de Salud.
Lo que transcribo a Ud., para su conocimiento.- Saluda atentamente a Ud., Fernando Muñoz Porras, Subsecretario de Salud.