Decreto 8 EXENTO
Navegar Norma
Decreto 8 EXENTO
Decreto 8 EXENTO MODIFICA EL DECRETO Nº 500 EXENTO DE 2012, DEL MINISTERIO DE SALUD, QUE APRUEBA LA NORMA TÉCNICA Nº 136, NOMINADA "NORMA QUE DETERMINA LOS PRINCIPIOS ACTIVOS CONTENIDOS EN LOS PRODUCTOS FARMACÉUTICOS QUE DEBEN DEMOSTRAR SU EQUIVALENCIA TERAPÉUTICA Y LISTA DE PRODUCTOS FARMACÉUTICOS QUE SIRVEN DE REFERENCIA DE LOS MISMOS"
MINISTERIO DE SALUD; SUBSECRETARÍA DE SALUD PÚBLICA
MODIFICA EL DECRETO Nº 500 EXENTO DE 2012, DEL MINISTERIO DE SALUD, QUE APRUEBA LA NORMA TÉCNICA Nº 136, NOMINADA "NORMA QUE DETERMINA LOS PRINCIPIOS ACTIVOS CONTENIDOS EN LOS PRODUCTOS FARMACÉUTICOS QUE DEBEN DEMOSTRAR SU EQUIVALENCIA TERAPÉUTICA Y LISTA DE PRODUCTOS FARMACÉUTICOS QUE SIRVEN DE REFERENCIA DE LOS MISMOS"
Núm. 8 exento.- Santiago, 29 de enero de 2024.
Vistos:
Lo dispuesto en el artículo 4º del Libro I del decreto con fuerza de ley Nº 1 de 2005, del Ministerio de Salud, que fija el texto refundido, coordinado y sistematizado del decreto ley Nº 2.763, de 1979 y de las leyes 18.469 y 18.933; el Código Sanitario; en el decreto supremo Nº 136 de 2004, del Ministerio de Salud, Reglamento Orgánico del Ministerio de Salud; las disposiciones del artículo 52º y aquellas del inciso 1º del artículo 221º contenidas en el decreto supremo Nº 3 de 2010, del Ministerio de Salud, Reglamento del Sistema Nacional de Control de Productos Farmacéuticos de Uso Humano; el decreto exento Nº 500 de 2012, del Ministerio de Salud, que aprobó la norma técnica Nº 136, nominada "Norma que determina los principios activos contenidos en los productos farmacéuticos que deben demostrar su equivalencia terapéutica y lista de productos farmacéuticos que sirven de referencia de los mismos"; los memorándums B35 Nº 463 y Nº 602, ambos del año 2023, de la División de Políticas Públicas Saludables y Promoción, de la Subsecretaría de Salud Pública; el ordinario Nº 656, de 10 de agosto de 2023, del Instituto de Salud Pública de Chile; y la resolución Nº 7, de 2019, de la Contraloría General de la República, que fija normas sobre exención del trámite de toma de razón; y
Considerando:
1º. Que, al Ministerio de Salud le compete ejercer la función que corresponde al Estado de garantizar el libre e igualitario acceso a las acciones de promoción, protección y recuperación de la salud y de rehabilitación de la persona enferma, así como coordinar, controlar y cuando corresponda ejecutar tales acciones.
2º. Que, conforme al artículo 94° del Código Sanitario, al Ministerio de Salud le compete velar por el acceso de la población a medicamentos o productos farmacéuticos de calidad, seguridad y eficacia.
3º. Que, los productos farmacéuticos constituyen una de las herramientas terapéuticas más utilizadas en la práctica de la medicina, transformándolos en un bien esencial para el desarrollo de los países y cuyo uso de manera apropiada permite la obtención de importantes beneficios sanitarios representados en la prevención, diagnóstico, curación, atenuación y tratamiento de las enfermedades y sus síntomas.
4º. Que, se entenderá por producto farmacéutico o medicamento cualquier substancia natural, biológica, sintética o las mezclas de ellas, originada mediante síntesis o procesos químicos, biológicos o biotecnológicos, que se destine a las personas con fines de prevención, diagnóstico, atenuación, tratamiento o curación de las enfermedades o sus síntomas o de regulación de sus sistemas o estados fisiológicos particulares, incluyéndose en este concepto los elementos que acompañan su presentación y que se destinan a su administración (artículo 95 del Código Sanitario).
5º. Que, el artículo 221, inciso 1º, del Reglamento del Sistema Nacional de Control de Productos Farmacéuticos de Uso Humano, dispone que "El Ministerio de Salud, mediante decreto, aprobará la norma técnica que determine los productos que requieren demostrar su equivalencia terapéutica, estableciendo las listas de los principios activos y de los productos farmacéuticos que servirán de referencia de los mismos, cuando corresponda; lo que podrá hacer a proposición del Instituto".
6º. Que, en razón de lo indicado, el Ministerio de Salud dictó el decreto exento Nº 500, de fecha 1 de junio de 2012, mediante el cual se aprobó la norma técnica Nº 136, nominada "Norma que determina los principios activos contenidos en los productos farmacéuticos que deben demostrar su equivalencia terapéutica y lista de productos farmacéuticos que sirven de referencia de los mismos".
7º. Que, a su turno, mediante el oficio ordinario B35/ Nº 6042, de fecha 30 de diciembre de 2022, la Subsecretaría de Salud Pública informó al Instituto de Salud Pública de Chile la intención de avanzar sustantiva y sosteniblemente en las diversas políticas asociadas al acceso a medicamentos de calidad y seguridad garantizadas, estableciendo la necesidad de propiciar una base normativa solvente que permita dar sustento a las diferentes iniciativas que pudieran plantearse; contexto en el cual le solicitó realizar acciones preparativas para avanzar específicamente en Equivalencia Terapéutica (EQT) de Medicamentos.
8º. Que, a través del precitado decreto se estableció la exigencia de demostración de Equivalencia Terapéutica a 438 principios activos/asociaciones contenidas en productos farmacéuticos sólidos orales junto con los productos de referencia. Sin embargo, varios de estos productos de referencia ya no se encuentran disponibles en el país, requiriendo por consiguiente su actualización.
9º. Que, con el objetivo de avanzar en la política de intercambiabilidad y ampliar la disponibilidad de productos con certificación de Equivalencia Terapéutica, el Instituto de Salud Pública de Chile presentó, a través del ordinario Nº 656, de 2023, un listado de productos de referencia voluntarios destinados a los estudios de equivalencia terapéutica, y un segundo grupo de productos ya certificados como equivalentes terapéuticos que podrán ser utilizados como referencia en los estudios comparativos de principios activos/asociaciones que ya cuentan con la exigencia de demostrar equivalencia terapéutica.
10º. Que, en dicho contexto, el Instituto de Salud Pública de Chile, publicó la "Guía Técnica de Metodología y Criterios para la Selección y Propuesta de Productos de Referencia para Estudios de Bioequivalencia", aprobada mediante la resolución exenta Nº 1.645/23, con el fin de contar con una herramienta para proponer productos de referencia y actualización en el tiempo al Ministerio de Salud.
11º. Que, con la finalidad de avanzar en la política de intercambiabilidad y aumentar el alcance en cuanto a la disponibilidad de productos con certificación de Equivalencia Terapéutica, el Instituto de Salud Pública de Chile, mediante ordinario Nº DD 335, de fecha 9 de mayo de 2023, propuso un primer listado de productos farmacéuticos de referencia para los estudios voluntarios de Equivalencia Terapéutica.
12º. Que, mediante el decreto exento Nº 51, de fecha 3 de noviembre de 2023, del Ministerio de Salud, que modificó el decreto exento ya individualizado en el considerando sexto, se incorporaron a la "Lista de Productos de Referencia para los Estudios de Equivalencia Terapéutica" un total de 131 principios activos en monodroga o asociaciones a dosis fija.
13º. Que, posteriormente, a través de ordinario DD Nº 656, de fecha 10 de agosto de 2023, el Instituto de Salud Pública de Chile propuso para su tramitación un segundo listado de productos farmacéuticos de referencia para la realización voluntaria de estudios de EQT, incorporando un total de 101 principios activos (en monodroga o asociaciones a dosis fija) y un tercer listado de productos de referencia para principios activos/asociaciones que ya están afectos a la exigencia de demostración de Equivalencia Terapéutica.
14º. Que, mediante los memorándums B35 Nº 463 y Nº 602, ambos del año 2023, la Jefa de la División de Políticas Públicas Saludables y Promoción, de la Subsecretaría de Salud Pública, informó que los referidos listados fueron evaluados por su Departamento de Políticas y Regulaciones Farmacéuticas, Prestadores de Salud y Medicinas Complementarias, en conjunto con personeros de la Agencia Nacional de Medicamentos del Instituto de Salud Pública; habiendo sido estos perfeccionados con miras a privilegiar la accesibilidad de los productos de referencia, empleando para ello las indicaciones contenidas en la "Guía Técnica de criterios para la selección y propuesta de productos de referencia para estudios de bioequivalencia", priorizando la designación de los productos de referencia con registro sanitario vigentes en Chile; todo ello con miras a posibilitar la accesibilidad a los productos de referencia para la realización de estudios de Equivalencia Terapéutica.
15°. Que, por lo antes expuesto, dicto el siguiente:
Decreto:
Artículo primero.- Modifícase el decreto exento Nº 500, de 1 de junio de 2012, del Ministerio de Salud, que aprobó la Norma Técnica Nº 136, que "Determina los principios activos contenidos en los productos farmacéuticos que deben demostrar su equivalencia terapéutica y lista de productos farmacéuticos que sirven de referencia de los mismos", en la forma que se indica a continuación:
a) Agrégase a la "Lista de Productos de Referencia para los Estudios de Equivalencia Terapéutica" los siguientes productos de referencia:
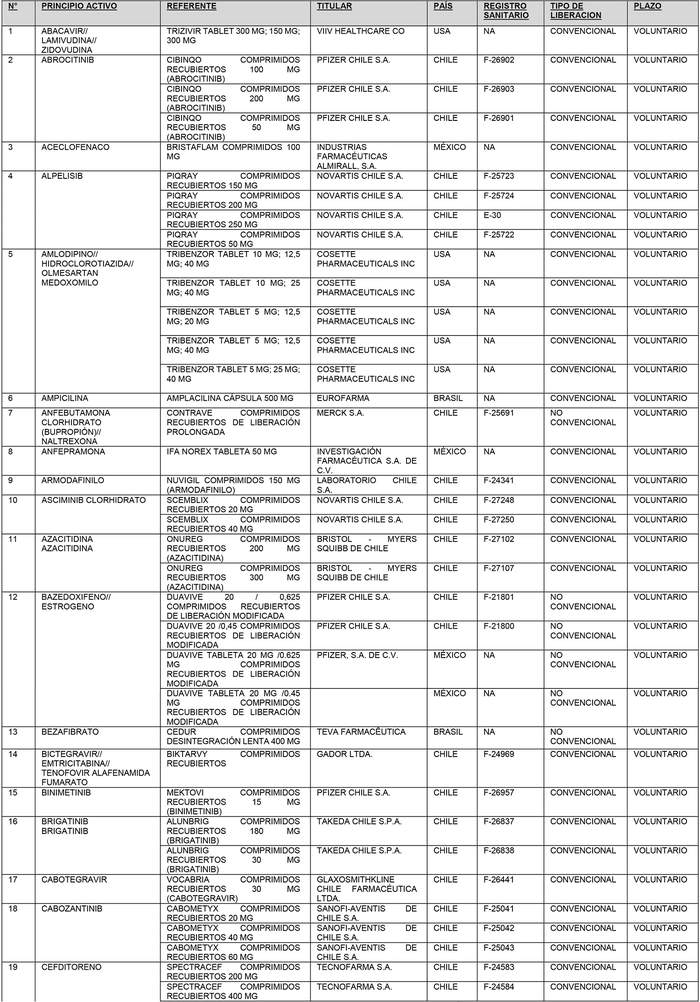
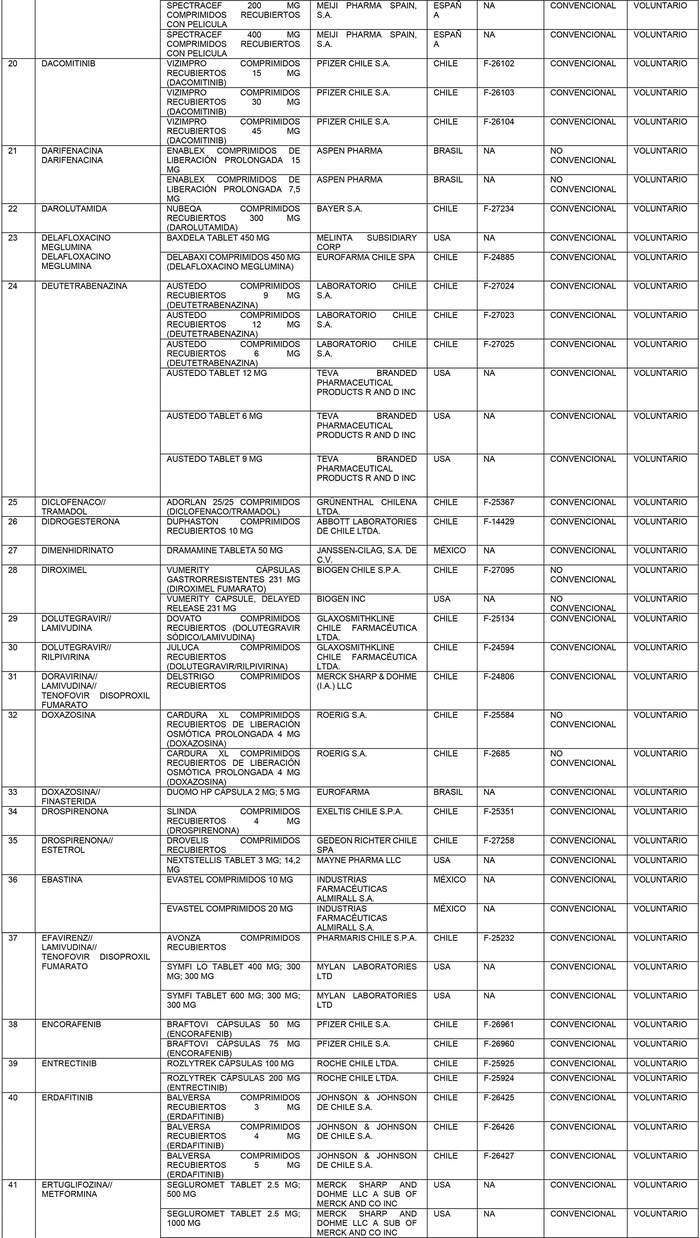
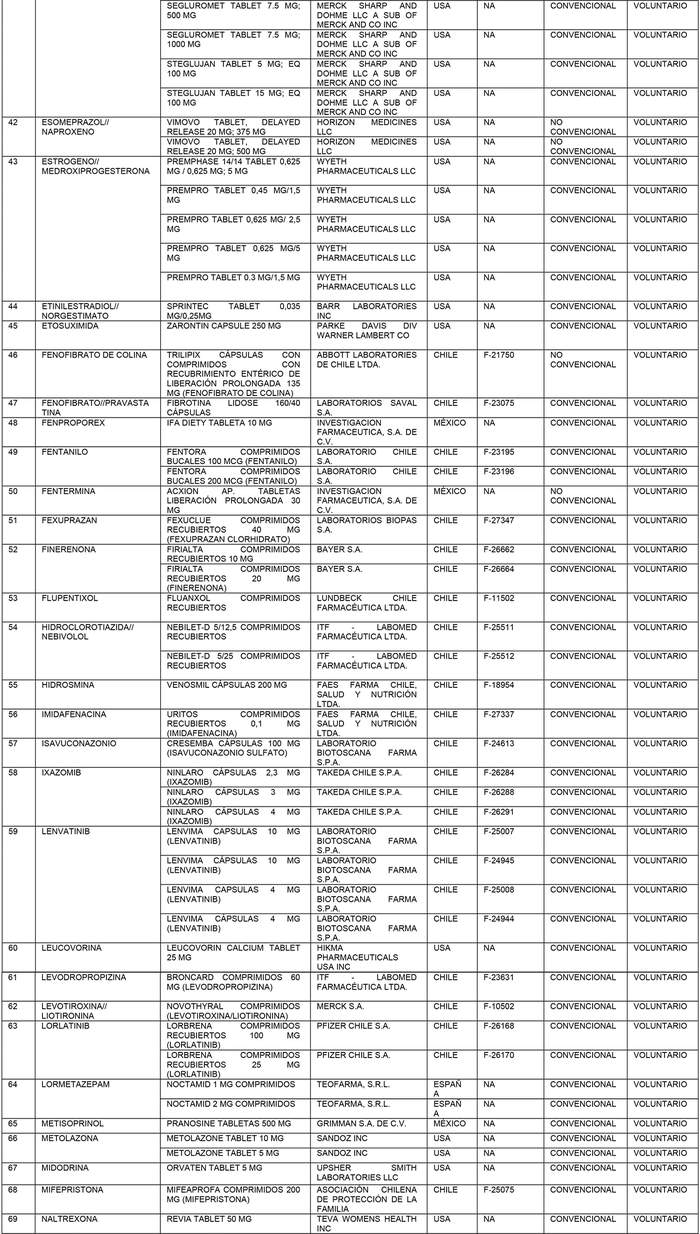
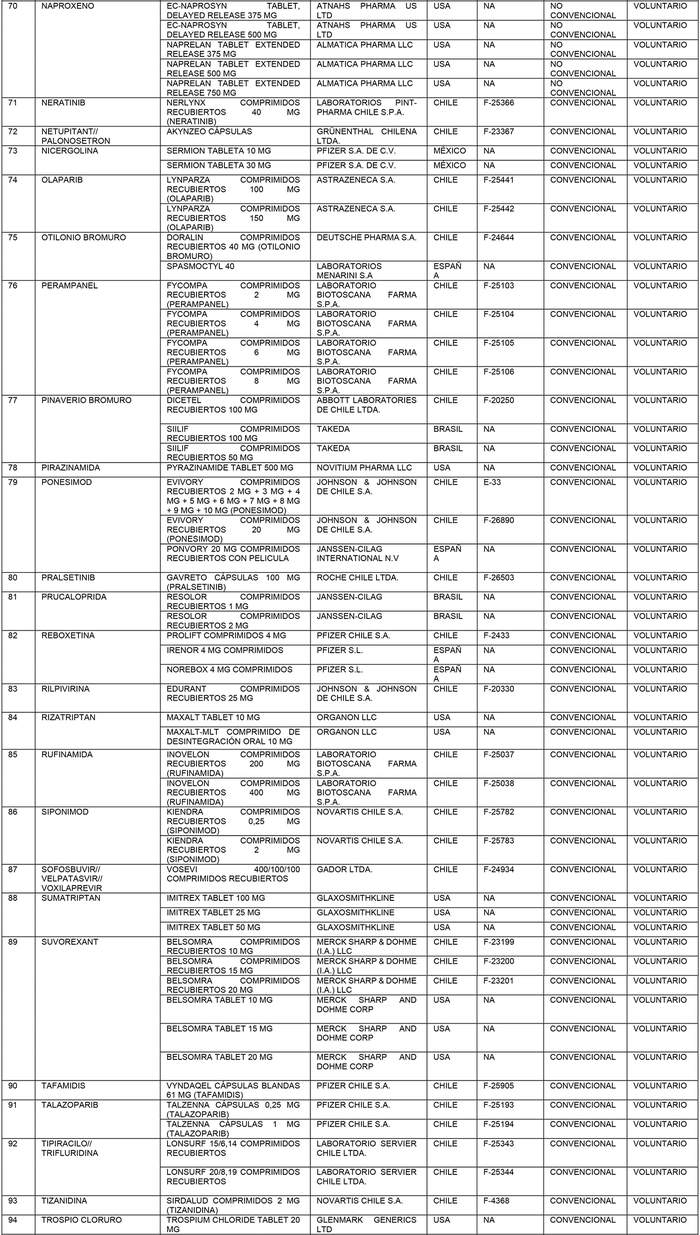
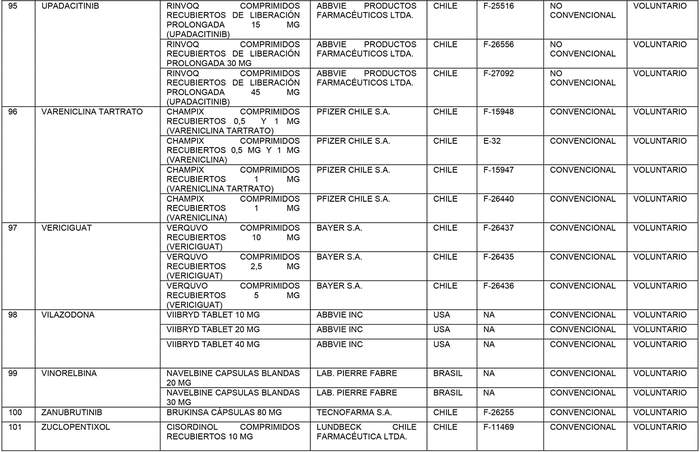
b) Actualícese la "Lista de Productos que sin perder su condición de Bioequivalente en Chile, podrán ser empleados como productos de referencia para los estudios de Equivalencia Terapéutica", en la forma que se indica a continuación:
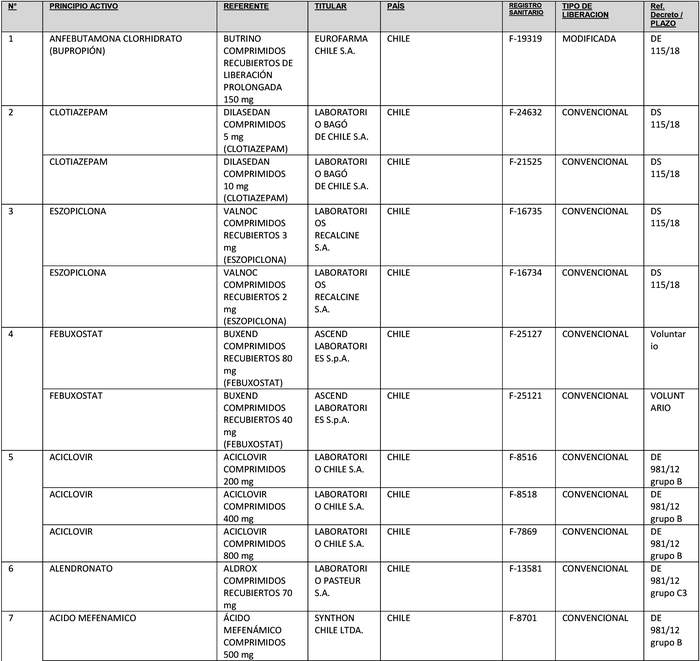
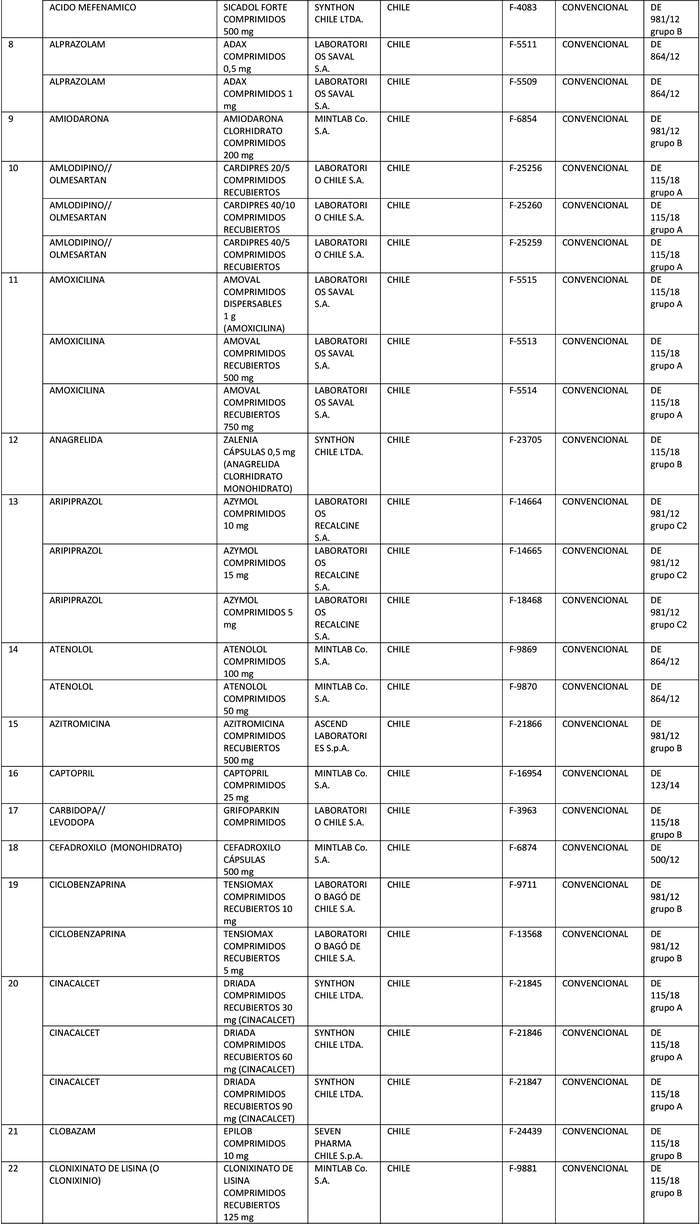
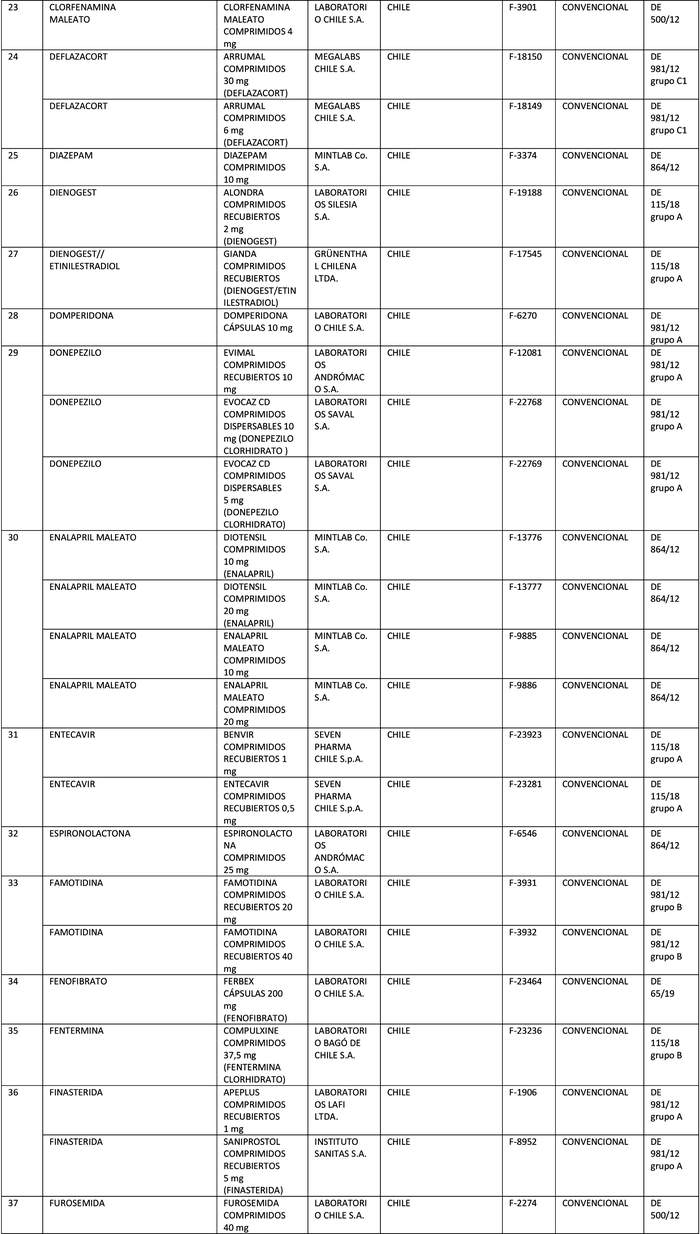
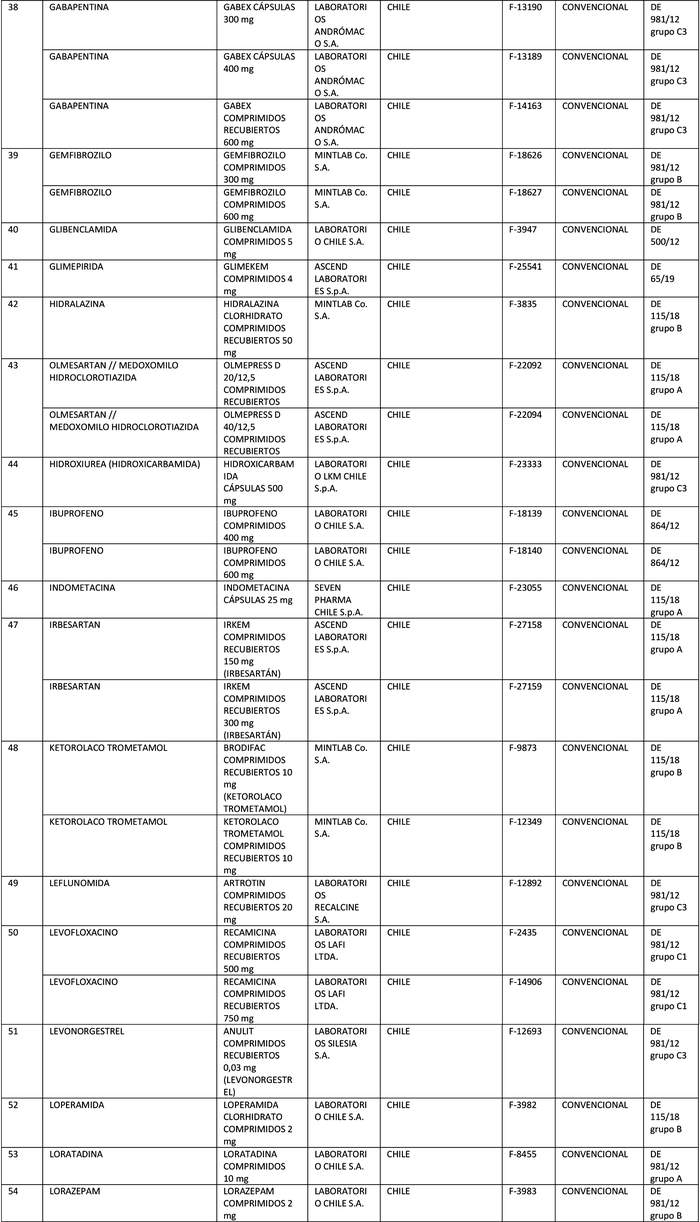
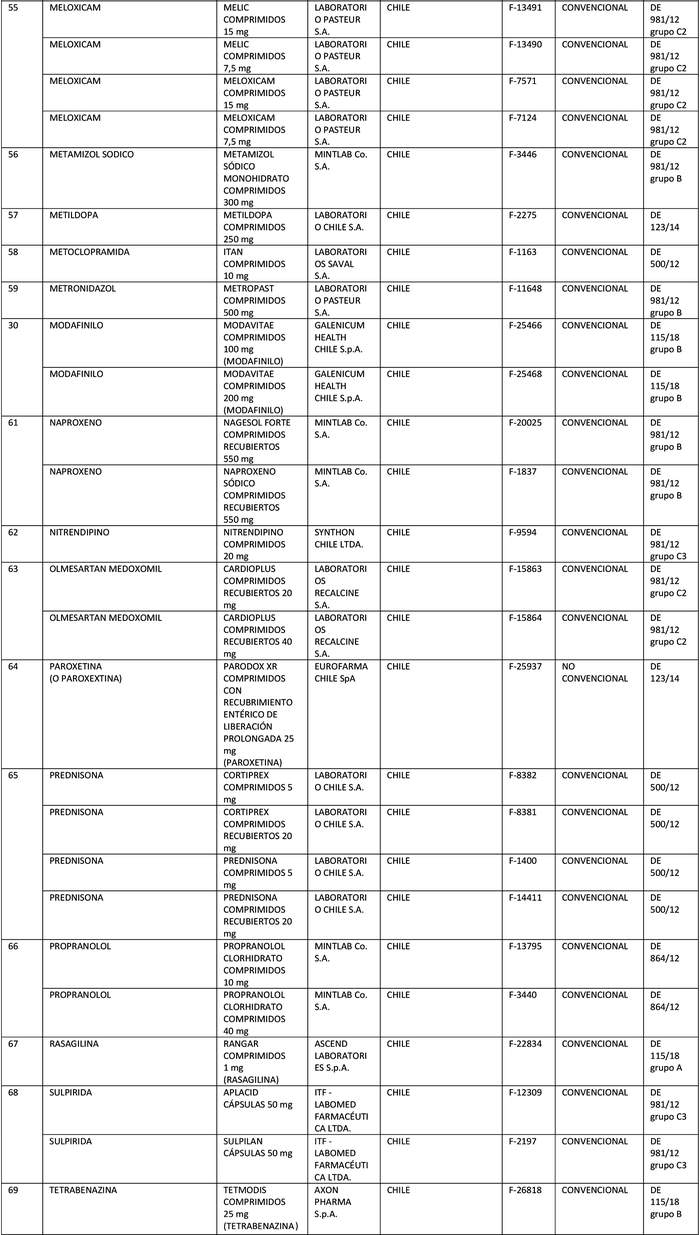
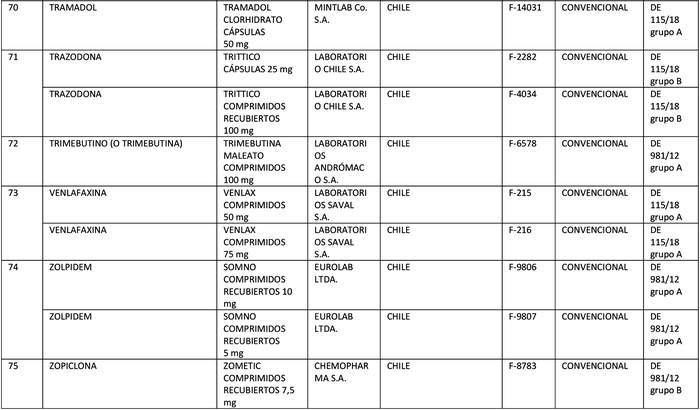
Artículo segundo.- Un texto actualizado de las normas, conteniendo las modificaciones que se aprueban en este decreto y las anteriores realizadas, se mantendrá en el Departamento de Políticas Farmacéuticas y Profesiones Médicas de la División de Políticas Públicas Saludables y Promoción de la Subsecretaría de Salud Pública, entidad que a su vez deberá velar por su oportuna publicación en la página web del Ministerio de Salud, www.minsal.cl, para su adecuado conocimiento y difusión, debiendo además asegurar que las copias y reproducciones que se emitan guarden estricta concordancia con el texto aprobado.
Artículo tercero.- Las disposiciones de este decreto regirán desde su publicación en el Diario Oficial.
Anótese, comuníquese y publíquese.- Por orden del Presidente de la República, Ximena Aguilera Sanhueza, Ministra de Salud.
Transcribo para su conocimiento decreto exento Nº 8, 29 de enero 2024. Modifica decreto exento Nº 500 del 2012.- Por orden de la Subsecretaría de Salud Pública.- Saluda atentamente a Ud., Yasmina Viera Bernal, Jefa de la División Jurídica, Ministerio de Salud.
| Tipo Versión | Desde | Hasta | Modificaciones | |
|---|---|---|---|---|
|
Única
De 08-FEB-2024
|
08-FEB-2024 |
Comparando Decreto 8 EXENTO |
Loading...